El diagnóstico de insuficiencia renal aguda (IRA) todavía se basa en la creatinina sérica y la diuresis. Sin embargo, el incremento de la creatinina a menudo se retrasa 48 h o más con respecto al momento de la lesión. El objetivo de este estudio es determinar la utilidad de las pruebas analíticas de función renal habituales en el postoperatorio, para predecir la IRA con uno o 2días de antelación, en una cohorte de pacientes intervenidos mediante cirugía cardíaca.
Pacientes y métodosA partir de una base de datos prospectiva, se seleccionó una muestra de pacientes operados de cirugía cardíaca mayor, entre enero de 2002 y diciembre de 2013. La definición de IRA se basó en el criterio de la creatinina sérica utilizado por la Acute Kidney Injury Network. La cohorte de 3.962 casos se dividió en 2grupos de tamaño similar, uno exploratorio y otro de validación. El grupo exploratorio se utilizó para demostrar los objetivos principales y el de validación para confirmar los resultados. La capacidad de predicción de la IRA, de varios parámetros de función renal medidos en la analítica postoperatoria habitual, se evaluó utilizando curvas ROC tiempo-dependientes. Como variable principal se consideró el tiempo transcurrido desde la medida del marcador hasta el diagnóstico de la IRA.
ResultadosSe observaron 610 (30,8%) y 623 (31,4%) episodios de IRA en los grupos exploratorio y de validación, respectivamente. La tasa de filtrado glomerular estimada por la ecuación MDRD-4 demostró la mejor capacidad predictiva de IRA, con valores del área bajo la curva ROC entre 0,700 y 0,946. Se calcularon distintos puntos de corte para dicho parámetro, en función de la gravedad de la IRA y del tiempo transcurrido entre la cirugía y su medición. Los resultados obtenidos se confirmaron en el grupo de validación.
ConclusiónLa tasa de filtrado glomerular postoperatoria, estimada por la ecuación MDRD-4, mostró una alta capacidad de predicción de IRA con uno o 2días de antelación, en pacientes operados de cirugía cardíaca.
and objective Acute kidney injury (AKI) diagnosis is still based on serum creatinine and diuresis. However, increases in creatinine are typically delayed 48h or longer after injury. Our aim was to determine the utility of routine postoperative renal function blood tests, to predict AKI one or 2days in advance in a cohort of cardiac surgery patients.
Patients and methodsUsing a prospective database, we selected a sample of patients who had undergone major cardiac surgery between January 2002 and December 2013. The ability of the parameters to predict AKI was based on Acute Kidney Injury Network serum creatinine criteria. A cohort of 3,962 cases was divided into 2groups of similar size, one being exploratory and the other a validation sample. The exploratory group was used to show primary objectives and the validation group to confirm results. The ability to predict AKI of several kidney function parameters measured in routine postoperative blood tests, was measured with time-dependent ROC curves. The primary endpoint was time from measurement to AKI diagnosis.
ResultsAKI developed in 610 (30.8%) and 623 (31.4%) patients in the exploratory and validation samples, respectively. Estimated glomerular filtration rate using the MDRD-4 equation showed the best AKI prediction capacity, with values for the AUC ROC curves between 0.700 and 0.946. We obtained different cut-off values for estimated glomerular filtration rate depending on the degree of AKI severity and on the time elapsed between surgery and parameter measurement. Results were confirmed in the validation sample.
ConclusionsPostoperative estimated glomerular filtration rate using the MDRD-4 equation showed good ability to predict AKI following cardiac surgery one or 2days in advance.
La insuficiencia renal aguda asociada a la cirugía cardíaca (IRA-ACC) ha sido objeto de gran atención en los últimos años1,2. Pese a su origen multifactorial, la IRA-ACC presenta algunas características que hacen que su estudio sea de gran interés: una incidencia elevada, un momento de lesión conocido, una epidemiología bien detallada y varios modelos de predicción precisos y validados basados en factores de riesgo bien definidos3,4. Por dicho motivo, los pacientes de cirugía cardíaca constituyen una población frecuente en los estudios de biomarcadores de lesión renal aguda.
En la última década han aparecido nuevos biomarcadores5, algunos de los cuales han sido ampliamente probados6-8. Sin embargo, a pesar de más de 10años de intensa investigación, los nuevos biomarcadores de lesión renal aguda todavía no están listos para su uso clínico. Los clínicos que se enfrentan a este síndrome todavía carecen de una herramienta terapéutica que pueda ayudar a sus pacientes. El estudio de la capacidad predictiva de estos biomarcadores en diferentes escenarios, incluyendo la cirugía cardíaca (CC), ha proporcionado una gran cantidad de resultados hasta ahora desconocidos. Desafortunadamente, ninguno de ellos ha alcanzado la fase clínica9, y el diagnóstico y la discriminación todavía se basan en la creatinina sérica (Crs) y la diuresis.
La tasa de filtrado glomerular estimada (TFGe) basada en la Crs ya ha sido centro de investigación en el ámbito de IRA-ACC10. La capacidad de la TFGe preoperatoria para predecir la necesidad de terapia renal sustitutiva (TRS) en el postoperatorio es superior a la de la Crs11, y está asociada de forma independiente con otros resultados negativos como son la hospitalización prolongada o la mortalidad intrahospitalaria12. En este estudio planteamos la hipótesis de que la TFGe postoperatoria puede ser útil como predictor precoz de un episodio de IRA tras CC. Para demostrar esta hipótesis, estudiamos la capacidad predictiva de varios parámetros habituales que miden la función renal tras la intervención, en una cohorte de pacientes operados de CC. En concreto se han evaluado: la TFGe mediante la fórmula MDRD-4 (Modification of Diet in Renal Disease 4variable), la concentración de urea y sus respectivos cambios, como biomarcadores para predecir la IRA con uno o 2días de antelación. Como definición de biomarcador se ha considerado la establecida por el grupo Biomarkers Definition Working Group13.
MétodosDiseño del estudio y poblaciónEstudio retrospectivo de una cohorte llevado a cabo en un hospital terciario universitario de referencia. Los datos de cada paciente adulto operado de CC y admitido en la Unidad de Cuidados Intensivos (UCI) de cirugía cardíaca se registraron de forma prospectiva en la base de datos del Servicio de Anestesia y Reanimación. En este estudio solo se consideraron los pacientes tratados mediante intervenciones quirúrgicas mayores entre el 1 de enero de 2002 y el 31 de diciembre de 2013. Se incluyeron las siguientes cirugías: revascularización miocárdica, cirugía valvular de reparación o reemplazo, procedimientos combinados (revascularización miocárdica + cirugía valvular) y la cirugía de aorta. Se han excluido las reparaciones complejas de las cardiopatías congénitas, las pericardiectomías y los procedimientos de implantación de la válvula aórtica transcatéter. También se excluyó a los pacientes con enfermedad renal crónica que recibían cualquier forma de TRS antes de la cirugía, los receptores de trasplante renal, los casos de muerte postoperatoria temprana (<24h), los pacientes que necesitaban un dispositivo de asistencia ventricular izquierda y los pacientes sin el valor basal de la Crs o sin la fecha de inicio de la TRS postoperatoria. En los pacientes con más de una intervención quirúrgica mayor en el mismo ingreso, solo se consideró la primera cirugía. Un pequeño grupo de pacientes incluidos en el estudio fue operado 2o más veces en ingresos distintos a lo largo del período de 12años. El estudio fue aprobado por el Comité de Ética Institucional. Dado su carácter retrospectivo, no se solicitó el consentimiento informado a los pacientes.
Definiciones y variable principalSe definió la IRA siguiendo el criterio de la Crs establecido por la Acute Kidney Injury Network (AKIN)14, considerando 3categorías distintas de gravedad. Los pacientes se asignaron siempre a la categoría de mayor gravedad. La función renal basal se evaluó mediante la Crs preoperatoria, tomada como el valor más próximo a la fecha de la intervención. Se consideró como día 0 el día del ingreso en la UCI después de la cirugía. La Crs de cada paciente se midió al menos una vez al día mientras estaba en la UCI y, solo si era clínicamente necesario, durante el postoperatorio en planta. Para el diagnóstico de IRA-ACC solo se consideraron los valores de la Crs medidos durante la primera semana postoperatoria.
Dado que la elevación de la Crs suele producirse entre uno y 3días después de la intervención, el objetivo de este estudio fue evaluar la capacidad de predicción de un episodio de IRA a partir de parámetros de función renal, bien medidos en pruebas analíticas rutinarias, o bien calculados con uno o 2días de antelación. En concreto, se analizaron la urea sérica, la TFGe MDRD-415, es decir:
TFGe MDRD-4 = 175×(Crs/88,4)−1,154×(edad)−0,203×(0,742 si mujer)×(1,212 si raza negra) y sus respectivos cambios en el tiempo: aumento de urea (Δurea) y disminución de TFGe MDRD-4 (ΔMDRD-4). La variable principal es el tiempo transcurrido desde que se miden los biomarcadores hasta el diagnóstico de IRA.
Análisis estadísticoSe realizó un análisis descriptivo de la frecuencia de IRA y su clasificación por gravedad, durante la primera semana tras la intervención. Se compararon las características clínicas y los factores de riesgo de los grupos con y sin IRA utilizando los métodos estadísticos estándar: el test de la t de Student o de Mann-Whitney para comparar variables continuas y el test de la chi-cuadrado o la prueba exacta de Fisher para comparar proporciones. Los datos se resumen en términos de medias (desviación típica), medianas (rango intercuartílico) o proporciones (frecuencias absolutas y relativas), según corresponda. Se ha considerado como estadísticamente significativo un valor de p < 0,05.
La muestra total se dividió aleatoriamente en 2submuestras de tamaño similar. La primera muestra (exploratoria) se utilizó para realizar el análisis principal y la segunda, para validar los resultados. Con el fin de garantizar que ambas muestras presentaran un número similar de episodios de IRA, se llevó a cabo una asignación aleatorizada por bloques, considerando el valor de la Crs basal con 2niveles, normal y alto, como factor bloque («blocking factor») para conseguir grupos homogéneos. Los casos fueron asignados a la categoría normal si el valor de su Crs basal era inferior al percentil 75 (93,7μmol/l para las mujeres y 111,38μmol/l para los hombres) o a la categoría alta en caso contrario. Se eligió la Crs basal como factor bloque porque esta variable ya mostró una importante asociación con el desarrollo de IRA tras la CC en un modelo predictivo3 previamente validado en nuestra institución16. Se calcularon las curvas ROC tiempo-dependientes para evaluar la capacidad de cada parámetro para predecir un episodio de IRA con uno o 2días de antelación17. La curva ROC constituye una de las mejores herramientas estadísticas para describir la capacidad de discriminación de una prueba diagnóstica cuando el valor de dicha prueba se mide en escala continua u ordinal y el resultado en escala binaria (evento/no evento)18. La información de una prueba diagnóstica va de nula a perfecta y sus correspondientes áreas bajo la curva —AUC «area under the curve»— toman valores dentro del intervalo (0,5; 1). Cuanto mayor sea el AUC, mejor será la capacidad de discriminación de la prueba. Si el área es mayor que 0,7, se puede concluir que el test, marcador o modelo tiene un poder discriminatorio aceptable19. Sin embargo, en nuestro estudio, la variable principal no es binaria, sino el tiempo hasta un evento, definido como el tiempo que transcurre desde que se mide el parámetro hasta el diagnóstico de IRA. Por lo tanto, para este tipo de datos deben considerarse otras definiciones de sensibilidad y especificidad20. En este estudio se consideran las definiciones de sensibilidad acumulada y especificidad dinámica propuestas por Heagerty et al.17. Fijado un tiempo después de la intervención, aquellos pacientes que presentan IRA antes de dicho tiempo se definen como casos (servirán para estimar la sensibilidad acumulada), mientras que el resto se consideran como controles (se utilizarán para estimar la especificidad dinámica). Esto significa que el estado de cada paciente puede cambiar de control a caso dependiendo del tiempo que se haya prefijado. A diferencia de lo que ocurre en un estudio de diagnóstico, en este caso, en el momento en que se mide el parámetro, se asume que todos los pacientes son controles18, por lo tanto, los valores de los parámetros en pacientes con IRA en este momento, si los hay, no se tendrán en cuenta en el análisis.
Para analizar la capacidad predictiva de cada parámetro se tuvieron en cuenta las 3categorías de IRA, i (leve), ii (moderada) y iii (grave), así como los días transcurridos desde la cirugía hasta la medición del biomarcador (el día de la cirugía, un día después y 2días después de la cirugía). Para cada parámetro y para cada día transcurrido después de la cirugía, se construyó una curva ROC tiempo-dependiente utilizando el paquete survivalROC del software estadístico R17. La información obtenida en las distintas curvas ROC se resume tanto a través de sus AUC como de las sensibilidades asociadas a unos valores fijos de especificidad. Para poder extrapolar los resultados obtenidos a toda la población de la cual se ha extraído la muestra, se calcularon los intervalos de confianza (IC) para dichas AUC mediante el método bootstrap. También se proporcionan los puntos de corte óptimos con sus correspondientes especificidades, fijado un valor concreto de sensibilidad.
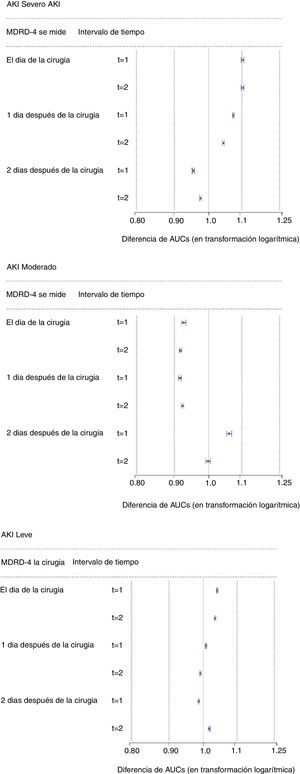
Por último, se evaluó la capacidad predictiva de los parámetros en la segunda muestra (muestra de validación). Si los resultados obtenidos en esta muestra son equivalentes a los resultados obtenidos en la muestra exploratoria, entonces podemos estar seguros acerca de su fiabilidad y reproducibilidad. El método más simple y utilizado para probar la equivalencia es la doble prueba unilateral («two one side test») propuesta por Shuirmann21. La equivalencia queda demostrada cuando el IC del 90% para la diferencia de AUC está dentro de los límites de aceptación (0,8-1,2) (los límites serían [0,8-1,25] si se considera la transformación logarítmica). Para construir el IC, se seleccionaron 500 muestras bootstrap de la muestra exploratoria y 500 muestras bootstrap de la muestra de validación y se calcularon sus correspondientes AUC. El IC se obtuvo mediante la función rtost del paquete equivalenc de R.
ResultadosEn este período de 12años se realizaron un total de 4.167 cirugías cardíacas mayores. Se excluyeron un total de 205 intervenciones (85 por tipo de cirugía realizada, 48 por TRS preoperatoria, 38 por muerte precoz, 19 por trasplante renal previo, 15 por ser segunda intervención en el mismo ingreso, 5 por falta de datos y 3 por ser casos de asistencia ventricular). Algunos pacientes cumplían más de un criterio de exclusión. De los 3.962 casos restantes, se seleccionó al azar una primera muestra exploratoria de 1.980 casos. En la tabla 1 se muestran las principales características demográficas y clínicas de esta muestra. La información correspondiente a la muestra de validación aparece en la tabla 1B del material adicional.
Principales características y factores de riesgo en la muestra exploratoria y su asociación con la aparición de IRA durante la primera semana del postoperatorio
| Características demográficas y factores de riesgo | Muestra exploratoria (n = 1.980) | IRA (n = 610) | No IRA (n = 1.370) | p |
|---|---|---|---|---|
| Edad (DT) en años | 67,4 (11,5) | 70,9 (9,9) | 65,9 (11,8) | <0,001 |
| Hombres en % | 57,5 | 57,4 | 57,5 | 0,961 |
| Euroscore estándar (DT) | 5,9 (2,9) | 7,2 (2,9) | 5,4 (2,7) | <0,001 |
| Historia de ICC en % | 20,8 | 29,3 | 17,3 | <0,001 |
| FEVI < 35% en % | 3,6 | 4,3 | 3,4 | 0,294 |
| EPOC en % | 7,0 | 9,5 | 5,9 | 0,001 |
| Cirugía cardíaca previa en % | 12,5 | 18,9 | 9,6 | <0,001 |
| Cirugía de emergencia en % | 3,0 | 4,3 | 2,5 | 0,046 |
| Tipo de cirugía en % | <0,001 | |||
| RM aislada | 30,4 | 24,4 | 33,0 | |
| Valvular | 51,3 | 53,6 | 50,3 | |
| Combinadaa | 9,7 | 13,8 | 8,0 | |
| Otras cirugíasb | 8,6 | 8,2 | 8,7 | |
| Tiempos de DCP (DT) en min | ||||
| De isquemia | 64,6 (34,5) | 72,4 (36,9) | 61,1 (32,8) | <0,001 |
| De perfusión | 89,0 (46,0) | 102,5 (51,6) | 83,0 (41,9) | <0,001 |
| Función renal preoperatoria | ||||
| Crs, media (DT) en μmol/l | 94,62 (31,05) | 107,36 (41,58) | 88,94 (22,8) | <0,001 |
| TFGe, media (DT) en ml/min/1,73 m2 | 70,4 (20,1) | 62,4 (22,4) | 73,9 (17,9) | <0,001 |
| TFGe < 60 ml/min/1,73 m2 en % | 31,3 | 49,3 | 21,2 | <0,001 |
Crs: creatinina sérica; DCP: derivación cardiopulmonar; DM: diabetes mellitus; DT: desviación típica; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección ventricular izquierda; ICC: insuficiencia cardíaca congestiva; RM: revascularización miocárdica; TFGe: tasa de filtración glomerular preoperatoria estimada por la ecuación MDRD-4.
La frecuencia de IRA y su gravedad en ambas muestras aparecen en la tabla 2.
Distribución de eventos/no eventos, en ambas muestras
| Muestra exploratoria | Muestra de validación | ||||
|---|---|---|---|---|---|
| Tipo | Frecuencia | Porcentaje | Frecuencia | Porcentaje | |
| Sin evento | 1.370 | 69,2 | 1.357 | 68,4 | |
| IRA | Leve I | 486 | 24,5 | 475 | 23,9 |
| Moderada II | 64 | 3,2 | 71 | 3,5 | |
| Grave III | 60 | 3,0 | 77 | 3,8 | |
| Total | 1.980 | 100 | 1.982 | 100 | |
p = 0,917 (test de chi-cuadrado).
Solo se muestran los resultados del mejor biomarcador (TFGe MDRD-4). Los resultados para el resto de los parámetros (urea, Δurea, ΔMDRD-4 y ΔCrs) se presentan como material adicional.
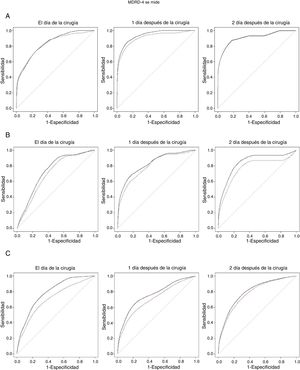
La figura 1 muestra las curvas ROC tiempo-dependientes correspondientes a las 3categorías de IRA, teniendo en cuenta además el tiempo transcurrido desde la cirugía. Las curvas representadas en la figura 1A se basan únicamente en la información proporcionada por los casos con IRA grave (AKIN estadio iii) y los controles, los casos con IRA moderada (AKIN estadio ii) y los controles en la figura 1B y, por último, los casos leves y los controles en la figura 1C. En estas curvas se han representado la estimación de la sensibilidad acumulada y de la especificidad dinámica de la TFGe MDRD-4. Las estimaciones se han calculado para la predicción con un día de anticipación (línea continua) y con 2días (línea punteada). Como puede observarse, la sensibilidad y la especificidad dependen no solo del periodo de tiempo entre la medición y el diagnóstico del evento, sino también del tiempo que ha transcurrido desde que se realizó la CC hasta la medición. Las predicciones a un día son siempre mejores (línea continua) y más aún cuando el valor de MDRD-4 se mide 2días después de la cirugía.
Curvas ROC tiempo-dependientes (acumulada/dinámica) en la muestra exploratoria. Casos de IRA frente a control: A) IRA grave (estadio iii). B) IRA moderada (estadio ii). C) IRA leve (estadio i). La línea sólida corresponde a la predicción para un día y la línea punteada corresponde a la predicción con 2 días de antelación.
La información proporcionada por estas curvas se puede interpretar fácilmente considerando sus correspondientes AUC (tabla 3). El biomarcador TFGe MDRD-4 mostró una alta capacidad predictiva de IRA en todas las categorías (es decir, leve, moderada y grave) independientemente del día en que se mida, con valores de AUC superiores a 0,7 en todos los casos. Los resultados son similares cuando se calculan los valores de sensibilidad con una especificidad del 80% (tabla 4).
AUC (IC 95%) de las curvas ROC tiempo-dependientes (acumulada/dinámica) para el TFGe MDRD4 en la muestra exploratoria
| Tipo | ||||
|---|---|---|---|---|
| MDRD-4 se mide | ta | Grave III | Moderado II | Leve I |
| El día de la cirugía | t = 1 | 0,833 (0,775; 0,912) | 0,733 (0,629; 0,814) | 0,788 (0,751; 0,830) |
| t = 2 | 0,827 (0,763; 0,905) | 0,700 (0,638; 0,761) | 0,707 (0,672; 0,743) | |
| Un día después de la cirugía | t = 1 | 0,946 (0,901; 0,972) | 0,823 (0,747; 0,910) | 0,763 (0,721; 0,795) |
| t = 2 | 0,919 (0,835; 0,962) | 0,797 (0,722; 0,875) | 0,712 (0,673; 0,742) | |
| Dos días después de la cirugía | t = 1 | 0,939 (0,810; 0,978) | 0,820 (0,717; 0,936) | 0,794 (0,767; 0,832) |
| t = 2 | 0,936 (0,815; 0,974) | 0,759 (0,655; 0,882) | 0,775 (0,749; 0,810) | |
Valores de sensibilidad en porcentaje para una especificidad fija del 80%. Muestra exploratoria
| Tipo | ||||
|---|---|---|---|---|
| MDRD-4 se mide | ta | Grave III | Moderado II | Leve I |
| El día de la cirugía | t = 1 | 67,4 | 45,4 | 60,4 |
| t = 2 | 67,6 | 38,6 | 50,4 | |
| Un día después de la cirugía | t = 1 | 89,4 | 70,0 | 62,0 |
| t = 2 | 85,6 | 63,2 | 52,3 | |
| Dos días después de la cirugía | t = 1 | 87,9 | 77,4 | 64,1 |
| t = 2 | 87,6 | 66,5 | 59,4 | |
Los puntos de corte óptimos para la TFGe MDRD-4, con una sensibilidad del 80%, aparecen en la tabla 5. En el material adicional (tabla A.4) se presentan análisis similares usando como biomarcador el cambio desde basal en la Crs (ΔCrs). Como era de esperar, ΔCrs no es un buen predictor: muestra valores de AUC bajos en todos los casos. Aunque la urea sérica, Δurea y ΔMDRD-4 mostraron una capacidad predictiva aceptable en algunos casos, nunca superaron los correspondientes al MDRD-4.
Puntos de corte óptimos para MDRD-4 y sus correspondientes especificidades, fijando la sensibilidad del 80% para la muestra exploratoria
| Tipo | |||||||
| Grave III | Moderado II | Leve I | |||||
| MDRD-4 se mide | ta | Punto de corte | Especificidad en % | Punto de corte | Especificidad en % | Punto de corte | Especificidad en % |
| El mismo día de la cirugía | t = 1 | 76,1 | 67,1 | 81,0 | 57,7 | 76,9 | 62,1 |
| t = 2 | 73,8 | 68,2 | 84,9 | 57,7 | 86,9 | 45,5 | |
| Un día después de la cirugía | t = 1 | 50,8 | 92,0 | 75,0 | 61,7 | 79,2 | 50,6 |
| t = 2 | 55,0 | 88,9 | 76,3 | 59,8 | 86,0 | 42,2 | |
| Dos días después de la cirugía | t = 1 | 46,3 | 93,4 | 63,5 | 74,5 | 69,5 | 63,8 |
| t = 2 | 46,8 | 93,2 | 69,8 | 65,9 | 72,9 | 59,4 | |
Las unidades de los puntos de corte para TFGe MDRD-4 son ml/min/1,73 m2.
Los resultados obtenidos en la muestra exploratoria fueron validados en la muestra de validación (n = 1.982). Los IC del 90% obtenidos al realizar las pruebas de equivalencia se muestran en la figura 2. Los resultados en esta segunda muestra fueron similares a los resultados obtenidos en la primera.
DiscusiónEn este trabajo utilizamos las curvas ROC tiempo-dependientes para explorar la capacidad de ciertos biomarcadores de laboratorio de la función renal, comunes y baratos, para predecir el desarrollo de IRA-ACC con uno o 2días de antelación. El principal hallazgo es que la TFGe por la fórmula MDRD-4 es un predictor fiable del IRA tras una CC mayor. Las limitaciones de la Crs para el diagnóstico precoz de IRA son bien conocidas y también se han confirmado con esta metodología. En el contexto específico de la CC, el retraso habitual en la elevación de los valores de Crs después de la intervención se amplifica debido a la hemodilución y al balance positivo del fluidos tras la derivación cardiopulmonar. También es bien sabido que, en presencia de IRA, la disminución de la TFGe precede al aumento en Crs. Así mismo, la estimación de la TFG basada en ecuaciones como MDRD no refleja el filtrado real en situaciones agudas. Estas fórmulas son inadecuadas para su uso en pacientes con IRA22. Sin embargo, en nuestro trabajo, la TFGe se utilizó como un biomarcador para predecir un evento futuro, no como un parámetro para cuantificar la función renal actual. Sorprendentemente, la estimación de la TFG basada en la Crs, y modificada por algunas características demográficas (edad, raza, género), demostró predecir mejor la aparición de IRA que las obtenidas solo con la Crs.
La IRA-ACC grave, definida por la necesidad de TRS, tiene un pronóstico preocupante, con tasas de mortalidad hospitalaria en torno al 50%. Se han desarrollado3,4,23 y validado16,24 varios modelos predictivos que incluyen factores de riesgo preoperatorios con el fin de detectar los sujetos en riesgo y mejorar la información del paciente. Los nuevos biomarcadores de lesión en sangre y en orina constituyen un gran avance para detectar con anticipación un episodio de IRA en diferentes escenarios clínicos, comenzando, hace ya más de una década, con la CC pediátrica25. La utilidad de todos estos biomarcadores de IRA se ha evaluado con las curvas ROC convencionales. Estos estudios proporcionan información sobre la sensibilidad y especificidad del biomarcador, los puntos de corte óptimos y el tiempo transcurrido desde que se observan los valores más elevados del biomarcador hasta que se diagnostica la IRA.
Nuestro enfoque es diferente. Los modelos de regresión de Cox se utilizan para tratar datos de tiempo hasta el evento, cuando el objetivo es estudiar la asociación entre determinados biomarcadores y eventos futuros. El principal problema es que un biomarcador puede mostrar una elevada asociación con el evento y, sin embargo, no ser útil para discriminar. Heagerty17 introdujo el concepto de curva ROC tiempo-dependiente como una extensión de las curvas ROC para el análisis de datos de tiempo hasta el evento. Hasta donde sabemos, las curvas ROC tiempo-dependientes no se han utilizado en el contexto específico de IRA-ACC con un conjunto de datos clínicos reales. Pepe et al.26 compararon diferentes enfoques para la estimación de las curvas ROC tiempo-dependientes, pero con datos simulados. Más recientemente, Pitili et al.27 utilizaron las curvas ROC tiempo-dependientes para evaluar una combinación de biomarcadores para predecir el inicio de la TRS en pacientes en UCI ventilados mecánicamente. En este trabajo hemos utilizado el enfoque más común de curva ROC tiempo-dependiente que es el de la acumulada/dinámica17.
La información proporcionada por las curvas ROC tiempo-dependientes debe interpretarse en términos de proporciones. Por ejemplo, un día después de la cirugía (ver tabla 4), considerando la TFGe MDRD-4 como biomarcador y suponiendo que la especificidad es del 80%, la proporción de pacientes con IRA grave (AKIN estadio iii) que se puede predecir con un día de anticipación es del 89,4% y con 2días de anticipación del 85,6%. Como era de esperar, cuando el biomarcador se mide el día de la cirugía, la capacidad de predicción disminuye. Por ejemplo, el día de la cirugía, solo el 67,4% de los pacientes con IRA grave y el 45,4% de los pacientes con IRA moderada (AKIN estadio ii) se pueden predecir con un día de anticipación. Este mismo resultado también se ha observado con algunos de los nuevos biomarcadores28 y está relacionado tanto con el breve lapso de tiempo transcurrido desde el inicio de los estímulos nocivos como con la hemodilución durante la derivación cardiopulmonar, cuando los parámetros se miden al ingresar en UCI.
Se proporcionan también los puntos de corte óptimos, (tabla 5) información muy útil para el uso del biomarcador en la práctica diaria. Los valores de TFGe MDRD-4 medidos el día de la cirugía no permiten discriminar entre casos y controles en ninguna de las 3categorías de IRA. Sin embargo, si se mide un día después de la cirugía, un paciente será clasificado, con 24 h de anticipación, como AKIN estadio iii si su TFGe MDRD-4 es inferior o igual a 51ml/min/1,73 m2, como AKIN estadio ii cuando 51 < MDRD-4 ≤ 75, como AKIN estadio i cuando 75 < MDRD-4 ≤ 80 y como no IRA cuando su TFGe MDRD-4 sea >80. Desde nuestro punto de vista, esta información es especialmente valiosa, ya que muchos pacientes son dados de alta y trasladados a planta el día después de la cirugía. Teniendo en cuenta estos puntos de corte, el valor de la TFGe MDRD-4 el día después de la cirugía puede ayudar a decidir la mejor opción para el paciente. Estas decisiones incluyen: el alta de UCI (frente a su permanencia o envío a una unidad de intermedios), el uso de fármacos nefrotóxicos (suspensión, cambio o reinicio), la necesidad de un estricto control glucémico, el mantenimiento de la monitorización hemodinámica y la interconsulta al Servicio de Nefrología29. Recientemente, Meersch et al.30 han demostrado que la puesta en marcha de un «paquete de medidas KDIGO en cirugía cardiotorácica» en pacientes intervenidos de CC con alto riesgo de IRA, identificados mediante un nuevo biomarcador de lesión medido 4 h después de la derivación cardiopulmonar, redujo la frecuencia y gravedad de la IRA-ACC.
Este estudio tiene varias limitaciones. En primer lugar, su diseño retrospectivo y unicéntrico demanda una validación prospectiva y externa: los puntos de corte obtenidos pueden no ser transferibles a otras instituciones. En segundo lugar, el uso de una definición de IRA basada en el criterio de la Crs dada por la AKIN es criticable: no se pudo usar el criterio de la diuresis para el diagnóstico del IRA, dado que la base de datos no incluía esta variable, un problema común en la mayoría de los estudios retrospectivos. En el contexto específico de la CC, utilizar el criterio de la diuresis para el diagnóstico de IRA es controvertido y ha sido cuestionado recientemente31. No hay consenso acerca de qué definición y clasificación de IRA debe utilizarse en CC, aunque algunos autores proponen una clasificación RIFLE modificada para evitar el sobrediagnóstico de IRA cuando se usan ambos criterios AKIN32. Este fenómeno afecta principalmente a pacientes con estadio i de AKIN. Sin embargo, en nuestra muestra, la capacidad predictiva del MDRD-4 mejoró con la gravedad de la IRA (tabla 3). Debido a que el pronóstico está directamente relacionado con la gravedad del episodio de IRA, creemos que el impacto del sobrediagnóstico de pacientes con IRA leve es insignificante si tenemos en cuenta que el uso de la TFGe MDRD-4 como biomarcador es especialmente útil en casos moderados y graves. Una limitación final es el efecto del valor basal de la TFGe MDRD-4. Es conocido que el rendimiento de algunos nuevos biomarcadores (por ejemplo, NGAL en orina) se ve afectado por la presencia de enfermedad renal crónica33, lo que hace que la prueba no sea informativa. No se exploró el papel del valor basal de TFGe MDRD-4 en la predicción de IRA debido al pequeño número de casos con IRA moderada o grave. Las probabilidades de un episodio de IRA y los puntos de corte óptimos para el MDRD-4 en pacientes con una TFGe preoperatoria inferior a 60ml/min/1,73 m2 pueden diferir de las cifras proporcionadas en las tablas 4 y 5.
ConclusiónEn los pacientes operados de CC mayor, los valores observados de la TFGe MDRD-4 uno o 2días después de la cirugía constituyen una buena herramienta predictora de IRA. Mientras se encuentran biomarcadores nuevos y más precisos, el uso de los puntos de corte de este biomarcador rutinario de bajo coste puede ayudar en la toma de decisiones en la UCI. El diseño de este estudio encaja perfectamente con la metodología ROC tiempo-dependiente, debido al tamaño de la muestra, la variable principal definida como tiempo hasta el evento y la disponibilidad de medidas repetidas para los diferentes parámetros. Esta investigación puede ayudar a popularizar y difundir esta metodología.
FinanciaciónEste trabajo fue parcialmente financiado por el proyecto de investigación MTM2016 -75351-R del Ministerio de Economía, Industria y Competitividad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A todo el personal de la UCI de Cirugía Cardiovascular por su constante ayuda en el mantenimiento de la base de datos