La infección por SARS-CoV2 ha impactado de forma importante en los pacientes con trasplante renal causando una elevada mortalidad en los primeros meses de la pandemia. La reducción intencionada de la inmunosupresión se ha postulado como uno de los pilares en el manejo de la infección ante la falta de un tratamiento antiviral dirigido. Esta se ha modificado de acuerdo con la situación clínica de los pacientes, y su efecto sobre la función renal o los anticuerpos anti-HLA a medio plazo no ha sido evaluado.
ObjetivosEvaluar los cambios de inmunosupresión realizados durante la infección por SARS-CoV2, así como la función renal y los anticuerpos anti-HLA de los pacientes trasplantados de riñón a los 6 meses del diagnóstico de COVID19.
Material y métodosEstudio retrospectivo, multicéntrico nacional (30 centros) de pacientes trasplantados de riñón con COVID19 desde el 01/02/20 al 31/12/20. Se recogieron las variables de la historia clínica y se incluyeron en una base de datos anonimizada. Se utilizó el programa estadístico SPSS para el análisis de resultados.
ResultadosSe incluyeron 615 trasplantados renales con COVID19 (62,6% varones), con una edad media de 57,5 años.
El tratamiento inmunosupresor predominante antes del COVID19 era la triple terapia con prednisona, tacrolimus y ácido micofenólico (54,6%) seguido de los regímenes con inhibidores m-TOR (18,6%). Tras el diagnóstico de la infección se suspendió el ácido micofenólico en el 73,8% de los pacientes, el inhibidor m-TOR en el 41,4%, tacrolimus en el 10,5% y ciclosporina A en el 10%. A su vez, el 26,9% recibieron dexametasona y al 50,9% se les inició o aumentó la dosis de prednisona basal.
La creatinina media antes del diagnóstico de COVID19, en el momento del diagnóstico y a los 6 meses fue de 1,7±0,8; 2,1±1,2 y 1,8±1mg/dl, respectivamente (p<0,001).
Al 56,9% de los pacientes (N=350) se les monitorizó los anticuerpos anti-HLA. El 94% (N=329) no presentaron cambios en los anti-HLA, mientras que el 6% (N=21) los positivizaron. De entre los pacientes con anticuerpos donante-específicos post-COVID19 (N=9), a 7 pacientes (3,1%) se les había suspendido un inmunosupresor (en 5 de ellos se suspendió ácido micofenólico y en 2 tacrolimus), a un paciente los 2 inmunosupresores (3,4%) y al otro paciente no se le había modificado la inmunosupresión (1,1%), siendo estas diferencias no significativas.
ConclusionesEl manejo de la inmunosupresión tras el diagnóstico de COVID19 se basó fundamentalmente en la suspensión de ácido micofenólico con reducciones o suspensiones muy discretas de inhibidores de calcineurina. Este manejo de la inmunosupresión no influyó en la función renal ni en cambios de los anticuerpos anti-HLA a los 6 meses del diagnóstico.
SARS-CoV-2 infection has had a major impact on renal transplant patients with a high mortality in the first months of the pandemic. Intentional reduction of immunosuppressive therapy has been postulated as one of the cornerstone in the management of the infection in the absence of targeted antiviral treatment. This has been modified according to the patient's clinical situation and its effect on renal function or anti-HLA antibodies in the medium term has not been evaluated.
ObjectivesEvaluate the management of immunosuppressive therapy made during SARS-CoV-2 infection, as well as renal function and anti-HLA antibodies in kidney transplant patients 6 months after COVID-19 diagnosis.
Material and methodsRetrospective, national multicentre, retrospective study (30 centres) of kidney transplant recipients with COVID19 from 01/02/20 to 31/12/20. Clinical variables were collected from medical records and included in an anonymised database. SPSS statistical software was used for data analysis.
Results615 renal transplant recipients with COVID19 were included (62.6% male), with a mean age of 57.5 years.
The predominant immunosuppressive treatment prior to COVID19 was triple therapy with prednisone, tacrolimus and mycophenolic acid (54.6%) followed by m-TOR inhibitor regimens (18.6%). After diagnosis of infection, mycophenolic acid was discontinued in 73.8% of patients, m-TOR inhibitor in 41.4%, tacrolimus in 10.5% and cyclosporin A in 10%. In turn, 26.9% received dexamethasone and 50.9% were started on or had their baseline prednisone dose increased.
Mean creatinine before diagnosis of COVID19, at diagnosis and at 6 months was: 1.7±0.8, 2.1±1.2 and 1.8±1mg/dl respectively (p<0.001).
56.9% of the patients (N=350) were monitored for anti-HLA antibodies. 94% (N=329) had no anti-HLA changes, while 6% (N=21) had positive anti-HLA antibodies. Among the patients with donor-specific antibodies post-COVID-19 (N=9), 7 patients (3.1%) had one immunosuppressant discontinued (5 patients had mycophenolic acid and 2 had tacrolimus), 1 patient had both immunosuppressants discontinued (3.4%) and 1 patient had no change in immunosuppression (1.1%), these differences were not significant.
ConclusionsThe management of immunosuppressive therapy after diagnosis of COVID19 was primarily based on discontinuation of mycophenolic acid with very discrete reductions or discontinuations of calcineurin inhibitors. This immunosuppression management did not influence renal function or changes in anti-HLA antibodies 6 months after diagnosis.
El 11 de marzo de 2020, la Organización Mundial de la Salud (OMS) declaró la infección por el nuevo coronavirus SARS-CoV2 como pandemia global. Este virus, cuyo origen se había producido unos meses atrás en la ciudad china de Wuhan, se caracteriza por producir infección respiratoria y afectación sistémica y se ha denominado enfermedad infecciosa por coronavirus o COVID19 por sus siglas en inglés1.
El 2 de marzo de 2020 se diagnosticó en España el primer paciente trasplantado renal con infección por SARS-CoV2 en uno de los hospitales de Madrid y el 18 de marzo de 2020 se creó, a través de la Sociedad Española de Nefrología, el registro de pacientes con terapia renal sustitutiva que se infectaban por este virus (registro COVID de la S.E.N.)2.
Los pacientes con tratamiento inmunosupresor crónico están expuestos a un mayor riesgo de infecciones y en el caso de los pacientes con trasplante renal supone una de las principales complicaciones tras el implante3. Este hecho ha provocado que la pandemia haya impactado de forma importante en este grupo de pacientes, causando en los primeros meses de la pandemia una mortalidad elevada2,4 y confirmándose en diversos estudios el peor pronóstico de la enfermedad en esta población.
El manejo de las infecciones virales, en la población trasplantada, se basa fundamentalmente en la prevención, a través de la vacunación, estrategias antivirales de profilaxis y medidas generales de control de la infección. Esto supone el primer escalón del tratamiento y es de máxima importancia; sin embargo, en enfermedades infecciosas que aparecen de novo, como lo es la actual pandemia por COVID19, el manejo incluye el tratamiento antiviral dirigido, en las situaciones en las que se dispone de él, y la reducción de la inmunosupresión para favorecer el desarrollo de inmunidad específica5.
Desde el inicio de la pandemia por COVID19 se han publicado diversas experiencias, en pacientes con trasplante renal, en las que el manejo de la infección viral incluía la reducción de la inmunosupresión6–11. Este hecho no parece influir a corto plazo ni en la supervivencia del paciente ni en la función renal o el desarrollo de anticuerpos contra antígenos leucocitarios humanos (HLA, de sus siglas en inglés) donantes-específicos6–11.
Aprovechando la creación del registro COVID de la S.E.N. y que durante la pandemia por SARS-CoV2 la inmunosupresión se ha modificado en estos pacientes de acuerdo con la situación clínica y a criterio de cada centro, es una oportunidad el conocer cómo se ha manejado la inmunosupresión en los diferentes centros participantes, así como las consecuencias a medio plazo si las hubiera.
Presentamos este estudio cuyo objetivo principal consistió en analizar los cambios en la función renal y en los anticuerpos anti-HLA a medio plazo (6 meses) de los pacientes trasplantados de riñón en España diagnosticados de COVID19, a los que se les disminuyó de forma intencionada la inmunosupresión, que fueron incluidos en el registro COVID de la S.E.N. y aceptaron participar en el mismo. Como objetivos secundarios se evaluaron el cambio de inmunosupresión realizado y el tiempo que se mantuvo reducida la inmunosupresión.
Pacientes y métodosDiseño del estudioRealizamos un estudio observacional, retrospectivo y multicéntrico nacional en el que participaron 30 hospitales españoles con seguimiento de pacientes con trasplante renal y que habían incluido pacientes en el registro COVID de la S.E.N.
Población de estudioSe incluyeron pacientes trasplantados de riñón con diagnóstico de infección por SARS-CoV2 desde el 1 de marzo de 2020 al 31 de diciembre de 2020. Se excluyeron los pacientes diagnosticados de infección por coronavirus por métodos serológicos, los fallecidos durante el periodo de estudio y los pacientes con datos incompletos en relación con el objetivo principal. Los pacientes fueron seguidos durante 6 meses.
El diagnóstico de infección por SARS-CoV2 se realizó mediante la técnica de reacción en cadena de la polimerasa (PCR) de muestras nasales o de nasofaringe.
La inclusión de pacientes abarcó dos periodos u olas de la pandemia en España; el primero de ellos de febrero a julio de 2020 (N=274, 44%) y el segundo de agosto a diciembre 2020 (N=341, 55,4%).
Se recogieron variables demográficas (edad, sexo y raza), variables clínicas relacionadas con la enfermedad renal crónica (ERC) y el trasplante renal (etiología de la ERC, número de trasplante renal, riesgo inmunológico, fecha del trasplante) así como el tratamiento inmunosupresor de mantenimiento, la función renal (creatinina, filtrado glomerular empleando la ecuación CKD-EPI en ml/min/1,73m2, índice proteína/creatinina en orina de muestra aislada en mg/g Cr) y los anticuerpos anti-HLA en la determinación previa al diagnóstico de la infección por SARS-CoV2.
También se recogieron variables relacionadas con el manejo de la inmunosupresión tras la infección por coronavirus, la función renal (creatinina, filtrado glomerular empleando la ecuación CKD-EPI en ml/min/1,73m2 e índice proteínas/creatinina en orina de muestra aislada en mg/g Cr) al diagnóstico de la infección, a los 7 y 15 días y a los 2 y 6 meses tras el diagnóstico de la enfermedad, los anticuerpos anti-HLA a los 2 y 6 meses tras el diagnóstico, así como variables clínicas de evolución de la enfermedad (periodo de la pandemia, ingreso hospitalario o en unidad de cuidados intensivos, días de ingreso, manifestaciones clínicas y tratamiento antiviral).
El fracaso renal agudo (FRA) se definió y clasificó según la guía de práctica clínica KDIGO de daño renal agudo12.
Los datos de las variables clínicas y demográficas se obtuvieron de la historia clínica de los pacientes y se recogieron en el registro COVID de la S.E.N. Posteriormente fueron incluidos en una base de datos anonimizada sobre la que se realizó el análisis.
El estudio fue aprobado por el comité ético de investigación clínica del Hospital Universitario La Paz (código PI-4332) y corroborada su aprobación por los comités de cada centro participante.
InmunosupresiónLa inmunosupresión de los pacientes se modificó de acuerdo con la situación clínica y el criterio de cada centro, no existiendo un protocolo de manejo estándar.
En líneas generales se reducía la inmunosupresión de forma progresiva a medida que la situación clínica del paciente empeoraba y consistió, básicamente, en la reducción, suspensión o no ajuste de la inmunosupresión:
En los casos de infección por SARS-CoV2 con síntomas leves o asintomáticos no se modificaba la inmunosupresión, salvo en 4 centros en los que sí se redujo o se suspendió el inmunosupresor adyuvante (ácido micofenólico o inhibidores m-TOR).
En los casos de infección moderada con neumonía e hipoxemia con necesidad de oxigenoterapia con gafas nasales se suspendía el inmunosupresor adyuvante (ácido micofenólico o inhibidores m-TOR), se reducía la dosis de inhibidor de calcineurina, salvo en 3 centros en los que se suspendía tanto el inmunosupresor adyuvante (ácido micofenólico o inhibidores m-TOR) como el principal, y se aumentaba la dosis de esteroides.
En los casos de infección severa con neumonía que precisaba de ventilación mecánica se suspendía tanto el inmunosupresor adyuvante (ácido micofenólico o inhibidores m-TOR) como el principal, y se aumentaba la dosis de esteroides.
Como consecuencia de las interacciones de los inmunosupresores con otros fármacos que se emplearon en el tratamiento de los pacientes, hubo un porcentaje de pacientes en los que la suspensión inicial del inmunosupresor no se materializó manteniendo niveles de inmunosupresor en sangre durante el ingreso. A este grupo de pacientes se les consideró, para el análisis del manejo de la inmunosupresión, como pacientes en los que no se ajustó la medicación o suspensión fallida.
Tratamiento antiviral y antiinflamatorio frente al SARS-CoV2El tratamiento dirigido a controlar la enfermedad infecciosa se realizó de acuerdo con los protocolos de cada centro y varió en función de la evidencia científica disponible en cada periodo de la pandemia.
En relación con el tratamiento antiviral:
El 82,5% de los pacientes (N=226) recibieron hidroxicloroquina durante el primer periodo de la pandemia mientras que sólo un paciente lo recibió en el segundo periodo.
El 19,3% (N=53) de los pacientes recibieron lopinavir/ritonavir en el primer periodo y sólo 3 pacientes en el segundo.
El 1,1% (N=3) recibió remdesivir durante el primer periodo y aumentó hasta el 5,9% (N=20) durante el segundo.
En relación con el tratamiento antiinflamatorio:
El 40,9% de los pacientes (N=112) recibieron dexametasona o metilprednisolona durante el primer periodo y el 51,5% (N=173) lo recibieron durante el segundo.
Interferón fue utilizado en el 4% de los pacientes (N=11) en el primer periodo y en menor proporción de pacientes en el segundo (N=5, 1,5%).
Tocilizumab se utilizó en el 11% de los pacientes (N=30) en el primer periodo y en el 5,9% (N=20) en el segundo.
Anakinra fue usado en 11 pacientes, 8 durante el primer periodo y en 3 pacientes en el segundo periodo.
El plasma de convalecientes se utilizó únicamente en el segundo periodo de la pandemia en 7 pacientes (2,1%).
Análisis estadísticoLos resultados de las variables cuantitativas se expresan como media±desviación estándar o como mediana. Se realizó comparación de medias de variables cuantitativas continuas empleando la prueba t de Student para muestras pareadas y no pareadas, según fuera adecuado. En el caso de que las variables no se distribuyeran de forma normal se emplearon pruebas no paramétricas: la prueba U de Mann-Whitney para comparar muestras independientes y en el caso de muestras pareadas se utilizó el test de Wilcoxon cuando se comparaban 2 muestras y el test de Friedman cuando se comparaban más de 2 muestras pareadas. Los resultados de las variables categóricas se expresan con la frecuencia absoluta y relativa. Se utilizó la prueba estadística chi cuadrado o test exacto de Fisher, según fuese necesario, para la comparación de las variables categóricas. Se consideró un resultado estadísticamente significativo un valor de p<0,01. Se utilizó el programa estadístico SPSS versión 20.0 para el análisis.
ResultadosSe incluyeron 615 pacientes trasplantados de riñón con diagnóstico de infección por SARS-CoV2. El 75,9% (N=467) ingresaron en el hospital y el 24,1% se siguieron de forma ambulatoria (N=148).
En la tabla 1 se muestran las características demográficas de la población de estudio, así como las variables clínicas relacionadas con el trasplante renal y las relacionadas con la evolución de la enfermedad infecciosa.
Características demográficas y variables clínicas relacionadas con el trasplante renal y la evolución de la infección por SARS-CoV2 en la población de estudio
| Edad (x±ds) – Años (mín.-máx.) | 57,5±12,7 (14-90) |
| Sexo, N (%) – H/M | 385 (62,6) / 230 (37,4) |
| Procedencia, N (%) | |
| Caucásica | 449 (73) |
| Latina | 77 (12,5) |
| Asiática | 6 (1) |
| Otras | 38 (6,2) |
| Desconocida | 45 (7,3) |
| Etiología ERC, N (%) | |
| Nefropatía diabética | 72 (11,7) |
| Nefroangioesclerosis | 52 (8,5) |
| Glomerular | 161 (26,2) |
| NTI crónica | 51 (8,3) |
| Poliquistosis HR | 103 (16,7) |
| Enfermedad sistémica | 21 (3,4) |
| Otras | 143 (23,3) |
| Desconocida | 12 (2) |
| Núm. trasplante renal, N (%) | |
| Primero | 523 (85) |
| Segundo | 61 (9,9) |
| Tercero | 4 (0,7) |
| Cuarto | 3 (0,5) |
| No especificado | 24 (3,9) |
| Riesgo inmunológico, N (%) | |
| No sensibilizado (PRA 0%) | 453 (73,7) |
| Sensibilizado (PRA 0-50%) | 72 (11,7) |
| Altamente sensibilizado (PRA >50%) | 44 (7,2) |
| No especificado | 46 (7,5) |
| Meses desde el trasplante renal (x±ds) | 100±85,4 |
| <2 meses, N (%) | 25 (4,1) |
| 2.12 meses, N (%) | 42 (6,8) |
| >12 meses, N (%) | 548 (89,1) |
| Periodos de pandemia, N (%) | |
| Primer periodo (de marzo a julio 2020) | 274 (44,6) |
| Segundo periodo (de agosto a diciembre 2020) | 341 (55,4) |
| Ingreso hospitalario, N (%) | 467 (75,9) |
| Días de ingreso (x±ds) | 18±18,2 |
| Mediana | 13 |
| Mínimo-máximo | 1-190 |
| Clínica respiratoria (tos, expectoración, rinorrea), N (%) | 384 (62,4) |
| Fiebre, N (%) | 430 (70) |
| Disnea, N (%) | 226 (36,7) |
| Clínica digestiva (náuseas, vómitos, diarrea), N (%) | 228 (37,1) |
| Asintomático, N (%) | 59 (9,6) |
| Neumonía, N (%) | 388 (63,1) |
| No oxígeno, N (%) | 113 (29,1) |
| Gafas nasales, N (%) | 157 (40,5) |
| VMK, N (%) | 61 (15,7) |
| VM (invasiva o no invasiva), N (%) | 49 (12,6) |
| No especificado, N (%) | 8 (2,1) |
| Ingreso en UVI N (%) | 44 (7,2) |
N=615.
x: media; ds: desviación estándar; ERC: enfermedad renal crónica; H: hombre; HR: hepatorrenal; M: mujer; mín: mínimo; máx: máximo; NTI: nefritis tubulointersticial; PRA: panel reactive antibody; VM: ventilación mecánica; VMK: ventimask; UVI: unidad vigilancia intensiva.
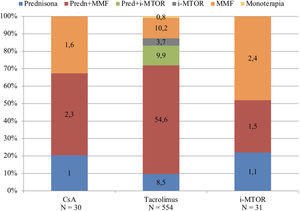
El tratamiento inmunosupresor (IS) predominante antes del COVID19 era la triple terapia, estando presente en el 68,3% (N=420) de los pacientes, seguida de las pautas de biterapia (28,5%, N=176) y de monoterapia con tacrolimus en una pequeñísima proporción de los pacientes (0,8%, N=5).
La pauta de prednisona, tacrolimus y ácido micofenólico era la mayoritaria (54,6%, N=336), seguida de la pauta en biterapia con tacrolimus y ácido micofenólico (10,2%, N=63) y la triple terapia con prednisona, tacrolimus e inhibidores m-TOR (9,9%, N=61). El resto de las pautas estaban representadas por una baja proporción de pacientes, como se muestra en la figura 1.
Tras el diagnóstico de la infección por SARS-CoV2 el manejo del tratamiento consistió básicamente en la reducción, suspensión o no ajuste de la inmunosupresión.
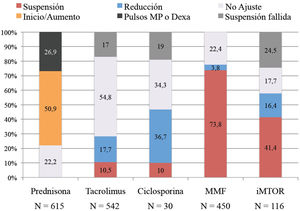
En la figura 2 se detalla el manejo final que se hizo de cada fármaco inmunosupresor, incluyéndose en la gráfica el grupo de pacientes en los que la suspensión de la inmunosupresión no se pudo materializar durante el ingreso a consecuencia de las interacciones de los inmunosupresores con otros fármacos empleados (suspensión fallida) y el grupo de pacientes que recibieron dexametasona o pulsos de metilprednisolona como parte del tratamiento antiinflamatorio de la enfermedad.
El tratamiento con ácido micofenólico se suspendió de forma mayoritaria, retirándose en el 73,8% (N=332) de los pacientes que lo tomaban previamente (N=450). Ciclosporina A fue proporcionalmente el fármaco que más se redujo, haciéndolo en el 36,7% (N=11) de los pacientes que lo tomaban antes de la infección (N=30). Tacrolimus fue el fármaco que menos se ajustó durante la infección permaneciendo en el 71,8% de los pacientes (en 323 pacientes [54,8%] no se modificó y en 66 pacientes [17%] la suspensión planeada fue considerada fallida). Y los inhibidores m-TOR se suspendieron o no se ajustaron en la misma proporción de pacientes (41,4% vs. 42,2% respectivamente, aunque en el grupo de pacientes sin ajuste del inhibidor m-TOR hubo un porcentaje elevado de pacientes con suspensión fallida [24,5%]).
La dosis basal de prednisona se aumentó en el 50,9% de los pacientes (N=313) y de estos el 66,5% además recibieron dexametasona o pulsos de metilprednisolona. En los pacientes en los que no se ajustó la dosis de prednisona (N=301, 49,1%), el 26,8% (N=81) recibieron dexametasona.
Los niveles de los inmunosupresores se monitorizaron durante el ingreso en cada paciente y fueron inferiores, como era de esperar, en los pacientes en los que se redujo la dosis de forma intencionada con respecto a aquellos en la que se mantuvo la misma dosis habitual. El grupo de pacientes en los que la suspensión planeada del fármaco inmunosupresor fue fallida presentaron niveles medios de fármaco en sangre superiores a los que presentaron los pacientes en los que no se ajustó la medicación (tabla 2).
Niveles medios de inmunosupresores durante el ingreso de infección por SARS-CoV2
| Reducción tacrolimus (N=63 de 96) | 3,9±1,2 (1,35-7,4) | |
| No ajuste de tacrolimus (N=239 de 297) | 11,5±7,5 (2-50) | 0,08 |
| Suspensión fallida de tacrolimus (N=66 de 92) | 15,4±9,8 (6-41) | |
| Reducción ciclosporina A (N=11) | 63,5±23,7 (27,8-90) | |
| No ajuste de ciclosporina A (N=6 de 13) | 155±137,4 (55-485) | NS |
| Suspensión fallida de ciclosporina A (N=3) | 157±76,9 (77-252) | |
| Reducción i-mTOR (N=19) | 3,1±1,1 (0,7-4,8) | |
| No ajuste de i-mTOR (N=15 de 49) | 9,4±3,8 (0,9-20) | NS |
| Suspensión fallida de i-mTOR (N=12) | 11,4±3,2 (6-20) |
Se comparan las medias de los niveles del grupo de pacientes «no ajuste» con el grupo de pacientes «suspensión fallida». Se utilizó el test t de Student o el test u de Mann-Whitney para muestras independientes según fuese necesario.
i-MTOR: inhibidores m-TOR.
La inmunosupresión se introdujo de forma progresiva cuando la situación clínica de los pacientes lo permitió, de tal forma que el tratamiento con ácido micofenólico, tacrolimus, ciclosporina A o inhibidores m-TOR se reinició a los 33, 17, 9 y 12 días de media, respectivamente. La dosis habitual de prednisona se recuperó a los 36 días de mediana (50,2±48,8 días).
Hubo un 6,2% de los pacientes (N=38) que, habiéndoles suspendido algún fármaco inmunosupresor (ácido micofenólico fundamentalmente) al inicio de la enfermedad, no recuperaron el tratamiento previo una vez recuperados clínicamente de la infección.
Función renal y anticuerpos anti-HLA antes, durante y después de la infección por SARS-CoV2La creatinina media antes del diagnóstico de COVID19, en el momento del diagnóstico, a los 7 y 15 días y a los 2 y 6 meses fue de 1,7±0,8mg/dl; 2,1±1,2mg/dl; 1,8±1,1mg/dl; 1,8±1mg/dl; 1,7±0,9mg/dl y 1,8±1mg/dl, respectivamente (p<0,001).
La proteinuria sólo estuvo disponible en la mayoría de los pacientes antes del diagnóstico y a los 2 y 6 meses del diagnóstico, siendo los valores medios de 217±530mg/g Cr, 220±510mg/g Cr y 178,1±447mg/g Cr, respectivamente (p=0,64).
El 57% de los pacientes (N=266) que ingresaron en el hospital y el 8,1% de los pacientes (N=12) seguidos de forma ambulatoria presentaron FRA. Según la clasificación KDIGO del FRA, el 78,8% (N=219) fueron estadio 1, el 1,8% (N=5) estadio 2 y el 16,5% (N=46) estadio 3. En 8 pacientes no se pudo establecer el estadio de FRA. Los pacientes que requirieron terapia renal sustitutiva (TRS) durante el proceso de enfermedad infecciosa fueron el 8,6% (N=24).
La causa funcional (70%, N=186) fue la etiología más frecuente del deterioro entre los pacientes ingresados, seguida de las causas obstructiva e inmunológica en el 1,5% (N=4) y 1,5% (N=4), respectivamente; otras causas se diagnosticaron en el 4,1% (N=11). En el 22,9% (N=61) de los pacientes no se especificó causa del deterioro. En los pacientes ambulatorios el FRA fue de causa funcional en todos ellos y todos recuperaron su función renal basal.
Se realizaron 10 biopsias renales en el contexto del FRA y la infección por SARS-CoV2. En 4 de ellas el diagnóstico histológico fue de naturaleza inmunológica, en 2 de necrosis tubular aguda y en las otras 4 las causas fueron de toxicidad por inhibidores de calcineurina en 2 pacientes, de isquemia cortical en uno y de lesiones vasculares crónicas en otro paciente. No se evidenció la presencia de partículas virales en ninguna de las biopsias renales realizadas.
En los 4 pacientes con diagnóstico histológico de naturaleza inmunológica, se observó rechazo mediado por células T en 3 de ellos y en uno de ellos rechazo activo mediado por anticuerpos. Los pacientes que desarrollaron rechazo celular llevaban 15 días, un mes y 4,7 meses trasplantados, lo que supone una incidencia de rechazo celular en los primeros 6 meses tras el trasplante del 6,9%; mientras que el paciente con rechazo humoral llevaba 7,2 años trasplantado. El manejo de la inmunosupresión durante la infección por SARS-CoV2 que se hizo en estos pacientes consistió en la suspensión de ácido micofenólico en los 4 pacientes. El tratamiento con tacrolimus no se suspendió en ninguno de ellos (2 de ellos mantuvieron la misma dosis de tacrolimus y a los otros 2 se les redujo la dosis). En relación con los esteroides, a 3 de ellos se les aumentó la dosis. Sólo uno de estos pacientes con rechazo agudo presentó anticuerpos anti-HLA donante-específicos a los 2 meses del diagnóstico de COVID19. En los otros 3 pacientes, en uno de ellos los anticuerpos anti-HLA se mantuvieron negativos a los 2 y 6 meses tras el diagnóstico de COVID, otro paciente negativizó los anticuerpos anti-HLA tras el tratamiento recibido y el otro paciente mantuvo los anticuerpos anti-HLA positivos sin cambios.
En los pacientes ingresados, se recuperó el FRA en el 93,2% de los pacientes (N=205), el 2,3% lo recuperaron parcialmente y el 3,6% (N=8) no recuperaron el daño renal agudo.
La estancia media hospitalaria de los pacientes con FRA fue significativamente superior que la de los pacientes que no lo presentaron (22,1±22,3 días vs. 14,2±12,1 días, p<0,001). Los pacientes que desarrollaron FRA tenían cifras medias de creatinina antes del diagnóstico de la infección por coronavirus, en el momento del diagnóstico y a los 2 y 6 meses tras la infección significativamente superiores que la de los pacientes que no desarrollaron daño renal agudo (antes: 2±0,9 vs. 1,5±0,5; al diagnóstico: 2,7±1,3 vs. 1,6±0,8; a los 2 meses: 2,1±1,1 vs. 1,5±0,6; a los 6 meses: 2,1±1 vs. 1,5±0,7, p<0,001, respectivamente). Así mismo, durante el proceso de la infección los pacientes ingresados con FRA presentaron una media de creatinina máxima o pico significativamente superior que la de los pacientes ingresados sin FRA (3,1±1,5 vs. 1,6±0,8, p<0,001), siendo los valores medios de creatinina pico según la etiología del FRA los siguientes: 3,1±1,4 en los casos funcionales, 4,1±3,1 en los casos obstructivos, 6±3,1 en los casos inmunológicos, 5,1±2,1 en otras causas y de 3,5±1,2 en los casos de FRA sin causa especificada. En el caso de los pacientes con un seguimiento ambulatorio, la media de la creatinina máxima durante la infección fue de 2,4±1 en los pacientes con FRA y de 1,7±1,2 en los pacientes que no desarrollaron FRA, sin que estas diferencias fueran estadísticamente significativas (p=0,13). El grupo de pacientes que requirieron de TRS durante la infección presentaban una creatinina basal antes del diagnóstico de COVID19 significativamente superior que la de los pacientes que no precisaron de TRS (4,04±1,9 vs. 2,6±1,2, p<0,001).
Se perdió el injerto renal en 12 pacientes (1,9%) y 11 de ellos habían presentado un FRA durante el ingreso. Las causas de pérdida del injerto fueron: progresión de la ERC del injerto en 5 pacientes, vascular en 2 pacientes, inmunológica en un paciente y otras causas en 4 pacientes. La creatinina media basal de estos 12 pacientes fue de 3,8±2mg/dl (mínima 1,19mg/dl – máxima 6,99mg/dl). Tanto el grupo de pacientes que precisaron de TRS como el grupo de pacientes que perdieron el injerto durante el curso de la enfermedad infecciosa presentaban ya una función renal avanzada antes del diagnóstico, lo que pudo influir en estos resultados.
Se analizó también la función renal en el grupo de pacientes con tacrolimus que recibieron tratamiento antiviral con lopinavir/ritonavir (N=46). De estos 46 pacientes, sólo 36 presentaban datos de niveles de inmunosupresión durante el ingreso. Se consideró un nivel valle de tacrolimus ≥10ng/ml como punto de corte para niveles altos de tacrolimus. Dieciocho pacientes en tratamiento con lopinavir/ritonavir presentaron niveles altos de tacrolimus y de estos el 77,8% (N=14) presentaron FRA con cifras de creatinina máxima durante el ingreso de 2,2±1,1mg/dl, mientras que los otros 18 pacientes presentaron niveles de tacrolimus <10ng/ml, presentando el 83,3% (N=15) de los pacientes FRA con unas cifras de creatinina máxima de 2,8±1,4mg/dl (p no significativa entre la comparación de la creatinina máxima en los dos grupos).
El 56,9% de los pacientes (N=350) tenían monitorización de anticuerpos anti-HLA antes y después de la infección por SARS-CoV2 y en el 94% de los mismos (N=329) no se presentaron cambios en los anticuerpos anti-HLA tras la infección.
Veintiún pacientes (6%) positivizaron los anti-HLA tras la infección, de los cuales 9 (2,6%) pacientes presentaron anticuerpos anti-HLA donante-específicos. De estos pacientes, 7 habían suspendido un fármaco inmunosupresor durante la infección (en 5 de ellos se suspendió ácido micofenólico y en 2 tacrolimus), un paciente había suspendido los 2 fármacos inmunosupresores y al otro paciente no se le había modificado la inmunosupresión.
DiscusiónEn este estudio multicéntrico colaborativo se ha evidenciado que el manejo de la inmunosupresión en los pacientes trasplantados de riñón con COVID19 consistió en la suspensión del ácido micofenólico en el 73,4% de los pacientes, en el aumento de la dosis de esteroides en el 50,9%, en el uso de metilprednisolona como parte del tratamiento antiinflamatorio de la enfermedad infecciosa en el 26,9% y en reducciones (17,7% para tacrolimus y 36,7% para ciclosporina A) o suspensiones (10,5% para tacrolimus y 10% para ciclosporina A) muy discretas de los inhibidores de calcineurina.
Estos cambios supervisados e intencionados en la terapia inmunosupresora no han supuesto un daño ni funcional ni inmunológico sobre el injerto renal en la mayoría de los pacientes. Es posible que la reducción de la inmunosupresión realizada en paralelo al incremento de la dosis de esteroides pueda compensar el riesgo de rechazo o de pérdida del injerto derivado de esta práctica.
Aunque no existe un acuerdo unánime sobre el manejo de la inmunosupresión en estos pacientes, es cierto que la reducción de la inmunosupresión se ha postulado como el pilar del manejo terapéutico de estos pacientes en ausencia de un tratamiento antiviral específico, y esta reducción se suele hacer de acuerdo con la situación clínica del paciente13,14.
De hecho, en un estudio internacional que recoge, mediante una encuesta, la práctica del manejo de la inmunosupresión durante los primeros meses de la pandemia en 513 programas de trasplantes distribuidos en 71 países diferentes se demuestra que en el caso de pacientes con síntomas de COVID19 moderados (con necesidad de ingreso hospitalario, no UCI) se disminuyó o suspendió el tratamiento con antimetabolitos e inhibidores de calcineurina en el 76% y 45,4% de los pacientes, respectivamente. En el caso de pacientes con síntomas severos (ingreso en UCI) estos porcentajes de suspensión o reducción de los antimetabolitos e inhibidores de calcineurina ascendían al 79,5% y 68,2%, respectivamente. En relación con los esteroides se produjo un incremento paralelo de la dosis de hasta el 30,6% y 46% de los pacientes con síntomas moderados y severos de COVID19, respectivamente15.
Comparado con nuestro estudio, Sandal et al.15 comunicaron una mayor tendencia a la reducción o suspensión de los inhibidores de calcineurina con porcentajes similares en el manejo de los antimetabolitos y esteroides. Esto puede estar motivado por el diseño del estudio, realizado a través de una encuesta con preguntas sobre el manejo de la inmunosupresión sin que hubiese una recogida de datos con el manejo final realizado en cada centro. De hecho, en nuestro estudio existe un porcentaje de pacientes en quienes habiéndose considerado suspender o reducir los inhibidores de la calcineurina no se consiguió formalmente y fueron considerados como pacientes sin cambios en la inmunosupresión o con suspensión fallida.
Otros estudios, publicados fundamentalmente tras la primera ola de la pandemia, también demuestran que los cambios realizados en la inmunosupresión durante la infección no influyeron en la función renal ni en la situación inmunológica de los pacientes7, como ocurre en nuestro estudio. Aunque el tiempo de seguimiento tras la curación del COVID19 es corto (3 meses en los estudios publicados7–11 y 6 meses en nuestro estudio) para analizar el efecto de la suspensión de la inmunosupresión sobre la supervivencia del injerto, sí que nos permite conocer su efecto sobre la función renal y la sensibilización HLA que influyen de forma directa sobre la supervivencia del injerto a largo plazo.
En nuestro estudio, la incidencia de FRA tras la infección por SARS-CoV2 en los pacientes trasplantados renales es frecuente y se presenta en el 57% de los pacientes que ingresaron en el hospital y casi en el 10% de los pacientes ambulatorios. De igual modo, en una revisión sistemática16 que analiza la evidencia sobre la evolución clínica, la mortalidad y el FRA en pacientes trasplantados renales con COVID19, se muestra que la incidencia de FRA es común y se presenta en el 50% de los casos (IC 95%: 44-56%). Aunque la incidencia de FRA parece inferior en el metaanálisis comparado con nuestro estudio, la variabilidad entre los estudios es grande (I2: 66%), lo que indica que puedan existir diferencias clínicas o metodológicas entre los trabajos.
La alta incidencia de FRA en los pacientes trasplantados renales con COVID19 es probablemente de origen multifactorial e influyen tanto factores asociados con la severidad de la enfermedad infecciosa —como la inestabilidad hemodinámica, el distrés respiratorio, la exposición a fármacos nefrotóxicos, las infecciones secundarias, la hipoxia e hipovolemia o la tormenta de citoquinas— como factores relacionados con el manejo de la inmunosupresión que pueden favorecer la puesta en marcha de mecanismos inmunológicos de rechazo en el injerto renal. En nuestro estudio, la principal causa del FRA fue la etiología funcional, lo que llevó a la recuperación del FRA en la mayoría de los pacientes; sin embargo, en los casos (10 pacientes) con biopsia renal del injerto el diagnóstico histológico más común fue el de rechazo agudo en 4 de ellos, siendo el rechazo agudo mediado por células T el más frecuente (en 3 pacientes). En los 4 casos la reducción de la inmunosupresión consistió en la suspensión de ácido micofenólico y además en 2 de ellos se redujo la dosis de tacrolimus. Sólo uno de los pacientes desarrolló anticuerpos donante-específicos a los 2 meses de la infección. La evidencia histológica de rechazo agudo en el contexto de COVID19 se ha descrito previamente en estudios también multicéntricos, siendo el rechazo celular el más común de los diagnósticos de rechazo17,18.
En nuestro estudio, una vez resuelto el FRA, la función renal de los pacientes volvió a sus cifras previas de creatinina y se mantuvo estable tras 6 meses de la infección por COVID19, no presentando cambios en la misma a medio plazo. Sin embargo, en la población general, se describe que los pacientes que desarrollan FRA asociado con COVID19 presentan mayor riesgo de pérdida progresiva de función renal entre 7 y 90 días después del evento inicial de FRA que aquellos pacientes que desarrollan FRA no asociado con COVID1919. Es muy probable que el seguimiento estrecho de los pacientes trasplantados tras el episodio de COVID19, en nuestro estudio, haya influido positivamente en que los pacientes que tuvieron un FRA no desarrollasen a medio plazo los efectos deletéreos del mismo sobre la función renal, como se describe en el trabajo de Nugent et al.19. Medidas terapéuticas como el control óptimo de la presión arterial, evitar el uso de fármacos nefrotóxicos, la introducción de fármacos que bloquean el sistema renina-angiotensina-aldosterona y el control adecuado de la inmunosupresión tras la resolución de la infección han podido ayudar a conseguir estos resultados en nuestra cohorte de pacientes trasplantados, y muchas de ellas podrían servir como oportunidades de mejora en el seguimiento precoz de los pacientes de la población general que hayan desarrollado FRA asociado a COVID19.
Aunque la presencia de FRA en COVID19 se asocia con peor pronóstico de la enfermedad y mayor riesgo de mortalidad, en nuestro trabajo no hemos podido realizar este análisis ya que sólo se han incluido en el estudio los pacientes que sobrevivieron a la enfermedad, excluyéndose los pacientes fallecidos durante la misma.
Nuestro estudio incluye un número muy importante de pacientes trasplantados renales, siendo una de las series más amplias descritas en la literatura y que engloba a la mayor parte de los pacientes con trasplante renal infectados por COVID19 en España durante la primera y la segunda ola de la pandemia. Dada su naturaleza descriptiva tiene un gran valor para la administración de recursos sanitarios y la generación de hipótesis de trabajo para otros estudios en esta población de pacientes tan vulnerables a las infecciones. Los datos clínicos proceden de un registro nacional creado solamente 2 semanas después de diagnosticarse el primer caso de COVID19 en un paciente con trasplante renal, lo que permitió la recogida rápida y homogénea de las principales variables del estudio por parte de cada investigador, aportando validez al estudio. Sin embargo, presenta algunas limitaciones; por un lado, su diseño retrospectivo no permite establecer asociaciones de causalidad y por otro, las características especiales del periodo de estudio (estado de pandemia con los hospitales volcados en la asistencia de numerosos pacientes con una nueva enfermedad infecciosa) hizo que alguna de las variables del estudio, en concreto la determinación de proteínas en orina o los niveles de inmunosupresores, no fueran analizadas en todos los periodos de tiempo establecidos, sin que ello repercutiera en los resultados finales del estudio.
Como conclusión, el manejo de la inmunosupresión tras el diagnóstico de COVID19 se basó fundamentalmente en la suspensión de ácido micofenólico con reducciones o suspensiones muy discretas de inhibidores de calcineurina. Este manejo de la inmunosupresión no influyó en la función renal ni en cambios de los anticuerpos anti-HLA a los 6 meses del diagnóstico.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo no hubiera sido posible sin la colaboración de las personas que forman parte del grupo de trabajo de trasplante de la S.E.N. (SENTRA) que han participado en la recogida de datos. Los nombres aparecen en el anexo 1.
Cristina Canal, Nuria Serra, Lluis Guirado, Ana Vila, Rosana Gelpi, Natalia Ridao, Carmen Díaz, Esther González, Amado Andrés, Ana Hernández, Natalia Polanco, Alba Santos García, Luis Alberto Sánchez Cámara, Nicolás Macías Carmona, Laura Llinás, Anna Buxeda, Carlos Arias, Carla Burballa, Julia Farrera, Miren Iriarte, Marta Crespo, Francisco Llamas Fuentes, Inmaculada Lorenzo González, Pilar Fraile, Elena González García, M. Auxiliadora Mazuecos, Emilio Rodrigo, Pilar Fraile, Beatriz Rodríguez Cubillo, Natividad Calvo Romero, M. Ángeles Moreno de la Higuera, Ana Sánchez Fructuoso, Patricia Martínez.