INTRODUCCIÓN
La inmunosupresión tras el trasplante confiere al paciente trasplantado una mayor susceptibilidad a las infecciones oportunistas, siendo las víricas las más frecuentes e importantes. Éstas pueden ser el resultado de la exposición a microorganismos de la comunidad, ser transmitidas por el donante o ser el resultado de la reactivación de infecciones latentes debido a la inmunosupresión.1
En general, las infecciones víricas son causa de una importante morbilidad y mortalidad en los receptores de trasplante de órgano sólido. Su conocimiento, por tanto, es importante, ya que en algunos casos podrían contraindicar el trasplante y siempre se han de tener en cuenta para tomar las medidas adecuadas en cuando a detección precoz, profilaxis y tratamiento.
De los virus que pueden causar infección en el paciente trasplantado (tabla 1), en este capítulo vamos a centrarnos en el Virus de la Hepatitis C (VHC), el Citomegalovirus (CMV) y el Virus BK (VBK).
No incluimos el Virus de la Hepatitis B (VHB) por su mínima prevalencia actual. En los últimos años, la infección por el VHB en el paciente trasplantado ha descendido considerablemente en nuestro medio, debido a las medidas adoptadas tanto en el donante como en el receptor:
- En el donante por la realización sistemática de un cribado serológico que incluye la determinación del HBsAg y de los anticuerpos totales HBc, así como de marcadores serológicos de transmisibilidad.
- En el receptor por la vacunación sistemática de los pacientes en diálisis candidatos a trasplante, el seguimiento serológico y el aislamiento de los pacientes seropositivos en Unidades de diálisis separadas, la adopción de medidas higiénicas y el control de las transfusiones.2
VIRUS BK
En los últimos años se está produciendo un aumento de la incidencia de nefropatía asociada al VBK. Este incremento podría estar relacionado con la introducción de nuevos agentes inmunosupresores y con la disminución de la incidencia de rechazo agudo.3
El VBK causa infección primaria asintomática en la niñez y permanece de forma latente principalmente en el tracto urinario,4 causando infecciones clínicamente significativas sólo en los pacientes inmunosuprimidos.5
En receptores de injertos renales se detectan anticuerpos contra el VBK entre el 55 y el 73% de los casos en el momento del trasplante. La reactivación del VBK puede producir diferentes enfermedades, incluyendo nefropatía y cistitis hemorrágica.6 Según diferentes estudios, se produce nefropatía por VBK hasta en un 10% de pacientes trasplantados renales, y alrededor del 50% de ellos puede perder la función del injerto.7,8 Debido a la persistencia del virus en el riñón, la infección por VBK, y por tanto la nefropatía por VBK, en el paciente trasplantado es más frecuente cuando el riñón de un donante seropositivo es trasplantado a un paciente seronegativo.9
En el paciente trasplantado, la reactivación ocurre cuando disminuye la inmunidad celular, aunque otras alteraciones, como la isquemia del injerto, también pueden jugar un papel importante en dicha reactivación.10
Aunque se ha implicado al tratamiento inmunosupresor en el desarrollo de la Nefropatía por Virus BK (NVBK), parece que ésta se produce más en relación con la carga total de inmunosupresión que con un fármaco específico. La mayoría de los casos publicados se refiere a pacientes en terapia triple que frecuentemente incluye Tacrolimus (TAC) y/o Micofenolato Mofetil (MMF) junto con corticosteroides.11 Brennan et al.12 estudiaron la posible asociación entre TAC, Ciclosporina (CsA), MMF y Azatioprina (AZA) y la presencia de viruria y viremia. Observaron que, aunque ninguno de los fármacos analizados les afectaba de forma independiente, la mayor viruria se producía en pacientes tratados con la combinación TAC-MMF, mientras que la menor se daba entre pacientes con CsA-MMF. Así, la presencia de viruria/viremia podría estar más relacionada con la asociación TAC-MMF. Un reciente estudio ha identificado el mantenimiento del tratamiento esteroideo y la inducción con globulina antitimocítica como factores de riesgo independientes para la replicación del VBK en pacientes tratados con TAC-MMF.13
DIAGNÓSTICO
El diagnóstico de la infección por VBK puede hacerse mediante la detección de células decoy en orina, del virus en orina y en sangre (viruria y viremia) y por el hallazgo de lesiones histológicas típicas de nefritis intersticial.
La citología de orina para detectar la presencia de células decoy tiene una sensibilidad de cerca del 100% para el virus BK, por lo que sería la técnica de cribado de elección. Sin embargo, su valor predictivo positivo es bajo (29%). El uso de técnicas moleculares para valorar la presencia de virus en sangre y orina puede ser útil como diagnóstico, ya que se ha observado una correlación entre viremia elevada y nefropatía por BK,8 aunque parece que su utilidad es mayor para el seguimiento del aclaramiento viral durante el tratamiento. Por último, la biopsia renal puede demostrar cambios citopáticos en el epitelio renal compatibles con el diagnóstico de nefritis intersticial. Debido a que puede coexistir NVBK con rechazo, la realización de biopsia renal es esencial para el tratamiento y seguimiento del proceso14,15 (tabla 2).
Es importante detectar la infección precozmente, antes de que se produzcan lesiones renales que podrían llevar a la pérdida del injerto. Se sabe que el diagnóstico de la NVBK cuando los pacientes mantienen la función renal normal y la reducción precoz de la inmunosupresión se asocian a una estabilización de la creatinina y a un menor número de pérdidas de injertos que cuando el diagnóstico se hace con la función renal ya alterada, en cuyo caso los pacientes continúan con incrementos de la creatinina y se produce un mayor número de pérdidas de injertos. Por ello, se recomienda efectuar un cribado rutinario del paciente trasplantado renal para estudiar la presencia de replicación viral.3,11
PREVENCIÓN
La primera medida para prevenir la incidencia de la NVBK posiblemente sea la reducción de la cantidad de inmunosupresión en el trasplante renal.16
Las estrategias para reducir la intensidad de la inmunosupresión incluyen la reducción del número y dosis de los inmunosupresores, su retirada y/o el cambio de la misma. En cualquier caso, hay que valorar el riesgo individual de rechazo.11
La prevención de la NVBK monitorizando la carga viral en pacientes con trasplante renal es una opción importante, ya que cuando la infección se diagnostica antes de que haya un incremento de la creatinina, la reducción preventiva de la inmunosupresión parece ser una opción segura y atractiva.12
REDUCCIÓN DE LA INMUNOSUPRESIÓN DE MANTENIMIENTO
El primer paso para el tratamiento de la nefropatía por VBK consiste en la reducción de la inmunosupresión, que por sí misma (incluso sin el uso de terapia antiviral) conduce a un aclaramiento de la viremia BK sin acompañarse de empeoramiento de la función renal.17,18 En una primera etapa se trataría de reducir los inhibidores de calcineurina y los agentes antiproliferativos en más de un tercio de la dosis, llegando a niveles de TAC <6 ng/ml, de CsA <150 ng/ml, de MMF <1 g/día y de AZA <75 mg/día.17
La reducción del 15% en la dosis de TAC se relaciona con una disminución significativa en la incidencia de NVBK. Asimismo, la retirada de algún componente de la triple terapia, ya sea TAC/CsA o MMF, manteniendo la terapia dual, con prednisona y TAC, CSA o MMF a dosis reducidas, se acompaña de una mejor supervivencia del injerto y un mayor aclaramiento de la viruria comparado con los pacientes que mantienen la triple terapia, aunque sea a dosis más bajas.
Aunque son necesarios más estudios, algunos datos ya indican que el reemplazo de inmunosupresores linfo y nefrotóxicos (como la combinación TAC-MMF) por pautas basadas en el uso de sirolimus y prednisona pueden llevar a la desaparición del virus sin aumento del riesgo de rechazo agudo.19
OTROS TRATAMIENTOS
En la actualidad, no existe ningún tratamiento antivírico específico para la NVBK.
Cuando la reducción de la inmunosupresión no es suficiente para controlar la replicación del virus, o cuando esta opción no es conveniente, por ejemplo en pacientes con alto riesgo de rechazo, pueden estar indicadas otras estrategias terapéuticas, como el uso de fármacos con efecto antiviral, como el cidofovir y la leflunomida, o de otras opciones antirrechazo.
Si coexisten infección por VBK y rechazo agudo, se aconseja administrar un ciclo de corticoides y, posteriormente, reducir la inmunosupresión, así como el uso transitorio de terapias antirrechazo (incluyendo preparados antilinfocitos).20
Entre los fármacos que han mostrado actividad frente al VBK, destaca el cidofovir. Aunque sus indicaciones de uso no incluyen el tratamiento de la NVBK, se ha utilizado de forma experimental a dosis bajas (0,25-0,33 mg/kg iv cada dos semanas), con el fin de minimizar sus efectos nefrotóxicos.11,17
La leflunomida es un inmunosupresor con actividad antiviral in vitro que en modelos animales ha mostrado eficacia y seguridad en el tratamiento de la NVBK.7 El cambio de MMF por leflunomida (a dosis de 100 mg/día durante cinco días seguido de 20-60 mg/día con la finalidad de alcanzar niveles sanguíneos entre 50-100 mg/ml), junto con la reducción de los niveles de TAC (4-6 ng/ml) y el mantenimiento de la prednisona, se ha demostrado eficaz (aclaramiento o reducción progresiva de la carga viral en orina y sangre) si los niveles de leflunomida alcanzados durante el estudio son superiores a 40 mg/ml. Sin embargo, en un reciente ensayo prospectivo realizado por Leca et al. los pacientes con niveles de leflunomida superiores a 40 μg/ml no muestran una mejor evolución clínica que aquellos con niveles inferiores a 40 μg/ml.21
Algunos autores han utilizado inmunoglobulinas a altas dosis asociadas a la reducción de la inmunosupresión en el tratamiento de la NVBK, observando que aunque se requieren más estudios para validar sus resultados, es una terapia útil, segura, puede ser beneficiosa para aquellos pacientes que tengan rechazo agudo simultáneo y puede prevenir la pérdida del injerto.
Otras terapias en investigación incluyen el uso de fluoroquinolonas por su efecto sobre las helicasas, esenciales para la replicación de ciertos virus DNA como el poliomavirus del simio SV40.22
RETRASPLANTE RENAL EN PACIENTES QUE HAN PERDIDO UN INJERTO POR NVBK
Como hemos visto, un alto porcentaje de pacientes con nefropatía por VBK sufrirá pérdida del injerto. Cuando ésta se produce, debe considerarse el retrasplante.20
Aunque en la actualidad no se conoce con certeza cuál es la terapia sustitutiva más adecuada (diálisis o retrasplante), las experiencias con retrasplantes están creciendo y son muy alentadoras. Los pacientes pueden ser sometidos a una nueva cirugía de forma segura y no parece que aumente el riesgo de recurrencia de la infección comparado con el primer trasplante.23
Sin embargo, nos planteamos una serie de preguntas. Si el paciente se va a retrasplantar, ¿debe realizarse nefrectomía del injerto?, ¿cuál es el momento adecuado para la misma?, ¿deben realizarse controles de viruria y viremia?, ¿en qué momento deben realizarse antes del retrasplante?, ¿debemos tratar a estos pacientes?
Atendiendo a la experiencia previa, se recomienda discontinuar toda inmunosupresión en pacientes que no tienen un trasplante multiorgánico, excepto los esteroides, que se irán reduciendo progresivamente hasta la dosis de 5 mg/días alternos. A los pacientes se les realizará monitorización mensual de la citología urinaria y de la carga viral en plasma. Antes del nuevo trasplante, la carga viral debe ser negativa o <102 copias/ml. En pacientes con carga persistentemente positiva, debe considerarse la nefrectomía del injerto. Si las células decoy o la carga del VBK persiste, se debe considerar el uso de cidofovir y/o leflunomida, y/o la nefroureterectomía.
VIRUS DE LA HEPATITIS C
El VHC puede ser transmitido en el trasplante de cualquier órgano. Según datos de donantes de sangre, la prevalencia del VHC oscila entre el 0,01 y 0,02% en el Reino Unido y países del norte de Europa, y entre el 1 y 1,5% en el sur de Europa, hasta tasas más altas como un 6,5% en África ecuatorial y un 20% en Egipto.24 En España, según datos de 2001 de la Organización Nacional de Trasplantes (ONT), la prevalencia de anticuerpos anti-VHC en los donantes es de alrededor del 2%.25
El método de cribado recomendado es el Análisis Inmunoenzimático (EIA) de segunda o tercera generación. Debido a que las pruebas de detección de anticuerpos son menos sensibles en pacientes en hemodiálisis, la prueba de elección para confirmar un resultado dudoso será la amplificación del ARN viral mediante RT-PCR. Además, siempre que sea posible, se recomienda la determinación de la carga viral, como factor pronóstico, y el genotipado del virus, que puede condicionar el tratamiento después del trasplante.26
La transmisión del VHC en donantes con ARN positivo es prácticamente del 100%, lo que en el receptor seronegativo se traducirá en seroconversión en el 50-67% de los casos y en enfermedad hepática en aproximadamente el 35%.
Por todo ello, igual que en el caso de la hepatitis B, los órganos VHC positivo sólo serán considerados para trasplante en el caso de receptores igualmente VHC positivo y, de forma excepcional, en casos de extrema gravedad, en pacientes de edad avanzada o ante la dificultad de encontrar donante adecuado por sensibilización por antígenos HLA.24 Habría que señalar, sin embargo, que los pacientes de edad avanzada son más susceptibles a la infección, por lo que en ellos estaría especialmente indicada la minimización de la inmunosupresión.27
La infección por el VHC es hoy en día la causa principal de hepatopatía crónica en el trasplante renal,28 lo que conlleva una reducción considerable de la supervivencia del injerto y del receptor.
La hepatitis C también induce importantes complicaciones extrahepáticas, que son fundamentalmente linfoproliferativas (secundarias a la estimulación antigénica crónica) y autoinmunes (por mimetismo molecular entre proteínas víricas y antígenos del huésped).29
Entre las alteraciones linfoproliferativas, la Crioglobulinemia Mixta (CM) es la mejor documentada. En la infección por el VHC tras el trasplante y con crioglobulinemia, las crioglobulinas suelen estar presentes en niveles muy bajos, por lo que el paciente generalmente evoluciona libre de manifestaciones sistémicas. Sin embargo, es importante tener en cuenta que la asociación entre glomerulonefritis y CM está claramente demostrada y que la afectación renal empeora considerablemente el pronóstico de la CM.30
Por otro lado, también pueden desarrollarse Glomerulonefritis (GN) fuera del contexto de la CM, incluyendo GN membranosas y membranoproliferativas.31 En el paciente trasplantado, la aparición de GN de novo asociada al VHC se relaciona con una reducción de la supervivencia del injerto y un peor pronóstico.
También existe una asociación significativa entre el Linfoma No Hodgkin (LNH) y la hepatitis C, en relación o no con la CM. En el curso de ésta, el riesgo de desarrollar un LNH está aumentado 35 veces con respecto a la población general.32
Por último, se ha relacionado la infección por el VHC con una mayor incidencia de Diabetes Mellitus Postrasplante (DMPT).33,34 Los posibles mecanismos por los que el VHC pudieran favorecer la aparición de diabetes incluyen, entre otros, una acción directa por parte del virus al infectar las células beta de los islotes pancreáticos.
Debido al riesgo asociado a la infección por el VHC y a la dificultad que comporta su tratamiento en el paciente trasplantado, se aconseja tratar al candidato a trasplante renal antes de su inclusión en lista de espera.
INMUNOSUPRESIÓN Y HEPATITIS C
No existe evidencia de cuál es la mejor estrategia inmunosupresora en el trasplante renal con VHC. Abbott et al.27 no han encontrado ninguna medicación inmunosupresora específica que sea lesiva para pacientes VHC positivo o receptores seronegativos de donantes VHC positivo.
Sin embargo, se acepta que la inmunosupresión está en parte implicada en la reactivación de la hepatitis C y que el paciente trasplantado es más vulnerable a la sobreinmunosupresión.35 De ahí que se haya intentado con cierto éxito el uso de inmunosupresores a dosis reducidas, la terapia libre de esteroides36 o la supresión de esteroides.37
Por otro lado, como se ha mencionado, los pacientes de edad avanzada tienen un mayor riesgo de muerte por infección y sufren más los efectos adversos de la inmunosupresión, por lo que en ellos estaría especialmente indicada la minimización de la inmunosupresión.38
En cuanto a datos sobre fármacos específicos, se dispone de escasa información y aún hay muchos datos contradictorios que generan cierta controversia. No obstante, podríamos decir que hoy en día se considera:
- Que los esteroides y el OKT3 condicionan un mayor riesgo de recurrencia agresiva, pérdida del injerto e incluso muerte del paciente.35
- Que hay estudios que han encontrado un efecto beneficioso del MMF en receptores de donantes seropositivos.27,39
- Que la CsA podría tener un efecto beneficioso en el curso de la infección por el VHC40 y que se ha relacionado con una mayor supervivencia del injerto en comparación con TAC y con un posible efecto beneficioso sobre la evolución de la fibrosis debida al VHC.41 En estudios en hepatocitos in vitro se ha observado una inhibición de la replicación del VHC por la CsA.42
- Que, aunque de forma empírica se recomienda evitar el uso en terapia de inducción de los anticuerpos policlonales antitimocitos (ATG), algunos estudios no han confirmado un efecto perjudicial con este tipo de terapia en pacientes infectados por el VHC.43
TRATAMIENTO
Deberíamos considerar el tratamiento antes y después del trasplante.
Antes del trasplante, el tratamiento de elección es el Interferón (IFN-α). Su uso en monoterapia induce erradicaciones virales significativas al año de tratamiento. La aparición del interferón pegilado y de la rivabirina ha supuesto un avance importante. La rivabirina asociada al IFN-α aumenta y mantiene la respuesta varias veces más que el IFN en monoterapia y previene las recaídas. El IFN pegilado, por su parte, permite una administración menos frecuente y consigue una mayor tasa de respuesta que el IFN convencional.
Tras el trasplante, la terapia antiviral está limitada por su poca eficacia y mala tolerancia. En la actualidad, el IFN-α no está recomendado por el alto índice de recaídas al suspender el tratamiento y por el alto riesgo de rechazo agudo y pérdida del injerto. Por otro lado, la rivabirina está contraindicada, ya que el aclaramiento renal reducido puede inducir hemólisis grave.44
CITOMEGALOVIRUS
La infección por Citomegalovirus (CMV) puede condicionar la aparición de rechazo y otras infecciones oportunistas. Globalmente, y en ausencia de profilaxis, la mortalidad por enfermedad por CMV es cercana al 15%.45
En general, se presenta en todos los trasplantes de órganos sólidos, aunque su incidencia y gravedad varía según el tipo de trasplante: es más frecuente, y habitualmente más grave, en los trasplantes de intestino, páncreas y pulmón que en los de hígado, corazón y riñón. El período de mayor riesgo corresponde a los seis primeros meses, con una máxima incidencia entre el segundo y el tercer mes.46
En España, la prevalencia de infección por CMV entre los donantes alcanza el 80%.25 Sin profilaxis, el 70-90% de los pacientes tendrá infección por CMV, de los cuales entre el 50-80% desarrollará enfermedad por CMV.45
Factores de riesgo
El principal factor de riesgo es el trasplante de un donante seropositivo a un receptor seronegativo (D+/R-). La positividad de anticuerpos IgG específicos es indicativa de infección previa y de persistencia del virus en estado de latencia en el donante, por lo que se debe realizar serología del donante sobre todo con vistas a decidir la actitud profiláctica a adoptar en el receptor.25
Por otro lado, los inmunosupresores antilinfocitarios (globulinas antilinfocíticas o antitimocíticas, o los anticuerpos monoclonales OKT3) producen un aumento de citoquinas, que desencadenan la cascada inflamatoria y estimulan la replicación del CMV.46 De ahí que su utilización también se considere un factor de riesgo importante.
Otros factores asociados a un mayor riesgo de infección por CMV son el uso de dosis elevadas de corticoides, la presencia de cargas virales elevadas de CMV, la estimulación alogénica, las coinfecciones por otros herpes virus, el micofenolato mofetil, la hipotermia intraoperatoria y el estrés asociado a situaciones críticas.46
El MMF a dosis altas y con niveles elevados se ha relacionado con la infección por CMV con tropismo digestivo,47 que puede cursar con antigenemia negativa. En un estudio que comparaba regímenes con MMF con pautas basadas en AZA se encontró en el primer grupo una mayor incidencia de enfermedad por CMV, con afectación principalmente del tracto gastrointestinal.48 En trasplantados cardíacos, everolimus ha demostrado asociarse a un menor tasa de infección por CMV comparado con AZA.49
Diversos estudios han demostrado que los episodios de rechazo agudo pueden inducir la infección por CMV.48 Por otro lado, la infección y la enfermedad por CMV pueden ser factores de riesgo independientes de rechazo agudo.50 La situación de rechazo agudo junto con la necesidad de instaurar tratamiento con anticuerpos antilinfocitarios, por tanto, debe considerarse de alto riesgo y susceptible de profilaxis para el CMV.
Medidas preventivas
Se han obtenido buenos resultados en la reducción de la infección por CMV con el uso de medidas profilácticas en el caso de pacientes de alto riesgo. Por otro lado, la medición de la antigenemia permite hacer un seguimiento de los pacientes de bajo riesgo, de forma que ante elevaciones de la misma se pueda iniciar el tratamiento antes del desarrollo de la enfermedad (tratamiento anticipado).51
Profilaxis
Se recomienda la realización de profilaxis en las situaciones de alto riesgo46 (tabla 3).
1. Situación D+/REn
pacientes D+/R-, la profilaxis con valaciclovir ha confirmado una reducción significativa de la enfermedad comparada con placebo.52
El valganciclovir oral es un profármaco del ganciclovir aprobado para la prevención del CMV en receptores seronegativos de un órgano seropositivo.45 Los trabajos que han comparado la profilaxis con valganciclovir vs. ganciclovir intravenososo53 o ganciclovir oral54,55 no han mostrado diferencias significativas respecto a la reducción de enfermedad, que en cualquier caso permaneció por debajo del 15%, claramente inferior a la obtenida con placebo (40-50%).
Se recomienda la profilaxis con valganciclovir oral, 900 mg/día, o valaciclovir oral, 2 g/6 h, o ganciclovir iv, 6 mg/kg/día, si el paciente no tolera por vía oral, hasta completar un máximo de tres meses postrasplante, todos ellos ajustados a la función renal.
2. Utilización de anticuerpos antilinfocitarios (globulinas antilinfocíticas o antitimocíticas, o anticuerpos monoclonales OKT3)
La profilaxis con ganciclovir reduce significativamente la frecuencia de enfermedad por CMV en trasplante renal.56 Se recomienda la utilización de ganciclovir intravenoso, 5 mg/kg/día, ajustado a función renal, al menos durante dos semanas durante el tratamiento con sueros antitimocíticos, plasmaféresis o anticuerpos anti-CD20.
Tratamiento anticipado (tabla 4)
Existen datos favorables al tratamiento anticipado con ganciclovir intravenoso durante al menos dos semanas. Por otro lado, aunque aún existen pocos casos publicados, la buena biodisponibilidad del valganciclovir oral y sus buenos resultados hablan a favor de su uso en esta indicación.57
En pacientes con insuficiencia renal grave postrasplante (aclaramiento de creatinina <10 ml/min), no está indicado el uso de ganciclovir o valganciclovir, dado que la vía de eliminación de ambos fármacos es exclusivamente renal. Debe valorarse esta situación, teniendo en cuenta que la profilaxis puede retrasarse hasta que el paciente recupere lo suficiente su función renal.46
Reducción de la inmunosupresión
Existe menos evidencia en cuanto a la modificación de la inmunosupresión de base. En trasplantados renales de bajo riesgo y valores bajos de replicación, puede estar recomendado un intento de reducción de inmunosupresión, posibilitando con esta medida en algunos casos evitar el uso de tratamiento anticipado.40
Tratamiento de la enfermedad por CMV45,46
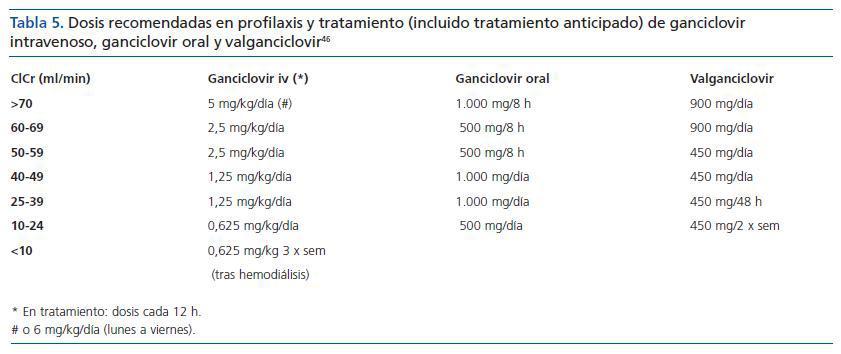
El ganciclovir iv es el tratamiento de elección. Su dosificación debe ser ajustada, teniendo en cuenta la función renal (tabla 5). Hay que considerar la posible presencia de cepas de CMV resistentes a ganciclovir, sobre todo en pacientes que han recibido profilaxis prolongadas con este fármaco, lo que recomendaría el uso de la combinación de ganciclovir y foscarnet.58
El valganciclovir es un profármaco del ganciclovir. La administración oral de 900 mg es equiparable a la de 5 mg/kg de ganciclovir en términos de área bajo la curva. Por ello, su uso estaría recomendado como tratamiento de continuación en pacientes que han iniciado la terapia con ganciclovir iv.
El foscarnet está indicado en pacientes con resistencia clínica a ganciclovir, aparición de enfermedad durante la profilaxis con ganciclovir o valganciclovir y en pacientes con neutropenia, en los que el ganciclovir está contraindicado. Se administra a dosis de 60 mg/kg/8 h o 90 mg/kg/12 h.
En casos de resistencia a ganciclovir y foscarnet, puede utilizarse como alternativa de segunda línea el cidofovir, a dosis de 3-5 mg/kg/semana. Sin embargo, hay que tener en cuenta que la resistencia de alto nivel a ganciclovir (en relación con alteraciones del gen de la polimerasa) confiere resistencia cruzada al cidofovir.59
La leflunomida es un fármaco inmunosupresor de administración oral con actividad frente al CMV. En trasplante renal se dispone de escasa experiencia, si bien con buenos resultados.60
Existen otros antivirales en estudio como adefovir, benzimidazol, lobucavir y maribavir, y otros en desarrollo preclínico como tomeglovir y CMV423.
Tabla 1. Patógenos virales en el paciente trasplantado1
Tabla 2. Seguimiento diagnóstico para el VBK en el paciente trasplantado renal (adaptado de la referencia 15)
Tabla 3. Recomendaciones en la prevención de la infección por CMV en el trasplante renal
Tabla 4. Recomendaciones para el tratamiento anticipado de la infección por CMV
Tabla 5. Dosis recomendadas en profilaxis y tratamiento (incluido tratamiento anticipado) de ganciclovir intravenoso, ganciclovir oral y valganciclovir
RECOMENDACIONES