El estudio del filtrado glomerular medido (FGm) o del estimado (FGe) es el eje de la evaluación adecuada de la función renal en la valoración de un potencial donante vivo renal. Nos planteamos estudiar la correlación entre las fórmulas de estimación del FG y los métodos de medición para determinar la función renal.
Material y métodosAnalizamos la relación entre los valores basales de FGm con Tc-99m-DTPA (dietilenolene-triamino-pentaacetato) y aquellos estimados mediante las fórmulas Modification Diet Renal Disease de 4 variables (MDRD4) y Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) en una serie de donantes vivos de nuestra institución.
ResultadosIncluimos a 64 donantes (70,6% mujeres; con una edad media de 48,3±11 años). La creatinina basal fue 0,8±0,1 y 1,1±0,2mg/dl un año posdonación. Las ecuaciones infraestiman el FG medido por Tc99m-DTPA (MDRD4 −9,4±25ml/min y p<0,05; CKD-EPI −4,4±21ml/min). La correlación entre las fórmulas estimativas y el método medido fue superior para CKD-EPI (r=0,41; p=0,004) que para MDRD4 (r=0,27; p=0,05). El FGe se redujo a 59,6±11 (MDRD4) y a 66,2±14ml/min (CKD-EPI) al año posdonación. Esto supone una reducción media del FGe de 28,2±16,7ml/min (MDRD4) y de 27,31±14,4ml/min (CKD-EPI) al año.
ConclusiónEn nuestra experiencia, CKD-EPI es la fórmula que mejor se correlaciona con el FGm-Tc99m-DTPA en la evaluación de la función renal para el cribado de donantes.
The evaluation of the measured Glomerular Filtration Rate (mGFR) or estimated Glomerular Filtration Rate (eGFR) is key in the proper assessment of the renal function of potential kidney donors. We aim to study the correlation between glomerular filtration rate estimation equations and the measured methods for determining renal function.
Material and methodsWe analysed the relationship between baseline GFR values measured by Tc-99m-DTPA (diethylene-triamine-pentaacetate) and those estimated by the four-variable Modification of Diet in Renal Disease (MDRD4) and Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) equations in a series of living donors at our institution.
ResultsWe included 64 donors (70.6% females; mean age 48.3±11 years). Baseline creatinine was 0.8±0.1 mg/dl and it was 1.1±0.2 mg/dl one year after donation. The equations underestimated GFR when measured by Tc99m-DTPA (MDRD4–9.4 ± 25ml/min, P<.05, and CKD-EPI–4.4 ± 21ml/min). The correlation between estimation equations and the measured method was superior for CKD-EPI (r=.41; P<.004) than for MDRD4 (r=.27; P<.05). eGFR decreased to 59.6±11 (MDRD4) and 66.2±14ml/min (CKD-EPI) one year after donation. This means a mean eGFR reduction of 28.2±16.7 ml/min (MDRD4) and 27.31±14.4 ml/min (CKD-EPI) at one year.
ConclusionsIn our experience, CKD-EPI is the equation that better correlates with mGFR-Tc99m-DTPA when assessing renal function for donor screening purposes.
Desde que en 1954 se llevó a cabo el primer trasplante renal de donante vivo con éxito1, dicha técnica ha experimentado una gran expansión, y ha demostrado que no solo es una importante fuente de órganos, sino el mejor tratamiento sustitutivo para los pacientes con insuficiencia renal crónica avanzada2. En España, esta modalidad ha crecido significativamente en la última década, y ha alcanzado una tasa de 9 procedimientos por millón de población al año3.
Diversos estudios uni- o multicéntricos publicados hasta 2010 con seguimiento a largo plazo de donantes renales no encontraron un mayor riesgo de enfermedad renal crónica o muerte en comparación con la población general4–9. Sin embargo, estudios más recientes que han incorporado un grupo control de población sana mejor aparejado señalan que podría existir un aumento de riesgo a largo plazo. Lamentablemente, estos estudios presentan algunos sesgos importantes que dificultan la interpretación y extrapolación de sus resultados a la práctica clínica habitual10,11.
No existe controversia en cuanto a la necesidad de estudiar a fondo al potencial donante renal, con objeto de evitar un impacto negativo en su salud y de obtener el mejor resultado en el receptor12–14. Un elemento clave dentro del estudio de los potenciales donantes es la evaluación de la función renal. La medición del filtrado glomerular medido (FGm) mediante marcadores externos no isotópicos (inulina, iohexol o iotalamato) está considerada como la prueba patrón oro para la determinación de la función renal12. Sin embargo, estas técnicas requieren un procedimiento largo y complejo, lo que limita su uso en la práctica clínica habitual. Algunos centros emplean técnicas isotópicas menos costosas (ácido dietilentriamino marcado con tecnecio [Tc99m-DTPA], EDTA-Cr51, 125iotalamato)15 y otros basan la evaluación de la función renal exclusivamente en el cálculo del filtrado glomerular estimado (FGe) mediante fórmulas a partir de la creatinina sérica. Las más usadas son la fórmula Modification of Diet in Renal Disease de 4 variables (MDRD4) y la fórmula Chronic Kidney Disease-Epidemiology Collaboration (CKD-EPI). La principal limitación de la fórmula MDRD4 es que muestra una baja correlación con el FGm con valores superiores a 60ml/min16. La fórmula CKD-EPI se desarrolló a partir de una cohorte que, a diferencia de MDRD4, además de pacientes con función renal reducida incluía individuos con función renal normal, con lo que proporciona una mejor correlación con el FGm en sujetos sanos17. A pesar de su validación en población general, no existen suficientes estudios que confirmen su precisión para evaluar la función renal en potenciales donantes vivos13–15.
El objetivo de nuestro estudio fue comparar el método de FGm mediante renograma isotópico con Tc99m-DTPA y las fórmulas estimativas basadas en la creatinina sérica, con el fin de evaluar la validez de dichas fórmulas en el estudio de los potenciales donantes renales y en el seguimiento posterior de receptores y donantes.
MétodosSe realizó un estudio retrospectivo en el que se evaluaron 64 individuos sanos a los que consecutivamente se realizó una nefrectomía para donación renal en el Hospital del Mar de Barcelona, entre enero de 2001 y marzo de 2015. El FGm se llevó a cabo mediante renograma con Tc99m-DTPA entre 2y 6meses antes de la nefrectomía y el FGe mediante las fórmulas basadas en la creatinina plasmática según MDRD4 y CKD-EPI como parte del protocolo del estudio de donante vivo, tomando como referencia el valor de creatinina más cercano a la fecha de la donación.
Todos los procedimientos se realizaron de acuerdo con la Declaración de Helsinki y todos los donantes firmaron un consentimiento informado que incluía los procedimientos incluidos en el presente estudio.
Medida de la función renalSe realizó renograma isotópico, con la administración en bolo intravenoso de 5-10 mCi (370 Mbq) de Tc99m-DTPA, un isótopo radioactivo cuya actividad puede ser detectada en el cuerpo humano a través de cámaras especiales. La eliminación del Tc99 es mayor por filtración glomerular, sin reabsorción ni secreción tubular y sin adhesión a proteínas plasmáticas. Cada 30-60 segundos se toman imágenes computarizadas con el fin de evaluar la perfusión arterial renal, el tránsito a través del parénquima renal y la excreción del radiotrazador a través de la pelvis renal, uréteres y vejiga.
Estimación de la función renal. Ecuaciones basadas en creatininaEl FGe se obtuvo a partir de la determinación de creatinina realizada con trazabilidad al método de referencia de dilución isotópica-espectrometría de masas (IDMS) en muestras de sangre usando las siguientes fórmulas:
- 1)
MDRD (IDMS) de 4 variables (MDRD4)=175×(creatinina)−1,154×(edad)−0,203×0,742 (si mujer)×1,210 (si raza negra)
- 2)
CKD-EPI calculado según género y estratificado por creatinina:
Mujeres
Creatinina≤0,7mg/dl: FGe=144×(creatinina/0,7)−0,329×(0,993)edad×1,159 (si raza negra)
Creatinina>0,7mg/d: FGe=144×(creatinina/0,7)−1,209×(0,993)edad×1,159 (si raza negra)
Varones
Creatinina≤0,9mg/dl: FGe=141×(creatinina/0,9)−0,411×(0,993)edad×1,159 (si raza negra)
Creatinina>0,9mg/dl: FGe=141×(creatinina/0,9)−1,209×(0,993)edad×1,159 (si raza negra)
Análisis estadísticoLas variables cuantitativas con una distribución normal se expresan como media y desviación estándar (DE) y el resto como mediana y rango intercuartílico. Todas las variables continuas presentan una distribución normal comprobada mediante la prueba de Kolmogorov-Smirnoff. Empleamos el coeficiente de correlación intraclase (CCI) para saber si las diferencias en la medición del FG mediante diferentes instrumentos de medición se deben al sujeto que las mide y no al método en sí. Dicho coeficiente estima el promedio de las correlaciones entre todas las posibles ordenaciones de los pares de observaciones disponibles y, por lo tanto, evita el problema de la dependencia del orden del coeficiente de correlación de Pearson (r), que únicamente tiene en cuenta la correlación lineal. Todos los análisis estadísticos se realizaron con el programa SPSS versión 20.0 (SPSS Inc., Chicago, IL, EE. UU.). Se consideró estadísticamente significativo un valor p<0,05.
ResultadosSe incluyeron 64 donantes renales consecutivos entre 2001 y marzo de 2015 (tabla 1). La edad media fue de 48±11 años, el índice de masa corporal 26,4±3,8kg/m2, el 70,6% eran mujeres, el 84% de raza caucásica. Cuatro donantes (6,6%) tenían hipertensión arterial bien controlada en tratamiento con un fármaco en el momento de la donación. Dos donantes (3,3%) tenían antecedentes de diabetes mellitus con glucemia basal normal y sin necesidad de fármacos en el momento de la donación. Ninguno tenía antecedentes de enfermedad cardiovascular o nefropatía. Antes de la donación renal, la creatinina sérica media fue de 0,8±0,15mg/dl. El FG basal medido mediante Tc99-DTPA fue de 99,4±22,4ml/min, y el FGe mediante MDRD4 y CKD-EPI de 88,3±19,3 y 93,5±15,9ml/min, respectivamente. El FGm por DTPA del riñón donado fue de 48,9±11,9ml/min mientras que el del riñón remanente fue de 50,6±12,2ml/min. Al año de la donación, ningún donante había fallecido o requerido tratamiento renal sustitutivo.
Características basales de los 64 donantes renales incluidos en el estudio
| Edad predonación (media±DE) | 48,3±11 |
| Sexo femenino (%) | 70,6 |
| Raza/etnia N (%) | |
| Caucásica | 54 (84) |
| Hispánica | 6 (9) |
| Negra | 2 (3,5) |
| Asiática | 2 (3,5) |
| Índice de masa corporal | 26,4±3,8 |
| Creatinina sérica basal (media±DE,mg/dl) | 0,8±0,15 |
| Filtrado glomerular estimado MDRD4 basal (media±DE,mL/min/1,73 m2) | 88,3±20,1 |
| Filtrado glomerular estimado CKD-EPI basal (media±DE,mL/min/1,73 m2) | 93,5±16 |
| Filtrado glomerular medido por DTPA basal (media±DE,mL/min) | 99,4±22.4 |
| Filtrado glomerular medido por DTPA del riñón remanente (media±DE,mL/min) | 50,6±12,25 |
| Filtrado glomerular medido por DTPA del riñón donado (media±DE,mL/min/1,73 m2) | 48,9±11,9 |
Tanto MDRD4 como CKD-EPI presentan una correlación lineal significativa con el método de FGm, que es más significativa con CKD-EPI (r=0,41; p=0,004) que con MDRD4 (r=0,27; p=0,05) (fig. 1). Si realizamos el mismo análisis haciendo distinción por género, se mantienen similares resultados para CKD-EPI (mujeres r=0,36 y p=0,03; varones r=0,57 y p=0,02); sin embargo, se pierde la significación de la correlación entre FGm y MDRD4.
Correlación entre los diversos métodos de estimación y medición del filtrado glomerular.
A) Correlación entre las fórmulas estimativas MDRD4 y CKD-EPI. B) Correlación entre el FG estimado por MDRD-4 y el medido con Tc99-DTPA. C) Correlación entre el FG estimado por CKD-EPI y el medido con Tc99-DTPA.
CCI: coeficiente de correlación intraclase; FG: filtrado glomerular.
El CCI entre MDRD4 basal y CKD-EPI basal fue de 0,86 (p<0,001), lo que indica una buena correlación entre ambas fórmulas (fig. 1). Sin embargo, al comparar la medición por DTPA con las fórmulas estimativas, el CCI mostró un correlación escasa tanto para CKD-EPI como para MDRD4, que fue algo mejor para la primera fórmula (CCI=0,362; p=0,025) que para la segunda (CCI=0,248; p<0,001). Cuando realizamos el análisis por género, comprobamos que el CKD-EPI incrementa su poder de correlación con FGm para ambos sexos (mujeres CCI=0,49 y p=0,02; varones CCI=0,65 y p=0,03) y MDRD4 mantiene escasa correlación con DTPA.
Ambas fórmulas infraestimaron el FG con respecto al FGm. La diferencia entre FGm y FGe fue estadísticamente significativa con MDRD4 (9,4±25ml/min menor que el medido por Tc99-DTPA, p<0,05), pero no con CKD-EPI (4,4±21ml/min inferior al FGm, p=0,145). Además, el FGe por MDRD4 fue 5ml/min menor que el estimado por CKD-EPI (p<0,001).
En cuanto al FGm entre ambos riñones del donante, se observó una diferencia no significativa de 1,7±8ml/min (p=0,145) entre el riñón trasplantando y el riñón remanente: siempre era mayor el FGm del riñón remanente.
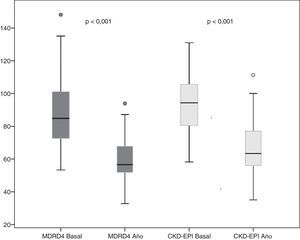
Resultados de la función renal del donante al añoSesenta donantes completaron el seguimiento a 12meses y se perdió el seguimiento de 4. Al año de la donación, la creatinina de los donantes fue de 1,1±0,2mg/dl. El FGe se redujo a 59,6±11 y 66,2±14ml/min por MDRD-4 y CKD-EPI, respectivamente. Esto supone una disminución media del FGe al año de la donación con respecto al FGe basal de 28,2±16,7ml/min por MDRD-4 y de 27,31±14,4ml/min por CKD-EPI (fig. 2).
DiscusiónEn el presente estudio, analizamos una cohorte de donantes renales vivos en los que se evaluó la función renal previa a la nefrectomía con métodos de medición y fórmulas estimativas basadas en la creatinina sérica. Nuestros resultados reflejan que el grado de correlación entre las fórmulas estimativas y el FGm mediante DTPA es escaso: ambas fórmulas infraestiman el FG con respecto al valor obtenido por DTPA. Sin embargo, dicho efecto parece ser menos marcado con la fórmula CKD-EPI.
Estudios previos que han comparado la aplicación de MDRD4 y CKD-EPI para la evaluación de la función renal en el potencial donante con alguno de los métodos de medición disponibles han encontrado resultados dispares. Macías et al.18 compararon el FGm con EDTA-Cr51 y las fórmulas estimativas, y encontraron mejor correlación en los valores de FG proporcionados por MDRD4 y MDRD6 que por CKD-EPI, por lo que los autores aconsejaban MDRD como herramienta para cribado de potenciales donantes renales. Más acorde con nuestros resultados, Lujan et al.19, al comparar en 85 donantes el FG medido con iotalamato y el estimado con MDRD4 y CKD-EPI, encontraron mayor precisión y menor sesgo con CKD-EPI que con MDRD4. Otros estudios han evidenciado coeficientes de correlación lineal adecuados entre las fórmulas estimativas —sin diferencias entre ellas— y el FGm con iohexol19,20.
La correcta evaluación de la función renal del potencial donante es crítica, dada su influencia decisiva en la función futura del injerto y del riñón remanente en el donante. Tras la nefrectomía, el donante pierde el 50% de su FG. La compensación del riñón restante alcanza el 70% de la función inicial; el factor más influyente en la función final alcanzada es el FG previo a la donación, aunque también la edad, sexo, raza y tamaño corporal15,20. En nuestro estudio encontramos que la compensación de la función renal de los donantes tras un año de la donación con respecto a la basal fue del 67,8% si la medimos mediante MDRD4 y del 70,8% si mediante CKD-EPI.
A pesar de su importancia, no existe consenso general sobre el límite de función renal que debería permitir a los potenciales donantes someterse a una nefrectomía. Todas las recomendaciones sobre la evaluación de la función renal previa a la nefrectomía se basan en opiniones de expertos, sin que existan por el momento estudios aleatorizados con seguimiento a largo plazo que aborden el límite mínimo del FG para la donación renal ni el mejor método para determinarlo21,22.
No existe tampoco acuerdo en cuanto al mejor método para determinar la función renal del potencial donante. Se considera aconsejable el empleo de un método medido ya que, como reflejan varios estudios previos, la aproximación (correlación y porcentaje de error) del FG estimado por fórmulas o aclaramiento de creatinina al FG real medido es escasa18–20,23. Así, ante la inexactitud de los métodos de estimación, algunas guías, incluidas las españolas, recomiendan su medición directa con cualquier método, principalmente en casos de función renal cercana al límite propuesto para la donación24,25. Las guías europeas más recientes asumen el margen de error de las fórmulas de estimación, pero no lo consideran de la suficiente relevancia clínica como para recomendar el uso estricto de FGm: defienden las fórmulas estimativas como método principal, relegando los métodos de medición a los casos dudosos22. En multitud de programas de trasplante, el FG del potencial donante únicamente se estima, no se mide, con lo que es muy pertinente la búsqueda de la fórmula que mejor se ajusta al FG real y plantear la utilidad real de los métodos de medición empleados.
La principal limitación de nuestro estudio es el tamaño de la muestra analizada, que dificulta la extrapolación de los datos obtenidos a la población de donantes general. Por otro lado, nuestro estudio no incluye la medición del FG del donante al año, con lo que el análisis de precisión de las fórmulas se limita al estudio basal.
En conclusión, la fórmula CKD-EPI de estimación del FG es la que mejor se correlaciona con el FGm-Tc99m-DTPA en la evaluación basal del donante renal, y su aplicación parece ser más apropiada que la de la fórmula MDRD4. Ambas fórmulas infraestiman el FGm, por lo que parecería lógico pensar que por encima de un determinado FGe la donación renal sería segura, dado que el FGm será probablemente superior. Sin embargo, la mejor evaluación de la función renal previa a la donación sigue siendo la combinación de ambas, particularmente en casos con función renal cercana al límite considerado aconsejable para la donación.
FinanciaciónEste estudio se ha podido realizar, en parte, gracias a la financiación de los proyectos FIS-FEDER PI13/00598, FIS-FEDER PI16/00617 y RETIC FEDER RD16/0009/0013 (RedinRen).
Conflicto de interesesLos autores declaran no tener conflictos de interés relacionados con el contenido de este artículo
Los autores agradecen a Sara Álvarez, Montserrat Folgueiras, Anna Faura, María Vera, Raquel Martín, Ernestina Junyent y a todo el equipo de enfermería nefrológica del Hospital del Mar su inestimable colaboración en este proyecto.