La infección por el poliomavirus BK ha tomado protagonismo en los últimos años como un problema cada vez de mayor dimensión en el trasplante renal, y es causa de deterioro de la función del injerto y de su pérdida. La infección por el poliomavirus BK ocurre principalmente en la infancia y establece infecciones persistentes dentro de las células tubulares renales y el urotelio, con implicaciones clínicas mínimas en los pacientes inmunocompetentes. Sin embargo, la reactivación del poliomavirus BK en inmunocomprometidos tras el trasplante renal o hematopoyético de células madre puede causar complicaciones graves, que incluyen la nefropatía asociada a poliomavirus BK, la estenosis ureteral y la cistitis hemorrágica. El uso de una inmunosupresión más potente y el aumento de la vigilancia postrasplante han dado lugar a una mayor incidencia de nefropatía por BK. La inmunidad antiviral desempeña un papel crucial en el control de la replicación del poliomavirus BK, y nuestro creciente conocimiento sobre las interacciones entre el huésped y el virus ha llevado al desarrollo de herramientas diagnósticas mejoradas y estrategias de abordaje clínico.
La nefropatía asociada al poliomavirus BK en los receptores de trasplante renal se relaciona con una menor supervivencia del injerto renal, ya sea por el daño asociado al poliomavirus BK o por el rechazo precipitado por una reducción de la inmunosupresión.
Actualmente, no hay agentes antivirales eficaces para la infección por el poliomavirus BK, y el pilar del control de su reactivación en el trasplante es la reducción de la inmunosupresión, con el objetivo de reconstituir las respuestas inmunitarias efectivas frente al virus. El desarrollo de terapias inmunológicas para combatir el polio-mavirus BK puede proporcionar nuevas oportunidades para el tratamiento de las complicaciones asociadas con el virus.
INTRODUCCIÓN
El virus BK (VBK) es un virus de doble cadena de ADN de la familia poliomavirus, que incluye también el virus JC y el SV-401. El VBK produce una infección asintomática en la infancia, de forma que el 70% de los niños con 10 años están infectados por el virus, probablemente por vía respiratoria u orofaríngea, pero no se conoce con detalle la vía de transmisión1. En consecuencia, la población general adulta presenta una alta prevalencia de seropositividad frente al VBK (> 80%)1,2. Después de la primoinfección, el VBK permanece latente en las células epiteliales del riñón y el tracto urinario en sujetos sanos de forma asintomática, aunque también se encuentra en leucocitos, cerebro y nódulos linfáticos. El VBK puede reactivarse en sujetos inmunodeprimidos y causar patología específica, como nefropatía en el trasplante renal o cistitis hemorrágica en los trasplantados de médula ósea. El nombre del VBK se debe a las iniciales del primer paciente en el cual se describió inicialmente el virus en 1971, un trasplantado renal con estenosis ureteral3.
Se han descrito 4 genotipos diferentes del VBK según la variación de las proteínas de la cápside VP1. El genotipo I es el más prevalente en humanos (distribuido por todo el mundo), seguido del tipo IV (presente en Europa y noreste de Asia). El tipo IV se subdivide a su vez en 4 subtipos, si bien no está claro si esto tiene importancia desde el punto de vista patogénico1. Los genotipos II y III son menos frecuentes. Las proteínas de la cápside VP1 son las responsables de la unión del virus a las células que infecta y su entrada se produce por un mecanismo de endocitosis mediado por caveolas4. El mecanismo por el cual el virus permanece silente durante largo tiempo en el huésped no se conoce con detalle, pero se sabe que codifica micro-ARN que regulan la replicación viral de manera similar a los herpesvirus1.
Desde el punto de vista inmunológico, el VBK provoca en el huésped una respuesta inmune de tipo innata y también de tipo adaptativa. La respuesta innata está mediada por células NK (natural killer) y células dendríticas5, junto con mediadores inflamatorios IL-6, IL-8, IFN-γ, RANTES, MCP-1 e IP-10, que están presentes en el tejido infectado por el VBK y participan en el desarrollo de la nefropatía por dicho virus6. La respuesta adaptativa está determinada tanto por la generación de células T específicas para el VBK del tipo CD8+ (mediada por células dendríticas) como por la respuesta humoral. El VBK induce la formación de anticuerpos específicos neutralizantes, que se unen a receptores virales restringiendo así su capacidad de infección. El 87% de los jóvenes sanos tiene anticuerpos IgG específicos frente al VBK7, y el 94% de trasplantados renales muestra anticuerpos neutralizantes frente al VBK en el momento del implante8. La mayoría son frente al genotipo I, y el 16% de los pacientes también muestra anticuerpos frente a 2 o más genotipos simultáneamente8. Como se verá más adelante, la respuesta humoral frente al VBK juega un papel importante en la limitación de la viremia y la nefropatía. Por otra parte, los anticuerpos neutralizantes son específicos para cada genotipo, de modo que los anticuerpos específicos frente al VBK-I tienen un escaso poder neutralizante frente al VBK-IV, y viceversa9.
La reactivación del BVK latente es frecuente en los pacientes inmunodeprimidos, y principalmente se ha descrito en trasplantados renales, aunque también en receptores de otros órganos sólidos como corazón, hígado y pulmón10 y en trasplantados de células hematopoyéticas; en estos causa cistitis hemorrágica en el 10%, generalmente a la segunda semana del trasplante11, y se detecta viruria positiva en el 50% de los trasplantados de médula ósea. En los trasplantes de órganos sólidos, la viruria por el VBK es más frecuente en trasplantados cardíacos (40%) y pulmonares (32-42%), seguido de los hepáticos (25%)10. Sin embargo, los casos de nefropatía por el VBK reportada en estos trasplantes no renales son escasos y probablemente esté infra-diagnosticada, pues no es habitual incluirla en el diagnóstico diferencial del fracaso renal agudo o crónico en los trasplantes de órganos sólidos no renales.
En esta revisión sistemática se describirá la epidemiología del VBK en el trasplante renal del adulto, los principales factores de riesgo, los criterios diagnósticos actuales y las principales estrategias terapéuticas disponibles hasta la fecha para el control de la infección.
EPIDEMIOLOGÍA
Incidencia del virus BK en el trasplante renal
En el trasplante renal, la presencia de viruria por el VBK es frecuente, entre el 15 y el 73% de los pacientes la desarrollan1,12-14, y el pico más elevado es al tercer mes postrasplante14-16. A partir de entonces disminuye progresivamente a lo largo del primer año. La viruria se presenta más precozmente que la viremia, cuyo pico se sitúa al quinto mes y es positiva en el 4,5-27% de los trasplantados renales13,14,17,18 según las series de casos publicadas. Afortunadamente, la incidencia de nefropatía por el VBK (daño histológico ocasionado por la replicación viral en tejido renal) es inferior, entre el 1 y el 9% de los pacientes13,17-20; en las series de trasplantes con biopsias de protocolo o seguimiento es en las que se encuentran las frecuencias más elevadas de nefropatía por el VBK19. Sin embargo, la nefropatía por el VBK no supera el 1% de las causas de pérdida del injerto1. Aunque la nefropatía por el VBK disminuye progresivamente tras los primeros meses, se ha reportado que el 10% de los pacientes con nefropatía por el VBK la desarrolla después del tercer año postrasplante19 y se ha descrito hasta 10 años después21. Por ello, algunos grupos recomiendan protocolos de vigilancia del VBK hasta 2 años después del trasplante y se aconseja determinar la viremia por el VBK en todas las biopsias realizadas19(evidencia baja). En algunos casos en los que la viremia se vuelve negativa, puede seguir habiendo positividad focal para SV-40 en la biopsia19; por ello es conveniente mantener un seguimiento en los pacientes que han aclarado el VBK (evidencia baja).
Una vez que el diagnóstico de nefropatía por el VBK se ha establecido, la monitorización de la viremia es el método que mejor refleja la gravedad del daño tisular por el virus22,23(evidencia baja).
Respecto al curso temporal de la viremia por el VBK, los pacientes con replicación precoz (en los primeros 6 meses postrasplante) presentan también más viremia por citomegalovirus (CMV), más tasa de rechazo agudo y peor compatibilidad HLA24. Por el contrario, los pacientes cuya replicación del VBK aparece tardíamente (después de los 6 meses postrasplante) son, con más frecuencia, pacientes retrasplantados y con una mayor tasa de anticuerpos anti-HLA24.
En el curso temporal de la infección por el VBK, la viruria precede a la viremia. Además, cuando aparece la viruria tiene un valor diagnóstico predictor de viremia, especialmente cuando es sostenida (2 o más determinaciones consecutivas separadas por 1-2 meses): una sensibilidad del 100% y una especificidad del 94%14(evidencia moderada). Los pacientes con viruria sostenida tienen una mayor carga viral que los que presentan viruria transitoria, y se ha mostrado una correlación positiva entre carga viral del VBK en orina y la carga viral en sangre14. Finalmente hay una relación directa entre gravedad de la viruria y de la viremia, el desarrollo de nefropatía por el VBK demostrada por biopsia: la viruria sostenida tiene valor pronóstico para el desarrollo de nefropatía por BK, con una sensibilidad del 100% y una especificidad del 91%, un valor predictivo positivo del 21,4% y un valor predictivo negativo del 100%. La viremia tiene un mayor valor predictivo que la viruria, con una especificidad del 96% y un valor predictivo positivo del 43% de desarrollar nefropatía por VBK14(evidencia moderada). Estos hechos se han confirmado en estudios posteriores y han demostrado que una viremia persistente alta (> 10.000 copias/ ml) se asocia con mayor riesgo de nefropatía por el BKV y con disfunción del injerto17,24(evidencia moderada/ baja).
Se ha observado un aumento de la tasa de rechazo agudo en pacientes con viremia elevada, tanto transitoria como sostenida12,17,25. El riesgo de rechazo llega a ser 3 veces superior al comparar pacientes con viremia elevada y transitoria con pacientes no virémicos17. En un reciente trabajo, que relaciona hallazgos histológicos en pacientes con infección por VBK, la nefropatía BK se correlacionó con alta incidencia de rechazo agudo (38%) tras la reducción de la inmunosupresión, y la mitad de ellos son rechazos humorales19. Es destacable que los hallazgos de rechazo celular agudo en la biopsia se asemejaron y se superpusieron a los de la nefropatía por BK en el 21% de los casos19. En este estudio, todos los pacientes que presentaron rechazo agudo habían negativizado previamente la carga viral. La alta tasa de rechazo observada tras la replicación del VBK puede justificarse por la reducción de la carga inmunosupresora como respuesta a la detección de la viremia; sin embargo, se han sugerido otras causas como la reactivación de mecanismos inmunológicos en respuesta a la infección viral17. De forma inversa, los episodios de rechazo agudo son un factor de riesgo para presentar reactivación del VBK25, por lo que en pacientes tratados de rechazo agudo se aconseja realizar un seguimiento posterior de la carga viral del VBK. También se ha descrito que la viremia persistente por el VBK incrementa el riesgo de aparición de anticuerpos específicos del donante de novo, especialmente de clase II26.
La importancia de diagnosticar a los pacientes con viruria o viremia precozmente radica en que, cuando se presenta la nefropatía por el VBK, el riesgo de pérdida del injerto aumenta en 2,01 veces27.
Factores de riesgo
La combinación de una inmunosupresión más potente y el aumento de la vigilancia postransplante han dado lugar a una mayor incidencia de nefropatía por BK19. Los factores que se relacionan con la reactivación son diversos, y se han descrito, entre otros, una peor compatibilidad HLA, el retrasplante, un alto grado de anticuerpos anti-HLA pretrasplante, el empleo de terapia de inducción con anticuerpos deplecionantes, el haber tenido rechazo agudo, el daño isquemia-reperfusión, la edad, el sexo masculino, el tener viremia por CMV y el haber perdido el injerto previo por nefropatía por el VBK24-33. Un resumen de estos factores se muestra en la tabla 1.
Respecto al tipo y potencia de la inmunosupresión, se conoce que en pacientes virémicos la disminución de la dosis de los inmunosupresores ocasiona una reducción de la carga viral del VBK17,28.
Terapia de inducción con anticuerpos
El uso de anticuerpos deplecionantes se asocia con mayor riesgo de tener poliomavirus BK28(evidencia baja). La administración de timoglobulina se asocia con una mayor duración de la viremia y con una mayor incidencia de nefropatía por el VBK comparada con la inducción con anticuerpos monoclonales anti-CD25 o con no inducción1,28-30,33(evidencia baja). Igualmente se ha reportado que los esquemas de desensibilización de pacientes hiperinmunizados basados en inmunoglobulinas intravenosas (i.v.), rituximab con inducción con alemtuzumab, no incrementan el riesgo de viremia por el VBK ni el mayor desarrollo de nefropatía por el VBK31.
Inhibidores de la calcineurina
En pacientes con alta tasa de viruria (> 107 copias/ml), el riesgo de desarrollar nefropatía por el VBK es 7,2 veces superior cuando se utiliza tacrolimus como inmunosupresor si se compara con esquemas terapéuticos sin tacrolimus28. Otros estudios observacionales del registro norteamericano OPTN también han encontrado un aumento del riesgo de desarrollar nefropatía por VBK en pacientes tratados con timoglobulina o la combinación de tacrolimus y micofenolato29.
En un ensayo clínico controlado, aleatorizado y abierto (estudio DIRECT) en pacientes trasplantados renales de novo se aleatorizaron 2 grupos a tacrolimus o ciclosporina (CsA)32. A los 6 meses, los tratados con CsA tuvieron significativamente menos tasa de viremia (10,6%) que los tratados con tacrolimus (16%); a los 12 meses, esta diferencia se incrementó entre el 4,8% con CsA frente al 12,1% con tacrolimus (p = 0,004). Además, en los pacientes con viremia, al año de seguimiento la carga viral era inferior con CsA (3,9 log10 copias/ml) que con tacrolimus (5,1 log10 copias/ml; p = 0,028). El perfil de mayor riesgo para desarrollar viremia por el VBK en este estudio fue el ser tratado con esteroides a mayores dosis, el uso de tacrolimus y micofenólico frente a CsA y micofenólico, el tener mayor edad y el ser del sexo masculino32(evidencia moderada/alta).
En un estudio observacional de trasplante renal con donantes vivos, el 27% presentó viremia positiva para el VBK; de ellos, el 3% desarrolló nefropatía por el VBK. Ninguno de los pacientes virémicos tratados con CsA desarrolló nefropatía por el VBK, y el 100% de los que la desarrollaron estaba tratado con tacrolimus18. Ambos grupos estaban tratados con esteroides y micofenolato18. En este mismo estudio, el uso de corticoides para el tratamiento del rechazo agudo (bolos de 1.000 mg de metilprednisolona × 3 dosis) fue un factor de riesgo independiente para el desarrollo de nefropatía por el VBK18.
Esteroides
Además del estudio anterior18, otros autores han encontrado relación entre el uso de corticoides para tratar el rechazo agudo y la aparición de viremia y nefropatía por el VBK; así, los pulsos de esteroides incrementan un 21% el riesgo relativo de replicación viral y un 38% el de nefropatía por BK33. En los pacientes con mayor incompatibilidad HLA, el tratamiento con bolos de esteroides aumentó significativamente el riesgo de viremia en un 28% y de nefropatía en un 78% (evidencia baja).
Ácido micofenólico
Es difícil encontrar evidencias sobre el papel aislado del micofenolato como factor de riesgo de infección por el VBK, ya que se utiliza generalmente en combinación con otros inmunosupresores. Sin embargo, un estudio multicéntrico, prospectivo, aleatorizado y controlado se diseñó para comparar la incidencia de viruria, viremia y nefropatía por el VBK en 3 grupos de pacientes tratados con doble terapia con prednisona y CsA, prednisona y micofenolato sódico y prednisona y everolimus seguidos durante 2 años13. Todos los pacientes se indujeron con basiliximab. Desde la aleatorización, el grupo de pacientes con micofenolato presentó una tasa de viruria significativamente superior (43,6%) a la de los tratados con CsA (16,9%) y everolimus (19,8%). La viremia también fue significativamente superior con micofenolato (7,7%) que con CsA (4,5%) o everolimus (3,1%). Finalmente, todos los pacientes que desarrollaron nefropatía por el VBK (el 1,3% de la cohorte total) pertenecían al grupo de micofenolato. Los pacientes de este grupo también presentaron más tasa de rechazo agudo y peor supervivencia del injerto (evidencia moderada). En otro estudio, observacional y con tratamiento con micofenolato e inhibidores de la calcineurina, los pacientes con viremia y que tenían dosis más altas de micofenolato en el momento de detectarse la replicación tuvieron un mayor riesgo de progresar a nefropatía por el VBK24.
Otros factores de riesgo
La incompatibilidad HLA es otro factor de riesgo para la infección por el VBK; en un estudio observacional del registro de la OPTN, una incompatibilidad HLA igual o superior a 4 identidades se asoció con infección por el VBK27. Igualmente, los pacientes con más incompatibilidad HLA que son tratados con bolos de esteroides presentan más riesgo de viremia y de nefropatía por el VBK33.
Como ya se comentó en la introducción, el VBK provoca una respuesta inmune de tipo innata y también humoral; la mayoría de los trasplantados presenta anticuerpos neutralizantes anti-VBK en el momento del trasplante8,32. Al igual que ocurre con el CMV, el estatus serológico frente al VBK del donante y del receptor se relaciona directamente con la incidencia de infección por el VBK. Así, los donantes con anticuerpos anti-VBK que se implantan en receptores sin anticuerpos (D+/R–) son los que tienen mayor riesgo, el 41,4% desarrolla viremia al año, mientras que los D+/R+ la presentan en un 36%, los D–/R– en un 12% y los D–/R+ en un 10%12. De esta forma, la incidencia de viremia BK (odds ratio, intervalo de confianza del 95%) fue 5 veces mayor en el grupo D+ (40%) que en el grupo D– (11,8%). En este estudio, el estado seroinmunológico del receptor no parece influir en la incidencia de viremia BK12(evidencia baja). Estos hallazgos se confirman en otro estudio con trasplantados renales de donante vivo, en los que se determinaron los niveles de anticuerpos IgG frente al VBK en donantes y receptores. Los trasplantados con donantes con niveles elevados de IgG frente al VBK presentaban una incidencia mayor de viremia y de nefropatía por VBK, mientras que los niveles de IgG en el receptor parecen ser protectores, pero no se alcanzó significación estadística. Los donantes con alto nivel de anticuerpos frente a receptores con bajos niveles de anticuerpos suponen el grupo de mayor riesgo de viremia y nefropatía, con un riesgo 10 veces mayor18. Se ha sugerido que la tasa de anticuerpos anti-VBK en el donante podría reflejar la carga viral que transmite al receptor, por lo que su determinación podría tener interés clínico18(evidencia baja).
En un reciente estudio, en el que se determinan los títulos de anticuerpos específicos frente a genotipos del VBK, se ha encontrado que los pacientes con títulos altos de anticuerpos presentan menos riesgo de desarrollar viremia; por cada incremento log10 en los niveles de anticuerpos del receptor se reduce el riesgo de viremia un 56%8.
Los anticuerpos neutralizantes frente al VBK son específicos de cada genotipo, de manera que los anticuerpos anti-VBK-I tienen una pobre respuesta neutralizante frente al genotipo IV, y viceversa9. La determinación del estatus serológico en el receptor también puede ser útil para detectar la primoinfección por algún genotipo en los casos en que se produzca la seroconversión de negativo a positivo en el postrasplante. Se ha sugerido que la inmunización de los receptores antes del trasplante con vacunas multivalentes frente al VBK o la administración de anticuerpos inmunizantes podrían ser útiles en el control de la infección por el VBK y sus consecuencias en el injerto9.
Aunque la determinación del estado serológico de anticuerpos neutralizantes de BK puede ser útil para la estratificación del riesgo de infección en trasplante renal, todavía debe validarse su utilidad clínica, ya que su determinación es compleja y actualmente su uso se limita a estudios de investigación.
Se ha descrito que los pacientes que metabolizan más rápidamente el tacrolimus tienen mayor incidencia de viremia y nefropatía por el VBK34. En este trabajo de casos-controles, los metabolizadores rápidos se definen como los que tienen un cociente concentración/dosis (C/D) de tacrolimus < 1,05 ng/ml*1/mg 1 mes después del trasplante. Sin embargo, estos resultados podrían estar desvirtuados porque los casos tenían más serología D+/R– para CMV (30%) que los controles (9%), y se ha descrito que los pacientes con alto riesgo para infección por CMV (D+R–) tienen un riesgo incrementado de infección por el VBK24. Los autores sugieren que la determinación del cociente C/D de tacrolimus podría identificar a pacientes en alto riesgo de infección-enfermedad por el VBK (evidencia baja).
Otro factor de riesgo para la infección por el VBK es la alteración de la respuesta inmune celular al virus. La monitorización de subpoblaciones linfocitarias CD4+ y CD8+ puede ser útil como marcador de riesgo de viremia por virus BK35,36(evidencia baja); los pacientes con células T CD8+ específicas frente al VBK que expresan TNFα e IFN-γ tienen niveles más bajos de viremia y menos episodios de replicación viral35. La pérdida de células T específicas frente a antígenos del VBK después del trasplante, así como el descenso de los niveles de IFN-γ, se relaciona con mayor riesgo de replicación del VBK36. En este mismo sentido, los inmunosupresores pueden influir en la replicación del VBK modulando la respuesta inmune: los inhibidores de la calcineurina y la prednisona reducen la secreción de citocinas y la capacidad lítica de las células T CD4+ específicas para BK, mientras que los imTOR (inhibidores del ligando de la rapamicina en los mamíferos [mammalian target of rapamycin]) no reducen la actividad de citocinas, efectora ni citolítica de las células T específicas para el VBK37, por lo que tendrían a priori un perfil más favorable para el control del virus (evidencia baja).
En relación con el posible papel favorecedor de neoplasias del VBK, aunque este virus se ha clasificado por la OMS como posible carcinogénico para humanos, la evidencia que apoya el papel del VBK como agente causante de neoplasias en humanos todavía es escasa y controvertida38(evidencia baja); sí se ha reportado que los pacientes trasplantados renales con replicación activa del VBK tienen más riesgo de desarrollar tumores de vejiga, en especial si tienen antecedentes de tabaquismo39(evidencia baja). En un reciente análisis del registro de cáncer norteamericano, no se ha encontrado un mayor riesgo de tumores renales en pacientes con nefropatía por el VBK, pero sí se ha constatado en ellos un riesgo significativo 3 veces superior de presentar cáncer de vejiga40 y 2,2 veces de tener tumores uroteliales de pelvis y uréter (estos últimos casi en la significación estadística).
Correlación clinicohistológica
La reactivación del VBK en forma de viremia en el trasplante renal puede progresar a nefropatía en el 1-10% de los casos41. El principal causante de la nefropatía por BK es el daño tubular directo causado por el propio virus en forma de necrosis tubular aguda e inflamación intersticial, que puede finalizar en inflamación subaguda y desarrollo de fibrosis intersticial y atrofia tubular, con la consecuente pérdida de función del injerto. Algunos estudios describen la evolución histológica y su correlación clínica y virológica con detalle gracias a biopsias seriadas en el tiempo22,41.
En el estudio de Drachenberg et al19 se siguió a 71 pacientes biopsiados con nefropatía por el VBK; la positividad para SV-40 en la biopsia se correlacionó con la reacción inflamatoria tubulointersticial y con la infiltración de células plasmáticas, aunque no se relacionó con la carga viral en sangre. El 58% de los pacientes presentaron fibrosis en la última biopsia de seguimiento y un aumento del score de “ci” y “t” entre la primera y la segunda biopsia predijo la pérdida del injerto. La validez de estos resultados ha sido confirmada por el trabajo reciente del grupo de BANFF42 en cuanto al valor pronóstico de la fibrosis. En el estudio de Drachemberg et al, los injertos con nefropatía BK tienen una alta tasa de rechazo agudo (38%), que puede asemejarse e incluso sobreponerse a un rechazo agudo mediado por células T. Además, más del 50% de los rechazos fue mediado por anticuerpos. La progresión de la lesión finalizó con pérdida del injerto en el 15% de los casos o bien en daños histológicos muy graves en los riñones que siguen siendo funcionales19(evidencia moderada). Nankivell et al41 reportan una tasa de pérdida del injerto del 38% y, de ellos, el 58% debido a una infección no controlada del VBK, pero el otro 42% perdió el injerto por rechazo crónico (sin marcaje de SV-40 en la biopsia). En definitiva, en la nefropatía por el VBK tanto la progresión a fibrosis como el aumento del rechazo contribuyen a la pérdida del injerto19,22,41(evidencia baja/moderada). Los autores recomiendan determinar la presencia del VBK en las biopsias por indicación, cuando aparece necrosis tubular aguda e infiltración de neutrófilos o células plasmáticas, o en los rechazos que ocurren en los primeros meses postrasplante, cuando la viremia por el VBK es más frecuente41(evidencia baja).
Desde el grupo de trabajo del poliomavirus BK de BANFF, se acaba de publicar un trabajo que, desde el punto de vista histopatológico, propone una nueva clasificación42 de la gravedad de la nefropatía por el VBK, que viene a renovar las 4 propuestas que existían hasta la fecha desde 2001 hasta 2013 (resumidas en la referencia 43). Este grupo plantea 3 estadios o clases de nefropatía por el VBK: clase 1, como un estadio precoz con pronóstico más favorable, y clases 2 y 3, con peor pronóstico; en la clase 3, la probabilidad de pérdida del injerto es del 50% 2 años después de la biopsia diagnóstica. Esta nueva clasificación se basa en 2 aspectos histológicos: a) la cuantificación de la replicación viral en el epitelio tubular en 3 niveles (1, 2 y 3) mediante inmunohistoquímica (positividad para SV-40) o inclusiones virales intracelulares, y b) el grado de gravedad de la fibrosis intersticial (score “ci” de la clasificación de BANFF, grados 1, 2 y 3).
Técnicas diagnósticas. Monitorización
Ya que las opciones terapéuticas (como se verá más adelante) son muy limitadas, el screening y diagnóstico precoz de la infección o reactivación del VBK son fundamentales para establecer medidas dirigidas a evitar el daño histológico y la pérdida de función del injerto renal. El genoma del VBK puede detectarse en orina y en sangre. También pueden detectarse células infectadas con inclusiones virales, detectables bien en orina o bien en muestras de tejido renal o urotelial. Las principales técnicas diagnósticas utilizadas en clínica son:
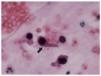
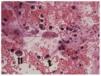
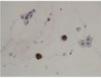
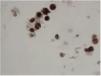
• Citología de orina: análisis al microscopio de sedimento urinario fresco, en el que se pone de manifiesto la presencia de células del epitelio urotelial infectadas por el virus, en forma de núcleos basófilos grandes con inclusiones virales nucleares (figs. 1 y 2). Esta técnica no permite diferenciar la infección entre el VBK y el virus JC. Cuando se detectan las células infectadas (células decoy o señuelos), es signo de infección (alta especificidad, 84%), pero si es negativa no se descarta la infección (baja sensibilidad, 25%). Su valor predictivo positivo es bajo (29%) y el valor predictivo negativo, muy alto (100%)44. Como ventajas está su bajo coste y su sencillez para ponerla en práctica. Existe una variante de citología que consiste en teñir las células descamativas en orina para SV-40, con lo que aumenta la sensibilidad y el valor predictivo positivo (figs. 3 y 4)20.
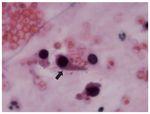
Figura 1. Células decoy en sedimento urinario acompañadas por hematíes. Núcleos aumentados de tamaño y basófilos, con citoplasma en forma de gota típica en el centro (flecha). Arriba a la derecha, célula polinuclear (p). HE, 600×. Cortesía de la Dra. Rosa Ortega, Servicio de Anatomía Patológica, Hospital Universitario Reina Sofía, Córdoba.
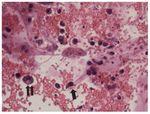
Figura 2. Sedimento de orina en paciente con nefropatía por virus BK (VBK). Se observan numerosas células infectadas por VBK (células decoy) con núcleos grandes muy basófilos, una de ellas en forma de típica gota (flecha) rodeada de múltiples hematíes, algunos linfocitos. A la izquierda se destaca una célula con doble núcleo (doble flecha). HE, 200×. Cortesía de la Dra. Rosa Ortega, Servicio de Anatomía Patológica, Hospital Universitario Reina Sofía, Córdoba.
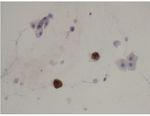
Figura 3. Citología de orina con células decoy en el centro (marrón) junto a células epiteliales, a derecha e izquierda, no infectadas (azul claro). Inmunohistoquímica con SV-40. 600×. Cortesía de la Dra. Rosa Ortega, Servicio de Anatomía Patológica, Hospital Universitario Reina Sofía, Córdoba.
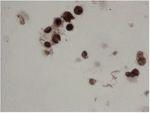
Figura 4. Células positivas para SV-40 en citología de orina, con un molde celular que refleja un muy probable daño tubular, sugestivo de nefropatía por virus BK. A la derecha, célula infectada binucleada y polinucleada. Inmunohistoquímica 600×. Cortesía de la Dra. Rosa Ortega, Servicio de Anatomía Patológica, Hospital Universitario Reina Sofía, Córdoba.
• Viruria: consiste en la detección del ADN viral presente en la orina mediante amplificación por reacción en cadena de la polimerasa (PCR) en tiempo real. La mayoría de los ensayos de PCR se basan en sondas frente al genotipo I del VBK y, aunque también pueden detectar otros genotipos, son mucho menos sensibles; además existe variabilidad entre diferentes fabricantes de ensayos y no hay un estándar para comparar entre laboratorios43,45. La viruria tiene mayor sensibilidad (91-100%) y especificidad (54-94%) que la citología urinaria15,43,44, pero es más cara y requiere un laboratorio de microbiología con posibilidad para realizar PCR en tiempo real. La mayoría de grupos asume que el punto de corte para considerar una viruria significativa está en 107 copias15,43(evidencia baja).
• Viremia: detección en sangre periférica del ADN viral mediante PCR en tiempo real. Las limitaciones descritas para la viruria son las mismas que para la viremia, ya que la técnica es la misma. Tiene una alta sensibilidad y especificidad (el 100 y el 88%, respectivamente), mejor que la citología de las células decoy44(evidencia baja/ moderada). El punto de corte de viremia para predecir nefropatía por el VBK se ha establecido en 104 copias15,43(evidencia baja).
• Biopsia renal: la histología de la nefropatía por el VBK se presenta como necrosis tubular e infiltración celular focal y/o fibrosis, que puede confundirse con rechazo celular agudo. Las células infectadas se detectan por la positividad a la tinción inmunohistoquímica de SV-40, que es un anticuerpo monoclonal frente al antígeno del virus SV-40 (simian vacuolating virus 40) que presenta la familia de los poliomavirus y que comparte la glucoproteína VP1 presente también en el VBK (v. “Introducción”). Cuando se detecta positividad frente a SV-40 en tejido, es patognomónico de infección por el VBK43. Dado que el infiltrado inflamatorio y la infección por el VBK pueden ser focales y el error de muestreo, aleatorio innato de la biopsia, una biopsia negativa no descarta por completo la nefropatía por el VBK. Por ello se recomienda obtener al menos 2 cilindros de tejido con parte de médula para llegar a un diagnóstico correcto43. Debe recordarse que la nefropatía por el VBK puede presentarse junto con un rechazo agudo o crónico, celular o humoral de forma concomitante43(evidencia baja).
Se han propuesto diferentes esquemas de monitorización del VBK en el trasplante, que se basan en screening, bien mediante viruria o bien mediante viremia14,25,42-44. Ambos son válidos para el screening de infección por BK (opinión). La viruria es el marcador más precoz de la infección activa por BK y es útil para detectar receptores con alto riesgo de desarrollo de viremia y de nefritis por VBK44. Su valor predictivo positivo es del 40% (evidencia baja/moderada). La detección de viremia de BK ofrece una mayor sensibilidad y valor predictivo positivo y una mayor área bajo la curva ROC que las células decoy en orina para predecir la nefropatía por BK29. Su valor predictivo positivo es superior a la viruria, 50-60%43,44(evidencia baja/moderada).
Los defensores de la viruria como test de screening se basan en que su aparición precede a la viremia; el VBK en orina puede detectarse de forma transitoria con baja carga viral, cuando la viremia es todavía negativa o muy baja46. La carga viral elevada en orina se relaciona con la presencia de viremia, de manera que los pacientes con alto grado de viruria tienen 50 veces más riesgo de tener viremia o nefropatía BK46. La presencia de alto grado de viruria (> 25 millones de copias) es un fuerte predictor de infección sistémica por BK, con un área bajo la curva de 0,971 (evidencia baja). El tiempo medio de aparición de viremia tras la viruria en el trabajo de Chon et al fue de 35 días46.
Otros grupos prefieren la viremia como test de screening43, por su mejor valor predictivo positivo sobre la viruria y por tener un valor predictivo negativo del 100%. Además se recomienda que los pacientes con viremia positiva tengan un seguimiento estrecho, incluso después de aclarar el virus15.
En opinión del panel de expertos, el método de screening y monitorización del VBK más adecuado para cada centro dependerá de su disponibilidad diagnóstica (carga viral en sangre, en orina y citología urinaria), recomendándose viruria o viremia (opinión).
Monitorización del virus BK. Algoritmos diagnósticos
Dado que la mayor incidencia de la infección por el VBK en el trasplante renal ocurre en los primeros meses postrasplante, se han propuesto diferentes métodos de monitorización y seguimiento de screening para la detección precoz del virus. Lo más habitual es una determinación mensual de viruria o viremia durante los primeros meses3-6, con espaciamiento cada 2 o 3 meses hasta el primer año17,28,42,43,47. Algunos grupos proponen un seguimiento más allá del primer año (trimestral hasta el segundo año postrasplante) y posteriormente una determinación anual en caso de disfunción del injerto28. Como ya se ha comentado anteriormente, debe realizarse una determinación de viruria o viremia ante una disfunción del injerto por causa no explicada, especialmente después de tratar un rechazo agudo.
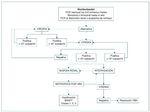
Esquemas y algoritmos. Se han propuesto diferentes algoritmos diagnósticos y de screening para la infección por el VBK en el trasplante renal. Aunque el screening puede realizarse mediante viruria o viremia, los 2 algoritmos más difundidos43,46 coinciden en iniciar la monitorización mediante cuantificación de la carga viral del VBK mediante PCR en orina. En la figura 5, el grupo de expertos propone un algoritmo propio y similar a los descritos: el screening puede iniciarse en el período postrasplante con una determinación mensual de viruria o viremia, que a partir del tercer al sexto mes se puede espaciar con una periodicidad bimensual o trimestral, hasta llegar al primer año de seguimiento postrasplante. Si después del primer año ocurre un deterioro de la función renal no explicado, también debe cuantificarse la viremia o la viruria. Ante un resultado positivo de viruria > 107 copias/ml, debe solicitarse la viremia. Si la viremia es negativa o < 104 copias/ml, la probabilidad de que exista nefropatía por BK es baja y debe continuarse con la monitorización de la carga viral en sangre o en orina; si la viremia es > 104 copias/ml, la posibilidad de que exista nefropatía por BK es elevada, por lo que, si es posible, está indicada una biopsia renal. Como alternativa a la biopsia se puede reducir la inmunosupresión y continuar con la monitorización de la viremia; si no se negativiza o no mejora la función renal debería hacerse la biopsia, para hacer el diagnóstico histológico y clasificarlo en su gravedad, además de descartar la coexistencia de un rechazo agudo. Una vez diagnosticada la nefropatía por el VBK, se debe reducir la carga inmunosupresora mediante las alternativas propuestas en el apartado siguiente. El seguimiento propuesto tras la biopsia es mediante viremia hasta alcanzar su negativización.
Figura 5. Algoritmo para la monitorización de la infección por virus BK (VBK) en el trasplante renal. PCR: reacción en cadena de la polimerasa.
Tratamiento
La reducción en la inmunosupresión sigue siendo el pilar del tratamiento de la infección por el VBK17,24,25,28,30,48(evidencia baja/moderada). La disminución de la inmunosupresión reduce la viremia49 y la viremia alta persistente17 (evidencia moderada/alta para esta última), acelera el aclaramiento del VBK13,48 y mejora la supervivencia del injerto y del paciente48.
La reducción de la inmunosupresión puede realizarse de forma diversa: bien reduciendo la dosis de los inmunosupresores, bien suspendiendo alguno de los fármacos, bien sustituyendo unos inmunosupresores por otros.
En un estudio retrospectivo unicéntrico europeo, en pacientes con viruria elevada para el VBK, se muestra que la reducción de la dosis de inmunosupresores supuso una mejor supervivencia del paciente y del injerto comparada con los que se les mantuvo el tratamiento inmunosupresor, a pesar de que presentaban viruria más baja28(evidencia baja).
Un estudio observacional retrospectivo en pacientes con nefropatía por el VBK mostró que la retirada de un inmunosupresor (micofenolato o inhibidor de la calcineurina) en pacientes con triple terapia de mantenimiento fue más beneficiosa que reducir la dosis de estos, pero sin retirar ninguno30(evidencia baja). En este estudio, la mayoría de los pacientes que tras la suspensión se mantuvieron con un esquema basado en prednisona y sirolimus tuvo los mejores resultados, pero el tamaño muestral fue muy pequeño y con múltiples factores de confusión.
De entre los inhibidores de la calcineurina, la CsA se asocia con menor infección; es la que menos incidencia tiene de viruria, similar a la de los imTOR13,32. Precisamente, una de las alternativas para el control de la infección por el VBK consiste en sustituir tacrolimus por CsA13,24,30,32,44,48; el tratamiento o la conversión a prednisona y CsA se asocia con una menor tasa de replicación por el VBK y un aclaramiento más rápido del VBK13,48(evidencia moderada/alta). En un estudio multicéntrico, aleatorizado y prospectivo en 682 pacientes tratados con basiliximab, la combinación de esteroides, CsA y micofenolato resultó en menor tasa de viremia y menor carga viral en sangre que en los pacientes tratados con tacrolimus en lugar de CsA32.
En cuanto al papel del micofenolato, ya se comentó en el apartado de “Factores de riesgo” que apenas hay estudios sobre su papel en la infección por el VKB de forma aislada. Entre ellos, en un estudio multicéntrico, aleatorizado y controlado, el tratamiento dual con la combinación de prednisona y micofenolato sódico se asoció con una alta tasa de viruria (46%) comparado con prednisona + CsA (15,9%) o prednisona + everolimus (19,8%). La tasa de viremia por el VBK en el grupo tratado con micofenolato fue del 7,7%, con CsA, del 4,5% y con everolimus, del 3,2%; sin embargo, estas diferencias no fueron significativas. De los 224 pacientes del estudio, solo 3 desarrollaron nefropatía por BK, todos ellos del grupo de combinación de micofenolato y prednisona13. Por tanto, el micofenolato en terapia combinada con esteroides sin inhibidores de la calcineurina es una estrategia de alto riesgo para la infección por el VBK.
Las dosis elevadas de esteroides (más de 2 g i.v.) se asocian a una mayor carga viral en sangre en los 30 días posteriores a estas50. Sin embargo, no se dispone de estudios dirigidos a valorar el efecto de los esteroides de mantenimiento.
En cuanto a los imTOR y su papel en le infección por el VBK existen datos controvertidos. Algunos estudios muestran efecto beneficioso, mientras que otros no encuentran diferencias. Así:
• En un estudio retrospectivo, unicéntrico no aleatorizado, la conversión de tacrolimus a sirolimus a los 3 meses del trasplante se correlacionó con una menor incidencia de viremia por BK49(evidencia baja).
• Un trabajo observacional de una serie de casos muy limitada en receptores ABO incompatibles sugiere que el uso de everolimus podría reducir la replicación del VBK en sangre51(evidencia muy baja).
• Sin embargo, en un metaanálisis reciente no se encuentra diferencia en la incidencia de infección por el BKV entre regímenes basados en imTOR (solo o con dosis reducidas de inhibidores de la calcineurina) y regímenes basados en inhibidores de calcineurina a dosis habitual52. A pesar de que el metaanálisis tiene un alto nivel de recomendación, el estudio tiene una potencia limitada por la escasez de evidencias disponibles para su análisis (evidencia moderada/alta).
• En otra revisión no sistemática, los autores recomiendan una estrategia de reducción drástica de la dosis de inhibidores de calcineurina y/o micofenolato o bien la sustitución de micofenolato por everolimus y utilizar dosis bajas de inhibidores de calcineurina53. Destacan la necesidad de realizar ensayos clínicos controlados y aleatorizados que confirmen esta estrategia (evidencia baja).
• Respondiendo a la necesidad del punto anterior, muy recientemente se han publicado los resultados del estudio TRANSFORM, aleatorizado y controlado con más de 2.000 pacientes, en el que se demuestra una menor tasa de viremia BK (4,3% frente a 8%) en pacientes con terapia de mantenimiento basada en everolimus asociado a tacrolimus (con minimización de dosis) comparados con los tratados con la terapia estándar tacrolimus asociado a micofenolato54(evidencia moderada).
Por tanto, la conversión de un régimen de mantenimiento basado en tacrolimus a otro basado en imTOR es posible que sea una estrategia adecuada para el control del VBK, pero faltan estudios que confirmen inequívocamente la eficacia de esta combinación.
Agentes terapéuticos para el virus BK
Además de la reducción de la intensidad de la inmunosupresión para el tratamiento de la infección por el VBK, se han empleado diferentes fármacos con actividad antibiótica, como quinolonas o antivirales como cidofovir o leflunomida, así como inmunoglobulinas i.v. inespecíficas, como terapia adyuvante. Sin embargo, ningún antiviral ha mostrado hasta la fecha una evidencia alta de eficacia clínica frente al virus.
Con unos prometedores inicios, en los que las quinolonas mostraron capacidad de inhibir la replicación de ADN del VBK in vitro55, y algunos estudios clínicos observacionales con resultados positivos, un estudio multicéntrico, doble ciego, aleatorizado y controlado con placebo no fue capaz de demostrar que 1 mes de tratamiento con levofloxacino mejorase la carga viral del VBK ni mejorase la función del injerto renal56(evidencia alta). Estos datos se han confirmado posteriormente en un metaanálisis que demostró que el uso de profilaxis con fluoroquinolonas no es efectivo en la prevención de viremia BK en receptores de trasplante renal, y no reduce la incidencia de nefritis por BK ni las pérdidas de injerto20(evidencia moderada/alta)57.
No se ha demostrado un claro beneficio con cidofovir. Este fármaco se administra vía i.v., con una dosis de carga de 1 mg/kg de peso y de mantenimiento de 0,5 mg/kg cada 2 semanas. En un estudio retrospectivo en el que se utilizó cidofovir como terapia adyuvante a la reducción de la inmunosupresión, la tasa de aclaramiento viral fue similar entre los pacientes con cidofovir que sin él58(evidencia baja). Sin embargo, el brincidofovir, la formulación lipídica de cidofovir que tiene una menor nefrotoxicidad y puede administrarse por vía oral, ha demostrado in vitro capacidad para inhibir la replicación del VBK en células epiteliales humanas59, y está en fase de investigación clínica para el tratamiento de infecciones por virus de doble cadena de ADN (CMV, adenovirus, viruela, poliomavirus). Se ha comunicado su eficacia en un caso clínico de nefropatía por el VBK en un trasplante de médula ósea60. Varios ensayos clínicos están en marcha con este fármaco, que todavía no está autorizado para el uso clínico (evidencia baja).
Se ha sugerido el posible efecto beneficioso de leflunomida61 como adyuvante de la reducción de la inmunosupresión en la infección por el VBK. En algunos centros se usa como sustituto del micofenolato48. La leflunomida es un fármaco inmunosupresor aprobado para el tratamiento de la artritis reumatoide, y su metabolito activo (A771726) ha mostrado actividad antiviral. Su principal limitación en la clínica es la hepatotoxicidad. Los datos clínicos disponibles con leflunomida son muy limitados: los estudios publicados sobre su eficacia son de series muy cortas y sin grupo control, retrospectivos61,62, y que requieren dosis elevadas y con una alta tasa de efectos adversos62, mientras que otros estudios no han demostrado efecto beneficioso de leflunomida comparada con un grupo control de reducción de inmunosupresión63(evidencia baja).
Las inmunoglobulinas i.v. (IGIV) se han utilizado con cierta eficacia en el tratamiento adyuvante del VBK junto con la reducción de la inmunosupresión. Las inmunoglobulinas comerciales contienen anticuerpos capaces de neutralizar la mayor parte de los genotipos del VBK64. En un estudio unicéntrico, retrospectivo y controlado, el grupo de pacientes con nefropatía por el VBK tratados con IGIV aclaró la viremia 3,7 veces más que el grupo control y mostró una resolución de la viremia más rápida y eficaz (77%) que el grupo control (33%)48. Aunque se perdieron menos injertos entre los pacientes tratados con IGIV (27%) que en el grupo control (54%), no se alcanzó significación estadística. La dosis de IGIV en este estudio fue 100 mg/kg semanales durante 10 semanas (dosis acumulada total de 1 g/kg). Como limitación importante, en el estudio se utilizaron otras estrategias de reducción de la inmunosupresión y terapias alternativas (cidofovir, leflunomida, sirolimus, etc.) en ambos grupos de pacientes. En definitiva, el tratamiento combinado con IGIV adyuvante fue más eficaz en la disminución del VBK en sangre y tejidos, en comparación con la terapia convencional (reducción de tacrolimus o conversión a CsA, reducción de micofenolato mofetilo o conversión a leflunomida, reducción de prednisona, uso de ciprofloxacino o cidofovir)48. Sin embargo, se requieren estudios prospectivos controlados y con mayor número de pacientes para establecer una clara indicación del uso de IGIV para la nefropatía por el VBK (evidencia baja/moderada).
Como resumen de las diferentes estrategias disponibles para el abordaje y tratamiento de la infección por el VBK, en la tabla 2 se describen las principales medidas propuestas.
Prevención
Si las evidencias disponibles para el tratamiento del VBK ya son de por sí limitadas, las evidencias de estrategias de prevención son más escasas aún. No existe una evidencia clara sobre el beneficio de ninguna de las estrategias analizadas para la prevención de la infección frente al VBK65,66(revisión). A diferencia de lo que ocurre con el CMV, en la actualidad no se dispone de protocolos de profilaxis para el VBK. Se ha intentado el tratamiento profiláctico con quinolonas (ciprofloxacino, gatifloxacino y levofloxacino) vía oral entre 10 días y 3 meses postrasplante, con resultados muy limitados y, en general, sin éxito, bien como tratamiento56, bien como profilaxis67(evidencia alta). El estudio de Knoll et al, además de demostrar que la profilaxis con levofloxacino 500 mg al día durante 3 meses después del trasplante no previno la viruria por BK, reflejó un incremento significativo del riesgo de infecciones de gérmenes resistentes a quinolonas y mayor tasa de tendinitis (aunque no significativa) en el grupo tratado con levofloxacino67.
Una estrategia alternativa de prevención de la infección por el VBK es la utilización de esquemas inmunosupresores que hayan mostrado respuesta positiva frente al virus. En este sentido, los resultados preliminares del estudio TRANSFORM, anteriormente comentados, muestran una menor tasa de viremia BK en los esquemas inmunosupresores basados en everolimus + tacrolimus con minimización comparados con tacrolimus + micofenolato a dosis estándar54. El empleo de esquemas inmunosupresores con suficiente potencia para evitar el rechazo, pero con capacidad de limitar la replicación viral, es la estrategia más realista disponible en la actualidad para la profilaxis de la infección por el VBK. En cualquier caso se necesitan estudios con alta evidencia que confirmen estas medidas profilácticas.
La otra estrategia de prevención del VBK es la vacunación. Ya se ha destacado la importancia de la inmunidad celular en la respuesta a la infección viral del BK, y el uso de péptidos virales como inductores de la inmunidad celular frente al VBK está en estudio en este momento67. Sin embargo, al igual que ocurre con el CMV, hoy en día no se dispone de ninguna vacuna eficaz frente al VBK.
Retrasplante en pacientes con nefropatía previa por el virus BK
Una de las cuestiones que surgen es si los pacientes que han perdido un injerto por nefropatía del VBK pueden trasplantarse de nuevo o necesitan un período de aclaramiento del virus.
En un análisis retrospectivo de la base de datos norteamericana OPTN68, se describe una cohorte de 126 pacientes que perdieron el injerto por el VBK (o contribuyó a su pérdida) y fueron trasplantados de nuevo posteriormente en un tiempo medio (mediana) de 314 días. En este estudio no se disponía del dato de nefrectomía previa del injerto inicial. De todos los retrasplantes, el 17,5% precisó tratamiento por el VBK, y se perdió solo un injerto por recidiva de la nefropatía por el VBK. La supervivencia del injerto y del paciente al año (el 95,5 y el 98,5%, respectivamente) y a los 3 años (el 93,6 y el 98,5%, respectivamente) fue excelente. Desgraciadamente, en este estudio se desconoce el estatus de viruria o viremia de los pacientes retrasplantados.
Entre los reducidos casos publicados de retrasplante anticipado en pacientes con nefropatía por el VBK, en la mayoría de ellos se ha realizado nefrectomía del primer injerto en el mismo acto del retrasplante; sin embargo, también se ha descrito el retrasplante anticipado sin necesidad de realizar nefrectomía del primer injerto en una paciente cuya viremia se había negativizado69.
Se han descrito casos aislados de retrasplante renal exitoso en pacientes con viremias positivas, previa nefrectomía del injerto —en el momento del retrasplante— o sin ella70(evidencia muy baja). Esta estrategia puede ser útil en pacientes en los que no es posible retirar la inmunosupresión antes del siguiente trasplante renal (como en el caso de trasplantes combinados con otros órganos sólidos funcionantes).
Con las evidencias disponibles, se puede afirmar que el retrasplante es posible en casos de pérdida del primer injerto por nefropatía por el VBK. Las dudas surgen sobre el momento óptimo del retrasplante, el esquema inmunosupresor más adecuado y la necesidad o no de nefrectomía previa. Es recomendable que se espere a que la viremia se haga negativa antes de retrasplantar otro riñón71. Puede valorarse realizar la nefrectomía del injerto previo, pero ello no previene la recurrencia ni parece necesario (evidencia muy baja/baja).
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses potencial relacionado con los contenidos de este artículo.
Correspondencia:
Alberto Rodríguez-Benot
Servicio de Nefrología. Hospital Universitario Reina Sofía.
Avda. Menéndez Pidal, s/n. 14004 Córdoba.
alberto.rodriguez.benot.sspa@juntadeandalucia.es
Revisión por expertos bajo la responsabilidad de la Sociedad Española de Nefrología.