INTRODUCCIÓN
La poliquistosis renal autosómica dominante es la enfermedad quística hereditaria más frecuente, responsable del 6% de nuevos casos de enfermedad renal crónica terminal en Europa1.
Está causada por la mutación de dos genes: el PKD1, localizado en el cromosoma 16 y el PKD2, localizado en el cromosoma 4.
El 85% de los pacientes heredan la mutación del gen PKD1 y el 15% restante, la mutación del gen PKD2.
El 50% de los pacientes desarrollan enfermedad renal crónica terminal, apareciendo mucho antes en aquéllos con la mutación en el gen PKD1 (14-20 años antes).
Ambos genes, PKD1 y PKD2, codifican respectivamente unas proteínas de membrana denominadas poliquistina 1 y poliquistina 2, multifuncionales y esenciales para mantener el fenotipo reabsortivo de las células epiteliales del túbulo colector.
MECANISMOS PATOGÉNICOS INVOLUCRADOS EN LA FORMACIÓN DE LOS QUISTES
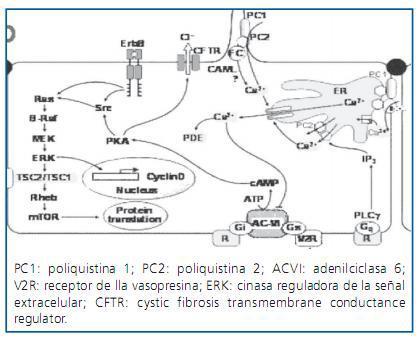
Las poliquistinas 1 y 2 (PQ1-PQ2) se localizan, entre otros lugares, en el cilio primario de las células del epitelio tubular. La PQ2 se comporta como un canal con alta permeabilidad para el calcio.
La PQ1 interacciona con la PQ2 favoreciendo la entrada de calcio dentro de la célula. Se ha sugerido que el cilio2 actúa como un sensor de flujo que permite que ambas proteínas se unan dejando que el calcio entre en la célula.
El calcio intracelular, en condiciones normales, limita la acumulación de monofosfato de adenosina cíclico (AMPc) en el epitelio tubular inhibiendo la adenilciclasa 6 (figura 1).
Modelos animales de poliquistosis han demostrado que el aumento de AMPc intracelular es responsable de dos procesos clave en el inicio y posterior desarrollo de los quistes: 1) secreción de líquido dentro del quiste, y 2) proliferación anómala de las células epiteliales3,4.
Secreción de líquido dentro del quiste
El AMPc activa el canal de cloro CFTR (cystic fibrosis transmembrane conductance regulator) en la membrana apical de las células epiteliales que recubren los quistes (figura 1) permitiendo la entrada de cloro, sodio y agua5-7.
Proliferación anómala de las células epiteliales
Se ha observado que las células epiteliales normales y las que recubren los quistes crecen a la misma velocidad en cultivos. En cambio, en presencia de AMPc las células normales disminuyen su tasa de crecimiento (respuesta antimitogénica) mientras que las células quísticas aumentan su tasa de proliferación (respuesta mitogénica).
Como consecuencia de la alteración en la homeostasia del calcio se produce una reprogramación de la vía Ras-B-Raf-ERK que permite al AMPc activar a B-Raf y a ERK, cinasa reguladora de la señal extracelular, responsable del aumento de la proliferación celular (figura 1).
Por otro lado, la PQ1 regula m-TOR, por lo que la disfunción de PQ1 implica una activación excesiva de m-TOR, cinasa que tiene un papel esencial en el metabolismo, el crecimiento y la proliferación celulares (figura 1).
Por tanto, y para resumir, en la célula poliquística existe un descenso del calcio intracelular, un aumento del AMPc y un exceso de actividad m-TOR.
No está del todo aclarado cómo la alteración en el cilio primario se relaciona con los otros componentes responsables de la formación de los quistes (aumento de AMPc, secreción de líquido dentro del quiste cloro dependiente y exceso de m-TOR), y además pueden existir otras vías que participen en la formación de los quistes que se desconocen en el momento actual8.
CRISP
En la poliquistosis, el aumento progresivo de los quistes lleva a un incremento en el volumen renal y al desarrollo de enfermedad renal en la sexta década de la vida9.
La hiperfiltración glomerular se asocia con la expansión de los quistes y la pérdida de nefronas.
Por tanto, se trata de una enfermedad con una larga fase asintomática y en la que, una vez iniciada la disfunción renal, el descenso del filtrado glomerular es rápido (~ 5,9 ml/min anual), por lo que las medidas clásicas para conocer la progresión de la enfermedad son poco efectivas.
Para establecer una medida fidedigna y objetiva de progresión de la enfermedad en fases tempranas se creó el estudio CRISP (Consortium for Radiologic Imaging Studies of PKD)10.
Es un estudio prospectivo, multicéntrico y observacional en el que a 234 pacientes poliquísticos con función renal conservada se les realizó una resonancia magnética nuclear (RMN) anual durante 3 años.
Se ha demostrado que antes de la pérdida de la función renal existe un crecimiento significativo de los quistes11; los pacientes hipertensos tienen mayor volumen quístico, existe una relación inversa entre el flujo sanguíneo renal y el volumen renal, y se ha observado que cambios en el volumen renal se relacionan inversamente con cambios en el filtrado glomerular.
Por tanto, la RMN es la mejor técnica para estimar cambios de volumen de los quistes y para saber si un tratamiento está siendo eficaz o no.
ESTUDIOS CLÍNICOS EN MARCHA
Estudio HALT-PKD
La enfermedad cardiovascular es la mayor causa de mortalidad.
La hipertensión arterial, además de contribuir a la enfermedad cardiovascular, es un predictor de progresión de enfermedad renal en la poliquistosis renal.
Más del 70% de los pacientes que inician hemodiálisis tienen hipertrofia del ventrículo izquierdo12.
La HTAocurre de manera precoz y anticipa la pérdida de función renal. Como consecuencia del crecimiento de los quistes, se produce isquemia renal y se activa el sistema reninaangiotensina-aldolterona (SRAA)13,14. El SRAA contribuye a la hipertensión y puede acelerar de manera independiente el crecimiento de los quistes renales.
Estos datos sugieren que el bloqueo intensivo del SRAA puede prevenir el deterioro de la función renal en pacientes poliquísticos.
El HALT es un estudio prospectivo, aleatorizado, diseñado para determinar el efecto del bloqueo del SRAA con inhibidores de la enzima convertidora de angiotensina (IECA) y bloqueadores de los receptores de angiotensina II (ARA II), en el retraso de la progresión de la enfermedad renal independientemente del control de la presión arterial (PA) y, además, si el control riguroso de la PA (<110/65-75 mmHg) frente al control estándar (130-120/80-70 mmHg) es más eficaz en retrasar la progresión de la enfermedad renal en fases tempranas de la enfermedad, es decir, cuando el filtrado glomerular (FG) es superior a 60 ml/min.
Se establecen dos grupos: A(FG >60 ml/min) y B (FG: 20-60 ml/min). El IECA, lisinopril, se administra a todos los pacientes del estudio y lo que se no se sabe es si añadiendo una ARAII, telmisartán en este caso, se conseguirá protección cardiovascular y renal.
En el grupo A, se distribuye aleatoriamente a los pacientes a recibir lisinopril + placebo frente a lisinopril + telmisartán y dos niveles de PA (estándar frente a rigurosa).
En este grupo, el objetivo primario es analizar los cambios en el volumen renal mediante RMN anual durante 4 años.
En el grupo B, los pacientes con FG <60 ml/min se distribuyen aleatoriamente a recibir lisinopril + placebo frente a lisinopril + telmisartán para conseguir un control estándar de la PA y el objetivo primario es el tiempo en doblar la cifra de creatinina, alcanzar la enfermedad renal crónica terminal o la muerte.
Este estudio proporcionará importante información sobre la progresión de la enfermedad por el elevado número de pacientes incluidos en el estudio y establecerá el beneficio del control de la PA y la inhibición del SRAA en ambos estadios (inicial y avanzado) de la enfermedad15.
Antagonistas de la vasopresina
El descubrimiento de los distintos mecanismos patogénicos responsables de la poliquistosis renal (PQ) ha permitido identificar numerosas dianas para distintas intervenciones terapéuticas que han sido eficaces en modelos animales16.
La inhibición del AMPc ofrecería un doble efecto beneficioso al regular dos de los procesos clave en el inicio y crecimiento de los quistes.
En numerosos estudios preclínicos, se ha demostrado que la administración de antagonistas de la vasopresina arginina (ADH), tolvaptán, reducía el nivel de AMPc, lo que se traducía en una reducción del volumen renal17.
Para confirmar que el efecto protector de estas drogas se debe al antagonismo de la ADH, se han cruzado ratas knock out para el gen de la vasopresina (brattleboro) con ratas poliquísticas para generar ratas poliquísticas con distintas cantidades de ADH. Y se ha observado que las ratas poliquísticas ADH¿/¿ tenían el nivel más bajo de AMPc y casi una completa inhibición de la cistogénesis, y que al añadir ADH aumentaba el AMPc y se recuperaba el fenotipo quístico, agravándose la enfermedad, lo que indica que la ADH es un poderoso modulador de la cistogénesis18.
La vasopresina se une a los receptores V2 localizados en la membrana basolateral de las células principales del túbulo colector, que a su vez están unidos a la proteína G activando ambas al AMPc (figura 1).
Bajo el programa TEMPO (Tolvaptan efficacy and safety in management and outcomes) se han completado varios estudios clínicos y otros siguen desarrollándose en el momento actual.
El estudio TEMPO3/4 finalizará en el año 2010 y es un estudio fase III, multicéntrico doble ciego, placebo-control en pacientes poliquísticos con función renal normal y volumen renal >750 ml, indicativo de rápida progresión de la enfermedad. El objetivo primario es el cambio de volumen renal mediante RMN durante 3 años. La dosis de inicio de tolvaptán es 60 mg dividido en dos dosis (45 y 15 mg) para ir aumentando semanalmente hasta una dosis total de 120 mg si se tolera (60 y 30 mg )19.
Análogos de la somatostatina
La somatostatina se fija a los receptores sst2 que se localizan en el riñón, inhibiendo a la adenilcliclasa y, por tanto, al AMPc.
En una paciente con poliquistosis y un tumor hipofisario sometida a tratamiento con octreotida, análogo de la somatostatina, durante 2 años, se observó mediante TAC que se había reducido el tamaño de los quistes.
Posteriormente, Ruggenenti20 realizó un estudio aleatorizado, longitudinal, para analizar la seguridad y la eficacia de octreotida mensual durante 6 meses en 12 pacientes con poliquistosis y distintos grados de función renal, observándose que fue bien tolerado, seguro y que el porcentaje de cambio en el volumen renal total fue menor respecto al grupo placebo.
Sin embargo, para saber si octreotida tiene un efecto renoprotector será necesario realizar estudios de mayor duración.
Adiferencia de los antagonistas de la vasopresina, éstos sí tienen acción sobre los quistes hepáticos.
En el momento actual, se están llevando a cabo varios estudios, entre ellos cabe mencionar un estudio piloto de octreotida en pacientes con poliquistosis hepática severa y un estudio fase III llevado a cabo por el Instituto Mario Negri que analiza los efectos de octreotida sobre la progresión de la enfermedad renal durante 3 años mediante el cambio en el volumen renal.
Sirolimus
La PQ1 suprime la actividad m-TOR, por lo que al existir una disfunción en la poliquistina se produce un exceso de activación de m-TOR.
m-TOR desempaña un importante papel en el crecimiento de los quistes.
Se ha demostrado que la inhibición de m-TOR con rapamicina y everolimus reduce el crecimiento de los quistes y la pérdida de función renal en modelos animales21.
Hay varios estudios en marcha, entre ellos destaca el estudio SUISSE22 por ser el primer estudio aleatorizado y controlado que examina la eficacia, la seguridad y la tolerancia del sirolimus en retrasar la progresión de la enfermedad en pacientes jóvenes con aclaramiento de creatinina >70 ml/min.
Se realiza una RMN en los meses 0 y 6, y los pacientes en los que se observa una progresión en el volumen renal son distribuidos de forma aleatoria a tratamiento con sirolimus 2 mg/día o a tratamiento estándar durante 18 meses.
El objetivo primario es observar si existe cambio en el volumen renal mediante RMN y, como objetivo secundario, analizar los posibles cambios en la función renal, la tolerancia y la seguridad del fármaco.
Recientemente se ha demostrado que sirolimus también reduce el volumen de los quistes hepáticos23.
Otros estudios
Recientemente se ha publicado el efecto del ácido eicosapentanoico en la función y el volumen renal en pacientes poliquísticos24.
Este ácido ω3 poliinsaturado redujo el tamaño de los quistes y retrasó el deterioro de la función renal en un modelo animal mediante un mecanismo antiinflamatorio.
Se realizó un estudio prospectivo, aleatorizado y multicéntrico para examinar la eficacia del ácido eicosapentanoico durante 2 años, sin que se haya podido demostrar ningún efecto preventivo en el descenso de la función renal ni en el incremento del volumen renal.
ESTUDIOS REALIZADOS EN MODELOS ANIMALES
Triptolida
Es un producto derivado de hierbas chinas usadas tradicionalmente como antiinflamatorio y en procesos autoinmunitarios.
Favorece la liberación de calcio intracelular, se comporta como un agonista de la PQ2 y frena el crecimiento celular en modelos animales embrionarios.
Leuenroth25 ha demostrado in vivo un efecto antiproliferativo en el epitelio quístico y una reducción significativa del número de quistes en estadios tempranos.
Moléculas pequeñas (Small molecules)
Tiazolidinonas
Modelos in vitro e in vivo han demostrado una reducción significativa en el crecimiento de los quistes al inhibir el canal de cloro CFTR, localizado en la membrana apical de las células epiteliales que revisten los quistes, por lo que, en el futuro, puede ser una herramienta terapéutica útil26.
Gamendazol
Actualmente está en investigación por ser un inhibidor de la espermatogénesis.
En modelos animales poliquísticos se ha observado una drástica reducción de los quistes27.
Apoptosis y caspasas
La apoptosis está aumentada en modelos animales y humanos de poliquistosis.
Está mediada por una familia de 14 proteasas llamadas caspasas.
Se ha observado que la inhibición de caspasas en un modelo animal atenuaba la formación de quistes28.
CONCLUSIONES
Aunque se han hecho avances significativos en el conocimiento de la patogenia de la enfermedad, y estamos cada vez más cerca de poder enlentecer su progresión, aún existen muchas preguntas sin respuesta, como plantea Chapman en una excelente revisión29.
- ¿Deberían ser tratados sólo los pacientes con más riesgo, es decir, aquellos con volúmenes renales elevados?
- ¿Cuándo se debe iniciar el tratamiento?
- ¿Será necesario el tratamiento de por vida o sólo durante cortos periodos de tiempo?
- ¿Cuál será la combinación más adecuada para tratar una enfermedad con manifestaciones sistémicas (enfermedad hepática, hipertensión, etc.)?
Tendremos que esperar a que finalicen los distintos estudios clínicos ya iniciados.
Figura 1.