Introducción: En ocasiones resulta difícil diferenciar la glomerulonefritis membranosa lúpica (GNML) de la Glomerulonefritis membranosa idiopática. Por otro lado, se conoce poco acerca de la historia natural de dicha enfermedad.
Métodos: Presentamos un estudio retrospectivo de 16 pacientes diagnosticados de GNML tipos Va (GNML «pura») y Vb (con proliferación mesangial). En cada uno de los casos analizamos las características clínicas y analíticas en el momento del inicio de la enfermedad y a lo largo del seguimiento.
Resultados: Siete pacientes (43%) no presentaban ninguna manifestación clínica extrarrenal sugerente de Lupus eritematoso sistémico (LES) en el momento del diagnóstico. El síndrome nefrótico constituyó la forma más habitual de presentación (81%). 14 pacientes (87%) presentaban positividad para los anticuerpos antinucleares (ANA) pero a título bajo en la mayoría de los casos; los anticuerpos anti-DNA fueron positivos en 3 casos (18%) y sólo se detectó hipocomplementeria en 2 pacientes (12%). Desde el punto de vista histopatológico, los hallazgos más relevantes fueron la presencia de depósitos de C 1 q (83%) y de depósitos electrondensos subendoteliales y mesangiales en el estudio ultraestructural. El abordaje terapéutico consistió en corticosteroides, añadiendo medicación inmunosupresora cuando no se obtenía respuesta en un período de 2 a 3 meses. En los últimos años hemos utilizado un inhibidor del enzima convertidor de angiotensina antes de utilizar la terapia inmunosupresora. Al final del seguimiento, 6 pacientes (42%) desarrollaron una insuficiencia renal crónica y 8 (58%) mantuvieron una función renal normal. La supervivencia actuarial renal es del 100% a los 5 años y del 75% a los 10 años. El mantenimiento de o la evolución hacia una proteinuria en rango no nefrótico fue el único parámetro que se asoció de manera significativa con un mejor pronóstico renal.
Conclusión: La GNML puede presentarse sin ninguna sintomatología extrarrenal sugerente de LES e incluso con negatividad para los marcadores serológicos propios de esta enfermedad. Casi la mitad de los pacientes con GNML (42%) desarrollaron una insuficiencia renal crónica. La evolución hacia una proteinuria no nefrótica se correlacionó con el mantenimiento de una función renal normal.
INTRODUCCIÓN
La glomerulonefritis membranosa lúpica (GNML), tipo V de la Organización Mundial de la Salud (OMS), es un tipo de nefropatía lúpica con unas características clínicas y evolutivas especiales. Según la clasificación morfológica revisada de la OMS1, se distinguen dos subtipos de GNML: la Va o GNML «pura» y la Vb en la que se asocia un ensanchamiento o hipercelularidad mesangial. Clásicamente se hablaba a su vez de la GNML tipo Vc, con datos de proliferativa focal sobreañadida y la Vd con datos de proliferativa difusa coexistente2.
La GNML es un proceso todavía no bien conocido en diferentes aspectos. En primer lugar y debido a sus peculiaridades clínicas y serológicas, constituye en ocasiones un reto diagnóstico a la hora de diferenciarla de la glomerulonefritis membranosa idiopática (GNMI). Por otro lado, se desconoce la historia natural de esta entidad ya que, ante su diagnóstico, se ponen en marcha medidas terapéuticas eficaces en otros tipos de nefropatía lúpica pero de eficacia difícil de establecer en la GNML por la ausencia de estudios prospectivos. Asimismo, varias de las series publicadas sobre la GNML denotan el sesgo de incluir grupos de pacientes heterogéneos desde el punto de vista histológico, pues consideran pacientes con y sin lesiones proliferativas asociadas a la hora de extraer conclusiones.
Con el presente estudio pretendemos revisar nuestra experiencia con la GNML, atendiendo únicamente a los tipos Va y Vb (GNML «puras») y excluyendo por tanto a los pacientes con GNML que presentan lesiones proliferativas asociadas (los antiguos tipos Vc y Vd). Analizamos las peculiaridades clínicas, serológicas e histopatológicas que deben hacernos sospechar este tipo de nefropatía, diferenciándola de la GNMI. Por otro lado, referimos la evolución de los pacientes, analizando la influencia de las pautas terapéuticas empleadas y los factores con importancia pronóstica.
PACIENTES Y MÉTODOS
Presentamos un estudio retrospectivo de 16 pacientes diagnosticados de GNML Va y Vb en el Servicio de Nefrología del Hospital Doce de Octubre de Madrid durante los años 1975 a 1998. Todos los pacientes cumplieron los criterios revisados para el diagnóstico de Lupus eritematoso sistémico (LES) de la Asociación Americana de Reumatología3 en algún momento de su evolución. El diagnóstico de GNML, requirió evidencia histopatológica por biopsia renal: engrosamiento difuso de la pared capilar debido a la presencia de depósitos electrondensos subepiteliales con distribución homogénea a lo largo de la pared capilar. Cuando existía proliferación de células y matriz mesangial asociadas, se catalogó el caso como GNML tipo Vb. Se excluyeron todos los casos que presentaban una proliferativa focal o difusa asociada a los criterios referidos de membranosa (antiguos tipos Vc y Vd). Todas las biopsias fueron revisadas para el presente estudio. Se dispuso de microscopía óptica en el 100% de los casos (16), de inmunofluorescencia en 12 (75%) y de microscopía electrónica en 4 (25%).
En cada uno de los casos se analizaron las características clínicas y analíticas en el momento de la presentación de la enfermedad y a lo largo del seguimiento. Salvo en los períodos de ingreso, los pacientes fueron revisados periódicamente en nuestra consulta externa. Una vez establecido el diagnóstico de GNML, en cada visita se determinaron de manera protocolarizada los siguientes parámetros: bioquímica general (hemograma, autoanalizador), aclaramiento de creatinina, proteinuria de 24 horas, sedimento urinario, anticuerpos antinucleares (ANA), anticuerpos anti-DNA bicatenario (anti-DNA) y niveles de las fracciones C3 y C4 del complemento.
Para evaluar las manifestaciones renales, hemos seguido las siguientes definiciones: proteinuria no nefrótica: inferior a 3,5 g/24 horas; síndrome nefrótico: proteinuria superior a 3,5 gramos/24 horas acompañada de hipoalbuminemia e hipoproteinenia. Se consideró que existía hipertensión arterial cuando las cifras de tensión arterial eran superiores a 140/90 mmHg de manera sostenida. La insuficiencia renal se definió por una creatinina plasmática superior a 1,4 mg/dl y/o un aclaramiento de creatinina inferior a 60 ml/min.
Como pauta general, una vez establecido el diagnóstico de GNML, se comenzó tratamiento con esteroides por vía oral. Cuando transcurrido un período suficiente de tiempo (generalmente de 2 a 3 meses) no se evidenciaba una mejoría clara de las manifestaciones renales, se asociaba un fármaco inmunosupresor: ciclofosfamida (oral o intravenosa en bolos) o azatioprina. Lógicamente, dado el amplio período que abarca este estudio (1975-1998), las pautas de tratamiento han ido modificándose, pero manteniendo el esquema general que hemos apuntado. En los primeros años se usó la azatioprina como fármaco inmunosupresor en los casos en que se consideró indicado por la ausencia de remisión con esteroides. Posteriormente, se fue sustituyendo la azatioprina por ciclofosfamida administrada por vía oral o, más recientemente, mediante choques periódicos intravenosos. En los últimos años hemos adoptado la política de administrar un Inhibidor del enzima convertidor de angiotensina (IECA) en los casos que mantienen proteinuria significativa (> 1 g/día) con esteroides, antes de introducir los fármacos inmunosupresores referidos.
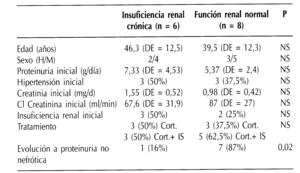
Para analizar los factores clínicos y analíticos con importancia pronóstica respecto a la evolución de la función renal, hemos estudiado los siguientes parámetros: sexo, edad, creatinina sérica y proteinuria iniciales (en el momento del diagnóstico), presencia de hipertensión arterial al inicio del proceso, tipo de tratamiento recibido (esteroides, esteroides y azatioprina, esteroides y ciclofosfamida) y la consecución o no de remisión a proteinuria no nefrótica a lo largo de la evolución. Estos parámetros fueron estudiados en relación con el desarrollo de insuficiencia renal a lo largo del seguimiento versus el mantenimiento de una función renal normal. Los datos han sido expresados como la media (desviación estándar) y la comparación entre los distintos grupos se ha realizado mediante el test de Fisher para las variables cualitativas y mediante los test paramétricos de Wilcoxon y Mann-Whitney para las variables cuantitativas.
RESULTADOS
La serie está constituida por 16 pacientes de los cuales 11 son mujeres y 5 son hombres con una edad media de 41,9 años (DE = 12) siendo el rango de edad de 27 a 64 años. El tiempo medio transcurrido entre el inicio de la sintomatología y la realización de la biopsia renal fue de 32,4 meses (DE = 62).
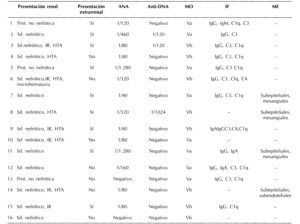
Las características clínicas, serológicas e histopatológicas de los pacientes se representan en la tabla 1.
Forma de presentación
La enfermedad renal se expresó en forma de síndrome nefrótico en 13 pacientes (81%) con una proteinuria inicial de 5,96 g/día (DE = 3,2), presentando el resto de los pacientes proteinuria en rango no nefrótico. Seis pacientes (37%) presentaban insuficiencia renal al inicio del cuadro con una creatinina plasmática media de 1,7 mg/dl (DE = 0,2), sin necesidad de tratamiento sustitutivo con diálisis y todos ellos con síndrome nefrótico asociado. Siete pacientes (43%) presentaban hipertensión arterial inicial. Acompañando o precediendo a la afectación renal, los pacientes en estudio desarrollaron sintomatología extrarrenal sugerente de LES muy vario-pinta (tabla 2) aunque en el momento de realizar la biopsia renal, 7 (43%), se encontraban asintomáticos en este sentido.
Marcadores serológicos
Nuestra serie se caracterizó por su pobreza serológica en cuanto a los marcadores clásicos de LES. 14 casos (87%) presentaban positividad para los ANA, pero en la mayoría de los pacientes tal positividad fue a títulos bajos, de modo que en 7 pacientes el título fue inferior a 1/100. Asimismo, 2 pacientes (12,5%) presentaban negatividad para los ANA. De modo paralelo, los anticuerpos Anti-DNA fueron positivos únicamente en 3 pacientes (18%) y sólo en uno de ellos a título elevado. La presencia de hipocomplementemia, descenso de niveles séricos de C3 y C4, fue detectada exclusivamente en 2 casos (12%).
Anatomía patológica
En el estudio histopatológico renal, todos los pacientes presentaban datos de glomerulonefritis membranosa en la microscopía óptica tal y como se ha descrito anteriormente 8 pacientes (50%) pertenecían a la clase Va y los restantes a la Vb, con proliferación mesangial asociada. Se dispuso de inmunofluorescencia en 12 de los casos (75%), existiendo depósito de IgG en 12 (100%), IgM en 1 (8%), IgA en 3 (25%), C3 en 10 (83%), C4 en 2 (16%) y depósito evidente de C1 q en 10 (83%). En 4 pacientes (25%) se dispuso de microscopía electrónica; en todos, además de los esperados depósitos electron-densos subepiteliales, se encontraron tales depósitos a otros niveles, fundamentalmente a nivel mesangial y subendotelial.
Tratamiento
De los 16 pacientes incluidos en el estudio, 8 (50%) fueron tratados con prednisona, 3 (18,7%) recibieron tratamiento con prednisona y ciclofosfamida oral (2 mg/kg/día), 1 (6%) recibió prednisona y ciclofosfamida i.v. (6 bolos mensuales a dosis de 1 g/m2) y 2 (12,5%) fueron tratados con prednisona y azatioprina 2 pacientes (12,5%) no recibieron ningún tratamiento específico. En los últimos años, hemos introducido la terapia con IECA de manera sistemática poco después de iniciar el tratamiento esteroideo, incluso en pacientes con cifras normales de tensión arterial. En nuestra serie, 6 pacientes (37,5%) recibieron tratamiento con IECA según la pauta referida.
Seguimiento y factores pronóstico
En dos casos se perdió el seguimiento tras establecer el diagnóstico de GNML. Los 14 restantes fueron seguidos durante 60,6 meses (DE = 47). Dos pacientes fallecieron a lo largo del estudio: uno de ellos a los 30 meses del diagnóstico por un accidente cerebrovascular y el otro paciente 3 meses después de realizar la biopsia renal en el seno de una púrpura trombótica trombocitopénica. Al final del período de estudio, 6 pacientes (42%) desarrollaron una insuficiencia renal crónica (IRC), requiriendo 2 de ellos tratamiento sustitutivo con diálisis y 8 pacientes (58%) mantuvieron una función renal normal. La supervivencia actuarial renal es del 100% a los 5 años y del 75% a los 10 años.
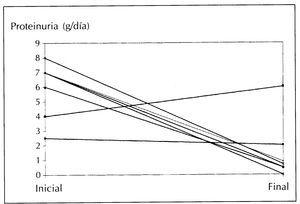
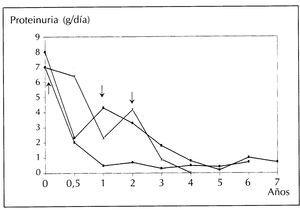
No hemos demostrado diferencias estadísticamente significativas en cuanto a la edad y el sexo entre el grupo de pacientes que mantuvo función renal normal y el que desarrolló IRC. La creatinina sérica inicial tiende a ser superior en el grupo que evoluciona hacia la IRC, sin embargo la diferencia no es estadísticamente significativa. Tampoco existen diferencias entre ambos grupos en lo que se refiere a la proteinuria inicial, la presencia de hipertensión, ni las pautas terapéuticas empleadas. Únicamente el paso a o el mantenimiento de una proteinuria en rango no nefrótico a lo largo del seguimiento fue más frecuente en el grupo de pacientes que conservaron función renal normal, con una diferencia estadísticamente significativa (p = 0,02) (tabla 3). De este modo, los 6 pacientes que evolucionan hacia IRC presentaban un síndrome nefrótico al inicio del proceso y en 5 de ellos (83%) la proteinuria se mantuvo en este rango a lo largo del seguimiento. Por otro lado, de los 8 pacientes que mantienen función renal normal, 7 (87%) conservaron o remitieron a proteinuria en rango no nefrótico a lo largo del estudio y 5 de ellos (71%) recibieron tratamiento con LECA según la pauta antes descrita (figura 1). El efecto antiproteinúrico de los IECA, sin necesidad de tratamiento inmunosupresor, fue especialmente relevante en 3 casos con una espectacular evolución de la proteinuria que representamos gráficamente (figura 2).
Por las peculiaridades clínicas y serológicas de la GNML, resulta difícil en ocasiones realizar el diagnóstico diferencial con la GNMI. Presentamos a continuación un breve resumen de la evolución de dos de nuestros pacientes, ilustrativa de dicha dificultad. En ambos, la ausencia de manifestaciones extrarrenales y la pobreza de datos serológicos llevó a un diagnóstico erróneo de GNMI. Tras un período de tiempo sin tratamiento inmunosupresor, ambos pacientes presentaron un brote lúpico agudo y agresivo, comprobándose en uno de ellos la evolución hacia una glomerulonefritis lúpica proliferativa difusa.
CASO 1
Mujer de 30 años en estudio por proteinuria de 2,5 g/día, presentando función renal y tensión arterial normales. Su estudio inmunológico fue negativo incluyendo ANA y Anti-DNA y presentaba niveles normales de C3 y C4. Se practicó una biopsia renal que mostró un engrosamiento difuso de la membrana basal glomerular con «spikes», sin aumento de la celularidad y con depósito de IgG, C3 y C1 q en la inmunofluorescencia. No se dispuso de estudio ultraestructural. Interpretado el caso como una GNMI, la paciente no recibió inicialmente medicación inmunosupresora, manteniendo durante 2 años función renal normal con una proteinuria de 3 g/día. Dos años más tarde ingresa en situación de anasarca e insuficiencia renal progresiva alcanzando una creatinina sérica de 4 mg/dl y una proteinuria de 8 g/día. El cuadro se acompañó de manifestaciones pulmonares y neurológicas graves. Se detectaron entonces unos ANA y anti-DNA positivos a título de 1/1.280 y 1/128 respectivamente, así como hipocomplementemia (C3 40 mg/dl y C4 9 mg/dl). Se efectuó entonces una segunda biopsia renal que mostró, además de los datos histopatológicos propios de una glomerulonefritis membranosa, asas de alambre, trombos hialinos, focos de necrosis y proliferación celular compatible con una glomerulonefritis proliferativa difusa. En la inmunofluorescencia existían depósitos de IgG, IgA, IgM, C3 y C1 q y la microscopía electrónica evidenció la presencia de depósitos electrondensos subepiteliales, subendoteliales y mesangiales. Se inició tratamiento con metilprednisolona intravenosa en bolos seguida de prednisona vía oral y azatioprina, con una mejoría clínica espectacular, desapareciendo la sintomatología extrarrenal de forma paulatina. La función renal se normalizó y la proteinuria se redujo a 2 g/día. Tras 10 años de seguimiento, la paciente presenta unos niveles de creatinina sérica de 1,4 mg/dl y una proteinuria de 2 g/día.
CASO 2
Mujer de 64 años de edad en estudio por insuficiencia renal con un valor de creatinina sérica de 2,2 mg/dl, proteinuria de 4,5 g/día e hipertensión arterial. El estudio serológico resultaba anodino salvo por la positividad para los ANA a título de 1/80. Se practicó una biopsia renal disponiéndose únicamente de microscopía óptica, con datos compatibles con una glomerulonefritis membranosa sin proliferación celular. Diagnosticada de GNMI, no se sometió a ningún tratamiento específico, experimentando a los 2 años de evolución un cuadro clínico consistente en fiebre, artralgias, artritis y manifestaciones cutáneas. En este contexto, se produjo un deterioro llamativo de la función renal, alcanzando la creatinina sérica un valor de 4,2 mg/dl; de modo simultáneo, la proteinuria de 24 horas alcanzó un valor de 10 gramos. Los Anti-DNA continuaron siendo negativos; sin embargo, se produjo una positivización muy llamativa de los ANA que alcanzaron un título de 1/1.280. Los niveles de C3 siguieron dentro del rango normal, pero los de C4 descendieron hasta 7 mg/dl. El resto del estudio inmunológico fue negativo. Dada la peculiar evolución sufrida por la paciente, se decidió realizar un segunda biopsia renal, que objetivo un engrosamiento homogéneo de la membrana basal glomerular con depósitos de IgG, C3 y C1 q en la inmunofluorescencia y depósitos electrondensos subepiteliales, subendoteliales y mesangiales en la microscopía electrónica. Con el nuevo diagnóstico de GNML, se inició tratamiento con esteroides, con una franca mejoría inicial (creat. 2,5 mg/dl y descenso en la proteinuria), pero la paciente falleció 6 meses más tarde en el seno de un accidente vascular cerebral.
DISCUSIÓN
La GNML es una entidad que puede ser peculiar en su presentación planteando dificultades al clínico para diferenciarla de la GNMI. En un paciente previamente diagnosticado de LES que presenta afectación renal, el diagnóstico histológico de glomerulonefritis membranosa no plantea problemas a la hora de establecer una relación de causalidad. La dificultad viene representada por el paciente diagnosticado de glomerulonefritis membranosa sin otros datos sugerentes de LES. Hemos realizado un estudio retrospectivo en el que observamos que esta última situación no es infrecuente en la práctica clínica, de modo que el diagnóstico de GNML habrá de sospecharse en base a una serie de datos clínicos, serológicos e histopatológicos.
Respecto a la afectación renal en la GNML «pura», la proteinuria suele ser el hallazgo predominante, estando presente en el 81% de los pacientes de nuestra serie. Este dato corrobora lo ya descrito por otros autores4-6. Pero el dato clínico más llamativo de nuestro estudio es la pobreza de la sintomatología extrarrenal propia del LES al inicio del cuadro, hecho que evidenciamos en 7 de los 16 pacientes (43%), es decir, en prácticamente la mitad de los casos y que también ha sido referida en otras series6-9. De ello se deduce que la GNML puede implicar una pobreza clínica llamativa que dificulta el diagnóstico de un LES latente. Este puede desarrollarse en un futuro, en ocasiones de forma explosiva, como queda reflejado en los casos clínicos anteriormente expuestos.
Coincidiendo con esta presentación clínica, la pobreza serológica es también característica de este tipo de nefropatía lúpica 14 pacientes (87%) presentaron inicialmente positividad para los ANA, pero en la mayoría de los casos a títulos bajos y en 2 casos (12,5%) fueron negativos. Asimismo, los Anti-DNA fueron positivos sólo en 3 pacientes (18%) y detectamos hipocomplementemia exclusivamente en 2 casos (12,5%). La escasa expresividad serológica de la GNML ha sido descrita también por otros autores6,7 pero no observada en otras series. De este modo, respecto a la positividad para los ANA en la GNML, Jennette8 la describe en el 100% de sus casos, Donadio6 en el 78% y Appel4 en el 50% de sus pacientes. Sin embargo, estos autores no especifican la importancia de tal positividad e incluyen pacientes de los 4 subtipos de GNML clásicamente descritos por la OMS. Pasquali10, que sí distingue entre los pacientes con y sin lesiones proliferativas asociadas, describe ANA positivos a título moderado o alto en todos sus pacientes con GNML pura, a diferencia de lo encontrado por nosotros. Por otro lado, en estas mismas series, llama la atención la frecuente aparición de hipocomplementemia en comparación con nuestro estudio. De este modo, Jennette8 la describe en el 65% de sus pacientes, Appel4 en el 75% y Donadio6 en la mayoría de sus casos. Quizá la frecuencia con la que se detecta hipocomplementemia en estos estudios pueda justificarse de nuevo por el hecho de que incluyen pacientes heterogéneos histopatológicamente hablando, i.e., con y sin lesiones proliferativas asociadas. Esta explicación se basa en la observación de que Pasquali (10), quien clasifica a los pacientes en clases Va + Vb versus Vc + Vd, a la hora de extraer conclusiones, detecta hipocomplementemia en el primero de los grupos sólo en el 11,5% de los casos, con un resultado por lo tanto similar al nuestro.
De lo expuesto anteriormente, se deduce que la GNML puede presentarse sin datos clínicos sugerentes de LES y con negatividad para los marcadores serológicos clásicos de esta enfermedad. Por ello resulta imprescindible considerar algunos datos histológicos para diferenciar esta entidad de la GNMI. Jennete8 analiza individualmente la eficiencia de una serie de datos anatomopatológicos a la hora de establecer el diagnóstico diferencial entre ambos procesos. Por la similitud con nuestros resultados, hemos de destacar la importancia que otorga al depósito de C1q en la inmunofluorescencia y a la presencia de depósitos electrondensos a nivel mesangial y subendotelial en el estudio ultraestructural como datos más frecuentemente presentes en la GNML. Otros autores también han descrito la detección de depósitos electrondensos a nivel mesangial y subendotelial como más característica de la GNML y como poco frecuente en la glomerulonefritis membranosa de causa no lúpica4,6,11-13 En consonancia con lo descrito por estos autores, en nuestra serie, en 10 de 12 pacientes (83%) en los que dispusimos de inmunofluorescencia se detectó C1 q y en 4 de 4 pacientes (100%) en los que hubo acceso a la microscopía electrónica existían depósitos electrondensos a nivel mesangial y subendotelial, además de los esperados depósitos subepiteliales.
Seguimos sin conocer cuál es la historia natural de la GNML pues la experiencia acumulada con el resto de los tipos de nefropatía lúpica hace que se instaure tratamiento de forma precoz. No obstante, un aspecto que resulta interesante analizar es la importancia pronóstica de algunos datos clínicos en relación con la evolución de la función renal. En nuestra experiencia, la edad, el sexo, la proteinuria inicial, la incidencia de hipertensión arterial y el tipo de terapia empleada no se comportan como factores pronóstico, es decir, no difieren entre el grupo de pacientes que evoluciona a IRC y el grupo que mantiene función renal normal. Asimismo, la presencia de insuficiencia renal al inicio del cuadro tampoco condiciona un peor pronóstico en cuanto a la función renal. Si bien refiriéndose a la nefropatía lúpica en general, otros autores afirman que la insuficiencia renal inicial sí implica un peor pronóstico a largo plazo14-17. Sloan18, analizando la evolución de pacientes con GNML tratada, concluye que la creatinina sérica inicial es factor pronóstico, pero únicamente en la clase Vd. En contraste con lo admitido por estos autores y de acuerdo con nuestros resultados, Appel19 en lo que se refiere a la nefropatía lúpica, no encuentra en la insuficiencia renal inicial implicación pronóstica, si bien alega que, respecto a otros estudios, ha podido incluir pacientes con lesiones potencialmente más reversibles.
El único factor que en nuestra experiencia ha demostrado tener importancia pronóstica es la remisión de la proteinuria a rango no nefrótico. Esta circunstancia es más frecuente en el grupo de pacientes que conserva función renal normal a lo largo del estudio, siendo esta diferencia estadísticamente significativa. El valor pronóstico de la proteinuria en la nefropatía lúpica fue descrita también en la serie de Appel19. Este autor observó que la presencia de síndrome nefrótico al inicio del cuadro se asocia con una mayor probabilidad de desarrollar insuficiencia renal, pero en los casos en que dicho síndrome nefrótico remite la probabilidad mencionada disminuye. Wallace" y Ginzler15 también afirman que en la nefropatía lúpica la proteinuria severa y/o el síndrome nefrótico conllevan un peor pronóstico renal, dato no observado por otros autores16-20,21
El pronóstico de la GNML ha demostrado ser peor de lo esperado en las series con seguimientos largos. De este modo, Pollak22 describe que ninguno de sus 7 pacientes con GNML desarrollaron IRC o murieron, pero el tiempo de seguimiento es corto, con una media de 3,6 años. Tras 3,9 años de seguimiento, Donadio6 describe esta evolución hacia la IRC o la muerte en 8 de 28 pacientes (29% de los casos). Appel, en su estudio de 19784 describe esta evolución desfavorable en 5 de 10 pacientes, pero con un seguimiento más prolongado19, el número se eleva a 7 de 10. Baldwin23 y Adler24, también con seguimientos más largos de 5,5 y 6 años respectivamente, describen una evolución hacia la IRC o la muerte en casi la mitad de sus pacientes con GNML. Nuestra experiencia con este proceso es similar a la descrita por estos autores. Con un tiempo medio de seguimiento de 5 años, 8 de nuestros 16 pacientes (50%) han evolucionado hacia la IRC o han fallecido. Por tanto, parece que la supervivencia renal en la GNML es buena a corto plazo empeorando claramente con tiempos de seguimiento más largos.
Nuestra serie es demasiado corta y las estrategias terapéuticas utilizadas demasiado heterogéneas como para extraer conclusiones respecto al tratamiento más adecuado en este tipo de nefropatía lúpica. Creemos necesario poner en marcha estudios prospectivos y multicéntricos en este sentido. Sin embargo, queremos llamar la atención sobre la utilidad de los IECA en esta entidad. El efecto antiproteinúrico de los IECA ha sido demostrado en diversos procesos glomerulares, pero no se ha demostrado su utilidad en la nefropatía lúpica25,26 Nuestros resultados son muy satisfactorios en cuanto a la reducción de la proteinuria con el tratamiento con estos fármacos, reducción que, como hemos señalado, se asocia a una mejor evolución de la función renal. Una vez iniciado el tratamiento con esteroides, en ausencia de una respuesta favorable, sería aconsejable iniciar tratamiento con un IECA antes de asociar un fármaco inmunosupresor; en algunos casos la respuesta es tan evidente que puede obviarse el uso de inmunosupresores, con los efectos adversos que a largo plazo su uso conlleva.
En conclusión, la GNML puede presentarse sin ningún tipo de sintomatología extrarrenal sugerente de LES e incluso con negatividad para los marcadores serológicos típicos. Casi la mitad de nuestros pacientes (42%) desarrollaron una IRC. La evolución hacia una proteinuria no nefrótica se correlacionó con el mantenimiento de una función renal normal.
Tabla 1. Características clínicas, serológicas e histopatológicas de los pacientes
Tabla 2. Manifestaciones extrarrenales de LES, diferenciando entres las presentes en el momento en que se realizó la biopsia (Bx) renal y las que aparecieron con posterioridad
Tabla 3. Comparación de variables entre el grupo de pacientes que desarrollo insuficiencia renal crónica y el grupo con función renal normal al final del estudio
Figura 1. Evolución de la proteinuria en el grupo de pacientes que mantuvieron función renal normal.
Figura 2. Evolución de la proteinuria en 3 pacientes tratados con un IECA, según el protocolo descrito en el texto.