La insuficiencia renal aguda (IRA) se presenta en un 5,3% de los enfermos hospitalizados, factor, este último, independiente de mortalidad y morbilidad. Las causas más habituales son la isquemia renal y la nefrotoxicidad por fármacos o por contraste radiológico. En este artículo se revisa la evidencia actual de las diferentes medidas de prevención primaria y secundaria de la IRA, realizándose una búsqueda sistemática utilizando las bases de datos PubMed/PubMed Central. En la prevención primaria, la mayoría de estudios hacen referencia a la prevención de la nefropatía inducida por contraste (NIC), pacientes en unidades de cuidados intensivos (UCI) y la cirugía cardíaca por su alta prevalencia. En el caso de la prevención de la NIC es importante tener en cuenta el medio de contraste utilizado, preferentemente los no iónicos e isoosmolares y la expansión con volumen en la que es opcional el empleo de fármacos antioxidantes como N-acetilcisteína. En la prevención en las UCI, una de las medidas principales es mantener un estado de hidratación y hemodinámica correctos, así como evitar nefrotóxicos. En prevención en cirugía cardiovascular destacan principalmente dos fármacos: fenoldopam y nesiritide, base de la mayoría de estudios y con resultados alentadores por confirmar con el primero. La prevención secundaria tiene como objetivo frenar la progresión del daño renal y favorecer los procesos de regeneración renal. Entre las medidas que deben seguirse destaca evitar más agresiones renales, ya sea mejorando la hemodinamia y la perfusión renal o evitando los nefrotóxicos. En cuanto al tratamiento farmacológico, no se ha demostrado beneficio en el uso de dopamina, fenoldopam, péptidos natriuréticos ni diuréticos.
INTRODUCCIÓN
La insuficiencia renal aguda (IRA) se presenta en un 5,3% de los pacientes ingresados en un hospital siendo las causas más habituales la isquemia renal y la nefrotoxicidad por fármacos o por contraste radiológico. El desarrollo de IRA durante el ingreso es un factor independiente de mortalidad y de morbilidad, aun cuando el incremento en la cifra de creatinina sea aparentemente trivial, como se ha demostrado en algunos estudios1 en los que incrementos de 0,3 mg/dl o superiores confieren de forma independiente una mayor mortalidad. Es evidente que estos incrementos tan pequeños no suelen llevar asociadas las complicaciones clásicas de la IRA (uremia, trastornos hidroelectrolíticos, sobrecarga de volumen, infección, hemorragia) y que, por tanto, estos episodios de IRA podrían actuar como marcador de comorbilidad. En cualquier caso, la mayoría de episodios de IRA hospitalaria podrían ser evitables y es por ello que las medidas de prevención primaria son esenciales para reducir la incidencia de este proceso.
Por otro lado, estudios recientes han demostrado que los episodios de IRA que se recuperan confieren una menor mortalidad que aquellos que no lo hacen, tanto en el contexto de postinfarto agudo de miocardio2 como después de cirugía cardíaca3. Estos efectos diferenciales se observan precozmente tras el alta de los pacientes y se mantienen a largo plazo, a 5 y 10 años, como se demuestra en los estudios citados más arriba, respectivamente. Además, los pacientes que presentan una recuperación sólo parcial de la función renal tienen una mortalidad intermedia2. Esto indica que si no se ha podido evitar la IRA, los esfuerzos se deben dirigir a reducir la duración de la misma y conseguir una recuperación lo más completa posible de la función renal (prevención secundaria).
En este artículo revisaremos la evidencia actual de las diferentes medidas de prevención primaria y secundaria en la IRA que han sido ensayadas en la clínica. Se ha realizado una búsqueda sistemática utilizando la bases de datos de PubMed, Medline con los siguientes criterios de revisión: todos los artículos publicados en inglés y español de los últimos 25 años que incluyeran los términos de: prevención fallo renal agudo, tratamiento y fallo renal agudo, nefropatía por contraste, fenoldopam y prevención IRA, diuréticos y prevención IRA, cirugía cardiovascular y prevención IRA, fluidoterapia e IRA, BNP y prevención IRA. Por la amplitud del tema y la limitación de espacio y en aras a mayor claridad, se han incluido sólo los ensayos más relevantes y en algunas ocasiones metanálisis. En el caso de la prevención primaria, la mayoría de estudios se han centrado en dos situaciones clínicas en las que la agresión al riñón es conocida en el tiempo, que son la exposición a contraste radiológico y la cirugía cardíaca, esta última por el gran riesgo de IRA que conlleva (alrededor de un 20%). Por ello, dado el extenso uso de contrastes en la actualidad y la práctica habitual de cirugía cardíaca en pacientes de riesgo, enfocaremos la prevención primaria sobre todo en estas dos situaciones clínicas. Además, discutiremos las medidas de prevención en pacientes críticos, ya que la IRA en este contexto es relativamente frecuente y reviste una elevada mortalidad.
PREVENCIÓN PRIMARIA
Factores de riesgo de IRA y prevención general de la IRA
Existen numerosos factores de riesgo de desarrollar IRA y algunos de ellos se han establecido de forma firme en diversos estudios (tabla 1). Entre ellos la edad, la presencia de enfermedad renal crónica (ERC) previa y la diabetes son los más señalados y pueden estar entre las razones del incremento de la incidencia de IRA observado en las últimas décadas debido a la atención, con una medicina cada vez más intervencionista, a pacientes cada vez más ancianos y con mayor número de comorbilidades. Entre los factores clínicos, la depleción de volumen, la hipotensión arterial, la sepsis y la administración de nefrotóxicos, se asocian frecuentemente a IRA. Desde un punto de vista general, el mantener un estado de hidratación y una hemodinámica correctos, y el evitar nefrotóxicos constituyen piedras angulares en la prevención de la IRA. En cuanto a la prevención de la IRA en el contexto de la administración de fármacos nefrotóxicos existen medidas para ciertos fármacos que, por su reconocimiento extenso, no vamos a discutir por limitación de espacio. Entre ellas se encuentran la monitorización en sangre de algunos fármacos, sobre todo antibióticos, para ajustar sus dosis según niveles, el ajuste prefijado de dosis según la función renal, la administración de aminoglicósidos en dosis única en lugar de fraccionada y el uso de la anfotericina liposomal con menor toxicidad tubular que la anfotericina B. Otras medidas bien establecidas son la repleción de volumen abundante, mínimo 3 l de suero salino 8 horas antes y después de la administración de cisplatino y el uso de aminofostina (agente quelante del cisplatino) y la administración de suero salino con alcalinización de la orina a pH >6,5 (con o sin furosemida) para evitar la toxicidad tubular y precipitación del metotrexato. En el síndrome de lisis tumoral, la prevención de IRA se realiza, por un lado, con expansión de volumen intensa que mantenga un flujo urinario adecuado y, por otro, con el uso de hipouricemiantes (rasburicasa). En la mioglobinuria es fundamental una repleción de volumen abundante con suero salino, siendo el uso de bicarbonato o manitol opcional (revisado en Bosch et al.4).
La medidas universales de prevención pueden ser más o menos matizadas según el contexto clínico en el que se encuentra el paciente. Así, creemos que un enfoque clínicamente útil es aquel que sitúa al paciente en contexto. A continuación discutimos las principales medidas de prevención aplicadas a tres situaciones de riesgo elevado de desarrollar IRA, que son la enfermedad crítica, la administración de contraste iodado y la cirugía cardíaca.
Prevención de la IRA en UCI
Aproximadamente entre un 5 y un 30% de pacientes críticos desarrolla IRA, y un 4% precisa de alguna forma de tratamiento renal sustitutivo (TRS)5. Las situaciones clínicas más frecuentemente asociadas a IRA en la UCI son la hipoperfusión renal y la sepsis, aunque en muchos casos la causa es multifactorial6. La mayoría de medidas preventivas se ha estudiado de forma aislada y, por lo tanto, la evidencia se refiere a la aplicación concreta de la medida. Dado el origen multifactorial de la IRA, la aplicación conjunta de varias medidas simultáneas se debe individualizar en cada paciente.
Expansión de volumen
La hipovolemia, ya sea manifiesta o relativa, es un factor de riesgo establecido de IRA7 y, por lo tanto, la repleción de volumen es una medida preventiva eficaz tanto de la hipoperfusión renal como de la nefrotoxicidad, como se ha mencionado anteriormente. No obstante, esta medida debe realizarse con cautela, de forma controlada con monitorización hemodinámica, ya que su empleo no controlado tiene sus riesgos, tanto inmediatos (congestión pulmonar, aumento de presión intraabdominal, etc.), como a más largo plazo, ya que diversos estudios han demostrado una asociación entre balance hídrico positivo y mortalidad en la IRA8,9.
Para la expansión de volumen se emplean fluidos de diferente composición según el origen de la pérdida de volumen del paciente y también de las alteraciones hidroelectrolíticas presentes. La base para la expansión de volumen son los cristaloides, básicamente suero salino isotónico (0,9%, 154 mmol/l de Na y de cloro) aunque también incluyen el bicarbonato y el Ringer lactato. El hecho de que el suero salino isotónico expanda únicamente un 25% del volumen infundido, junto a la elevada concentración de cloro que puede producir acidosis hiperclorémica, ha llevado al uso de sustancias coloides para la expansión de volumen. Éstas contienen partículas que por su peso molecular elevado (plasma, albúmina, gelatinas, almidones y dextranos) no atraviesan las membranas capilares y son retenidas en el espacio intravascular más tiempo, por lo que en teoría producen una expansión más efectiva con menos volumen. No obstante, algunas soluciones coloides conllevan ciertos riesgos, como son reacciones anafilácticas y alteraciones en la coagulación con las gelatinas10, así como aumento del riesgo de desarrollar IRA con los dextranos y almidones11, sobre todo sin son hiperoncóticos12. Un ensayo clínico ya clásico demostró que no había diferencias en cuanto a morbimortalidad (incluido el desarrollo de IRA) entre la reposición con albúmina al 4% o con cristaloides13 (en este estudio se excluía a pacientes con cirrosis).
En los pacientes sépticos graves está bien establecido el beneficio de la reposición de volumen en estadios tempranos del proceso, y así lo recomiendan las principales guías clínicas14. En las guías se recomiendan indistintamente soluciones coloides de peso molecular bajo y cristaloides, ya que estudios relativamente pequeños habían demostrado equivalencia. No obstante, un estudio reciente ha demostrado un mayor riesgo de IRA con coloides de bajo peso molecular respecto al Ringer lactato15. Dado el mayor coste de las soluciones coloides y el riesgo que conllevan algunas de ellas, creemos que en general deberían utilizarse soluciones cristaloides y reservar las primeras para usos individualizados.
Vasopresores e inotropos
La preservación o el aumento de la presión de perfusión renal es una medida de prevención con fuertes bases fisiológicas. Se puede lograr mediante reposición de volumen, mediante vasodilatadores renales, agentes inotrópicos y agentes vasoconstrictores sistémicos que aumenten la presión arterial media (PAM). Las guías recomiendan un objetivo de PAM de >65 mmHg14, y estudios pequeños no han demostrado beneficios renales en titular la PAM hasta 85 mmHg con noradrenalina con respecto a la usual de 65 mmHg16. No obstante, es conocido que en pacientes ancianos con comorbilidad (hipertensión, diabetes), el límite de autorregulación de la presión de perfusión renal se puede encontrar por encima de 65 mmHg y que, por lo tanto, es importante individualizar el objetivo de PA en los pacientes críticos según su presión arterial premórbida, si es conocida.
Aunque en el pasado se recomendó la dopamina a dosis bajas (dosis renal, 1 a 3 µg/kg/min) como vasodilatador renal y natriurético para prevenir la IRA, múltiples ensayos y metanálisis han demostrado que es ineficaz17, probablemente porque si bien en sujetos sanos tiene efecto vasodilatador renal y diurético, en pacientes críticos o sépticos puede poseer un efecto vasoconstrictor e incluso favorecer el desarrollo de IRA18. La dopamina a dosis bajas se ha ensayado en múltiples situaciones clínicas, la mayoría de veces en estudios pequeños, de baja potencia estadística y con end-points cuestionables. Un estudio de pacientes críticos adecuadamente dimensionado para detectar diferencias pequeñas no observó efecto de la dopamina en cuanto a la función renal, necesidad de diálisis, estancia en la UCI o mortalidad19. En el estudio NORASEPT II realizado en cerca de 400 pacientes con shock séptico que recibieron dopamina a dosis bajas, dopamina a dosis altas o placebo, la incidencia de IRA o la necesidad de TRS no fue diferente entre los grupos20. La falta de eficacia y la posibilidad de efectos secundarios (taquicardia, arritmias, isquemia tisular) desaconsejan así su uso como prevención de la IRA. La noradrenalina se emplea como primera elección en el tratamiento del shock en el paciente séptico y tiene efectos beneficiosos sobre la función renal21, aunque faltan estudios comparativos con otros agentes vasopresores que avalen su ventaja potencial sobre el riñón en esta circunstancia.
Vasodilatadores
El empleo de vasodilatadores se basa en contrarrestar la activación neurohormonal que acompaña a los estados de hipoperfusión tisular. No obstante, el uso de estos agentes conlleva como riesgo la hipotensión arterial. La utilización de fenoldopam, un agonista dopaminérgico puro del receptor A-1, es más frecuente en la prevención de la IRA en cirugía cardíaca (v. posteriormente). En pacientes críticos, un estudio piloto en 300 pacientes con sepsis y creatinina >1,7 mg/dl ensayó la infusión de fenoldopam (0,09 µg/kg/min) durante la estancia en la UCI, observándose una reducción en la incidencia de IRA (definida como creatinina >1,7 mg/dl), con una OR estimada de 0,47 (p = 0,005) y con una reducción en la estancia en la UCI22. No obstante, este estudio, por los criterios de entrada de cifras de creatinina, entraría más en prevención secundaria de IRA establecida. Además, fenoldopam no redujo la incidencia de IRA grave, definida en este caso como creatinina >3,4 mg/dl. No obstante, un metanálisis reciente de 16 estudios aleatorizados en casi 1.300 pacientes críticos concluye que el uso de fenoldopam previene la IRA, reduce la necesidad de TRS y la mortalidad en pacientes críticos23. Los péptidos natriuréticos se han empleado en la prevención de la IRA en cirugía cardíaca o en la IRA establecida, y sobre ellos tratremos posteriormente.
Control glicémico estricto y otras medidas
En un estudio aleatorizado ya clásico que comparaba el control estricto de la glicemia (80-110 mg/dl) con perfusión de insulina en pacientes de UCI quirúrgicas frente a control habitual (insulina si glicemia >200 mg/dl, con unas cifras medias de 150 mg/dl) se observó que el control estricto se asociaba con una menor mortalidad y además una reducción de 41% de IRA que precisa TRS24. Más tarde, los mismos autores realizaron otro estudio en pacientes de UCI médica observando una reducción del 34% de IRA de novo25. No obstante, en los pacientes del segundo estudio no se observó una reducción en la necesidad de TRS, probablemente porque un mayor número de pacientes tenía disfunción renal en el momento del ingreso. Posteriormente, dos estudios de cohorte, uno realizado en UCI médico-quirúrgica26 y otro realizado en contexto de cirugía cardíaca27 también demostraron una reducción de la incidencia de IRA después de la implementación de protocolos de control estricto de la glicemia. No obstante, estudios recientes en pacientes sépticos de UCI general no demuestran un efecto renoprotector en pacientes sometidos a control estricto de la glicemia15,28,29, con un metanálisis que sugiere que el beneficio queda restringido a pacientes de UCI quirúrgica30. El control estricto de la glicemia parece así que no es tan beneficioso y pone a los pacientes en riesgo de hipoglicemia, con algunos estudios que demuestran que la mortalidad aumenta en estos pacientes29. Así, un reciente metanálisis de 29 estudios reuniendo más de 8.000 pacientes concluye que el control estricto de la glicemia no previene la necesidad de TRS, no reduce la mortalidad y expone al paciente a mayor riesgo de hipoglicemia. Dentro de las recomendaciones actuales el control glicémico se debe instaurar con un objetivo no tan estricto de mantener una glicemia <150 mg/dl, sin una indicación como medida específica de renoproteccón.
Otras medidas que han fracasado en pacientes críticos son el factor de crecimiento similar a la insulina-1, tiroxina, glucocorticoides, proteína C activada o eritropoyetina (revisado en Joannidis et al.31). Respecto a eritropoyetina, su potencial beneficio se deriva de su acción antiapoptótica y como factor de crecimiento. Estudios llevados a cabo en animales en varios modelos de IRA (isquemia, contraste) ha demostrado beneficios. No obstante, un estudio amplio (500 pacientes) publicado recientemente no ha mostrado ningún beneficio renal de la administración de dos dosis de Epo (500 U/kg) en pacientes críticos seleccionados por aumentos en orina de marcadores de lesión tubular32. Un posible defecto del estudio es precisamente la elección de dichos biomarcadores (GGT y fosfatasa alcalina), que presentaban incrementos que eran transitorios, lo que probablemente debió confundir la selección de pacientes. Respecto al uso de N-acetilcisteína (NAC) en los pacientes críticos, no hay estudios que hayan evaluado su eficacia como prevención de la IRA excepto en cirugía cardiaca (v. posteriormente). Es importante tener en cuenta que la NAC no es totalmente inocua. Se han descrito reacciones anafilácticas y complicaciones en el contexto de su uso como tratamiento de la intoxicación aguda por paracetamol33. Además, en los paciente sépticos puede empeorar la hipotensión y reducir el índice cardíaco34, posible explicación de la mayor mortalidad observada en este tipo de pacientes con el uso de NAC35. No obstante, en los estudios anteriormente citados, las dosis empleadas eran muy superiores a las que se utilizan en la profilaxis de la nefropatía inducida por contraste (NIC).
Prevención de la nefropatía inducida por contraste yodado
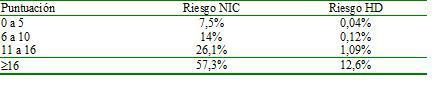
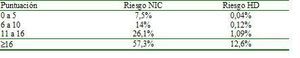
En la actualidad, un gran número de procedimientos radiológicos tanto terapéuticos como diagnósticos implican la administración de medio de contraste yodado. Esto ha llevado a que la NIC sea una de las causas más comunes de IRA en pacientes hospitalizados. Representa la tercera causa más frecuente de IRA intrahospiatalaria36. La patogenia de la NIC sigue sin estar clara y probablemente, entre otros factores, sea el resultado de la reducción de la perfusión renal por vasoconstricción y el efecto tóxico directo sobre el túbulo renal. La NIC se define como una alteración de la función renal que aparece entre los 2 y los 5 días posteriores a la administración de contraste yodado, y esta alteración de la función renal se define como un aumento de la creatinina plasmática de 0,5 mg/dl sobre la basal o un incremento relativo del 25% en ausencia de otras causas de IRA. Existen diferentes factores de riesgo37 para desarrollar NIC, y a partir de ellos se ha desarrollado un sistema de puntuación que permite predecir el riesgo de IRA según la presencia de más o menos factores predisponentes (tabla 2a y tabla 2b)37. Esta estratificación es de utililidad de cara a extremar más o menos las medidas de nefroprotección.
A continuación se discuten las principales medidas que deben adoptarse para reducir el riesgo de NIC.
Medio de contraste
El volumen, la dosis y el tipo de contraste están relacionados con el riesgo de NIC. Los medios de contraste pueden clasificarse como hipo, iso o hiperosmolares, y de igual forma pueden clasificarse como iónicos o no iónicos con base en su potencial de disociación. Los no iónicos y probablemente los isoosmolares son los que producen menos toxicidad. A diferencia de la primera generación de contrastes (iónicos con osmolalidad de 1.800 mOsm/kg), los actualmente llamados de «baja osmolaridad o hipoosmolares» la tienen de aproximadamente 750 mOsm/kg. Existe un único contraste (iodixanol) realmente isoosmolar con el plasma (290 mOsm/kg). La viscosidad es un parámetro con relación aún no establecida con la nefrotoxicidad, y la del iodixanol es superior a la de los contrastes hipoosmolares. Existen diferentes estudios que comparan varios tipos de contraste, así como su riesgo de IRA. El estudio The Cardiac Angiography in Renally Impaired Patients comparó dos de los medios de contraste más utilizados, el iodixanol (isoosmolar) y el iopamidol en 482 pacientes con ERC previa, pero no encontró diferencias significativas entre ambos en la incidencia de IRA38. No obstante, un metanálisis de 25 estudios aleatorizados que comparaban iodixanol con diferentes tipos de contraste, objetivó que si bien éste no disminuía el riesgo de NIC, un análisis de subgrupos demostró que reducía el riesgo de NIC en pacientes con ERC a quienes se administraba contraste intraarterial en comparación con aquellos que recibían iohexol39.
Expansión con volumen
La expansión de volumen extracelular desempeña un importante papel en la prevención de la NIC, y es la estrategia profiláctica más utilizada. El uso de expansores de volumen por vía intravenosa antes y después del procedimiento parece ser más efectivo que administrar bolos de volumen durante el procedimiento o el empleo de hidratación por vía oral. Probablemente su utilidad en la profilaxis se deba, entre otras razones, a la capacidad de diluir las altas concentraciones de sustancias en los túbulos renales, evitar el contacto prolongado, facilitar un flujo sanguíneo adecuado en el riñón, la inhibición del sistema renina-angiotensina, la disminución del feedback túbulo-glomerular, la permeabilidad de los tubos colectores y la viscosidad. Son muchos los estudios que demuestran el efecto beneficioso de la hidratación en la prevención de la NIC, pero todavía es objeto de discusión cuál es la mejor pauta a seguir; la comparación entre suero salino y bicarbonato es el objetivo de múltiples estudios, sobre todo desde la publicación en el año 2004 de un estudio que mostraba que el uso de bicarbonato reducía la incidencia de NIC en comparación con el empleo de suero salino normal40. En este estudio los beneficios del bicarbonato se debían básicamente al incremento en el pH urinario inducido por el bicarbonato que puede reducir la formación de radicales libres de oxígeno en el riñón. Sin embargo, existen múltiples estudios aleatorizados y retrospectivos posteriores que comparan ambas pautas de hidratación y que no demuestran mejores resultados con bicarbonato. En un metanálisis reciente de 12 estudios aleatorizados (seis de ellos publicados en forma de resumen) se concluye que la OR de la NIC con bicarbonato respecto al uso de salino es de 0,44 (intervalo de confianza [IC] 95%, 0,26-0,82)41. De este análisis se deduce que existe heterogeneidad entre estudios y que hay sesgo de publicación, ya que en los publicados como resumen se refiere un menor beneficio. No obstante, también se puede concluir que el bicarbonato no es perjudicial, como había sugerido algún estudio retrospectivo poco valorable.
Fármacos antioxidantes
N-acetilcisteína (NAC)
La NAC constituye un potente antioxidante con doble efecto en la protección renal: prevención del daño oxidativo directo y mejoría de la hemodinámica renal. Tepel et al.42 fueron de los primeros autores en objetivar los beneficios protectores de la NAC. En este estudio, se incluyeron 83 pacientes que recibieron 600 mg dos veces al día y se comparaban respecto a placebo; los pacientes que recibieron NAC tuvieron una menor incidencia de IRA. Posteriormente, se han publicado un sinfín de estudios y no menos metanálisis evaluando el papel preventivo de la NAC. Entre los dos metanálisis más recientes, Kelly et al.43 analizaron 26 estudios con un total de 3.353 pacientes y observaron un beneficio de NAC más salino frente a salino, con una OR de 0,62 (IC 95%, 0,44-0,88), aunque se detectaron deficiencias metodológicas en la mayoría de los estudios. En otro metanálisis, Gonzales et al.44 incluyeron 22 estudios aleatorizados (2.746 pacientes) y separaron dos grupos homogéneos de estudios. En el primero (18 estudios, 2.445 pacientes) no se pudo demostrar un beneficio de NAC (RR 0,87; IC 95%, 0,68-1,12). En el segundo grupo (4 estudios, 301 pacientes) se observó un efecto altamente beneficioso (RR 0,15; IC 95%, 0,07-0,38), pero en este caso asociado con descensos de la creatinina después de la administración de NAC, por lo que el efecto podría haber sido «artefactuado» debido a la propiedad conocida de la NAC de interferir con la medida de la creatinina sérica. De este modo, se puede concluir que está por demostrar un beneficio claro de la NAC, aunque dado que sus efectos tóxicos son mínimos y ante la posibilidad de que sea beneficiosa, su empleo podría estar indicado.
Ácido ascórbico
Existen pocos estudios en los que se utilice el ácido ascórbico como agente protector de la NIC. Spargias et al.45 en el año 2004 realizaron un estudio doble ciego con 231 pacientes con IRC comparando ácido ascórbico con placebo y concluyendo que éste protegía respecto a la IRA inducida por contraste.
Hemodiálisis y hemofiltración
La realización tanto de hemodiálisis como de hemofiltración previa o posterior a la administración del contraste se ha probado en diversos estudios desde los resultados positivos de un primer estudio realizado hace años. No obstante, un metanálisis crítico de 5 estudios concluye que estos procedimientos no reducen la incidencia de NIC (RR 1,35; IC 95%, 0,93-1,94). Posteriormente, se ha publicado un ensayo en 83 pacientes con ERC avanzada (creatinina basal >3,5 mg/dl) que comparaba salino antes y después del contraste con salino más una sesión de hemodiálisis después del contraste46. Se demostró un menor descenso del aclaramiento de creatinina el día 4 con la hemodiálisis (0,4 ± 0,9 frente a 2,2 ± 2,8 ml/min/1,73 m2; p = 0,001), una menor necesidad de TRS (2 frente al 35%; p = 0,001) y una menor necesidad de diálisis en el momento del alta (0 frente al 13%; p = 0,018). No obstante, dado el reducido tamaño del estudio, con cierta falta de potencia estadística, son necesarios más estudios para definir el papel de los tratamientos extracorpóreos en la prevención de la NIC.
Recomendaciones generales
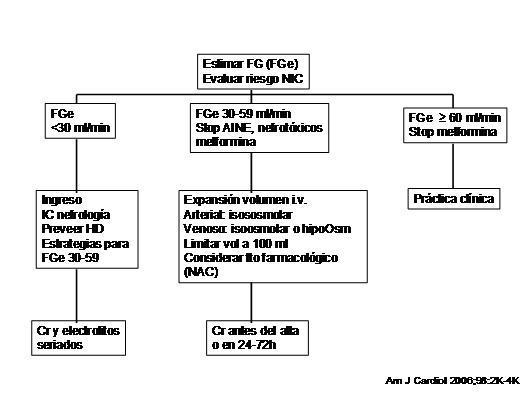
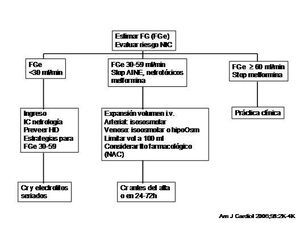
1. En todos los pacientes que vayan a recibir contraste se debe evaluar el riesgo de nefropatía por contraste (tabla 2a y tabla 2b). El algoritmo de actuación (figura 1) vendrá definido por el filtrado glomerular estimado (FGe) basal del paciente a partir de la creatinina sérica (validez de 24 h en el paciente ingresado estable y validez de un mes en el paciente ambulatorio estable).
2. Todos los pacientes que vayan a recibir contraste deben encontrarse en un estado óptimo de volemia durante la prueba. La pauta de hidratación dependerá de las circunstancias del paciente (ambulatorio o ingresado) y de la patología concomitante (riesgo de edema pulmonar con la pauta estándar). Puede usarse tanto el suero salino como el bicarbonato. El ritmo y el tiempo de administración de fluidos siempre deben individualizarse y se debe mantener un mínimo de 3 horas posprocedimiento en las pruebas intraarteriales. Unas pautas muy extendidas son las siguientes: ³ 1 ml/kg/h 12 h antes y 12 h después de la prueba o bien 3 ml/kg/h 1 h antes del procedimiento y 1 ml/kg/h durante 3-6 h después del procedimiento.
3. La profilaxis farmacológica sólo se debería emplear en pacientes de alto riesgo con agentes de eficacia probada. Considerar la NAC a dosis de 1.200 mg/12 h el día antes y el día de la prueba.
4. Evitar el uso de contraste si es posible. Valorar la realización de un estudio sin contraste, o bien de otras pruebas alternativas.
5. Utilizar la menor dosis de contraste posible y evitar varias exploraciones en poco tiempo (solo una exploración cada 72 h en pacientes con dos o más factores de riesgo).
6. En todos los pacientes se deberían usar medios de contraste de baja osmolalidad y reservar los contrastes isoosmolales para los pacientes de riesgo alto.
7. Evitar la administración de fármacos que pueden interferir con la función renal antes e inmediatamente después de la exposición al contraste. Entre éstos se incluyen AINE (en las 24 h previas) y fármacos nefrotóxicos, así como la metformina (en las 48 h previas).
8. Los diuréticos de asa se han asociado con mayor incidencia de NIC.
Prevención en cirugía cardíaca
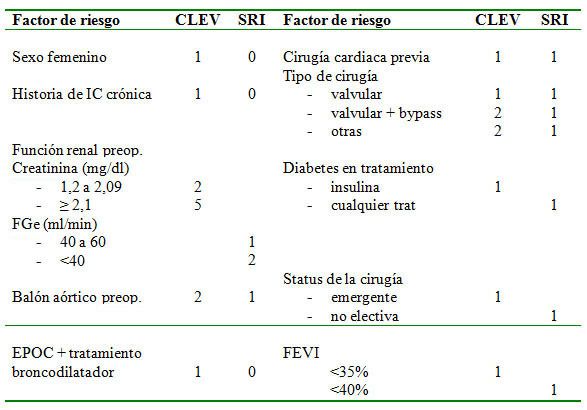
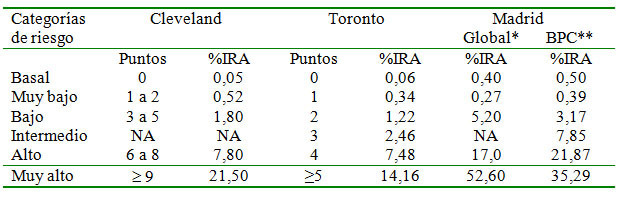
El fallo renal agudo poscirugía cardíaca está relacionado con una alta morbimortalidad en el postoperatorio. En cuanto a la incidencia, ésta oscila entre el 1 y el 30% y está relacionada con el tipo de cirugía cardiovascular realizada. Así pues, la cirugía valvular y el bypass combinado son las cirugías de mayor riesgo, mientras que con el empleo del bypass único se ha visto una menor incidencia de IRA47. Los factores concominantes a la intervención quirúrgica que aumentan el riesgo de IRA son, entre otros, IRC, diabetes mellitus, uso de balón de contrapulsación, fallo cardíaco, EPOC o enfermedad vascular periférica47. Los factores de riesgo derivados de estudios amplios de cohortes han servido para establecer unas escalas de puntuación que permiten predecir el riesgo de IRA asociada con cirugía cardíaca. Dos de estas escalas han sido validadas recientemente en población española y se detallan en la tabla 3a y en la tabla 3b48.
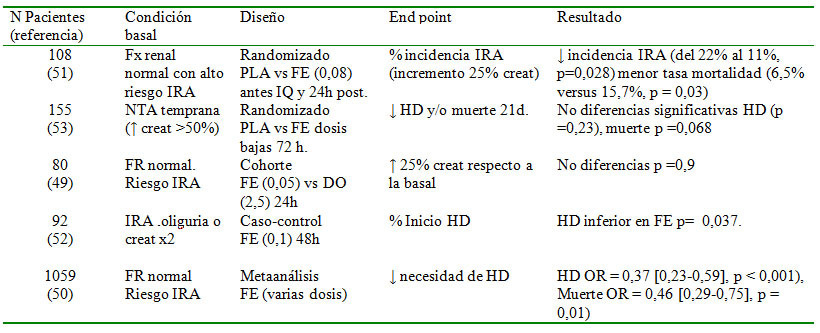
La fisiopatología de la IRA asociada con cirugía cardiovascular es, en parte, desconocida y probablemente se asociecon vasoconstricción renal, inflamación o hipoperfusión renal, entre otras. Existen diferentes fármacos objeto de controversia en la prevención de la IRA y uno de los más estudiados en los últimos años ha sido el fenoldopam, agonista selectivo del receptor D1 de la dopamina que actúa en el riñón produciendo vasodilatación, sobre todo medular, e inhibición selectiva de la reabsorción tubular de sodio. En cuanto a la eficacia en la prevención de IRA existen resultados prometedores en algunos estudios, aunque, por otro lado, también estudios negativos. En la tabla 4 se resumen los principales estudios realizados con fenoldopam en este contexto49-53. Aunque los resultados son prometedores, se necesitarán más estudios con potencia adecuada para definir el papel de este agente en la prevención de la IRA en este contexto.
Otro de los fármacos probados para la prevención de la IRA poscirugía cardiovascular ha sido la NAC. Los estudios de los que se dispone refieren resultados contradictorios, con dos recientes ensayos de 177 y de 254 pacientes que comunican resultados negativos, por lo que no se puede recomendar la NAC para la prevención de la IRA en este conexto54,55. El uso de diuréticos, tanto furosemida como manitol, no se recomienda por la falta de efecto preventivo y la posibilidad de efectos secundarios47.
El péptido natriurético nesiritide basa su uso en el tratamiento de la descompensación del fallo cardíaco. Un estudio prospectivo con 94 pacientes que comparó el uso de nesiritide a dosis de 0,01 µg/kg/min durante 5 días con placebo no pudo demostrar una disminución en la incidencia de hemodiálisis o muerte en el grupo de nesiritide, aunque sí una reducción en la incidencia de IRA en el postoperatorio inmediato. No obstante, el seguimiento de los pacientes demostró que a día 21 no había diferencias en la incidencia de muerte o hemodiálisis56. En el estudio NAPA se incluyeron 272 pacientes con disfunción ventricular izquierda que iban a ser sometidos a cirugía de bypass y se comparó nesiritide con placebo. Se pudo observar que en los pacientes que habían recibido nesiritide se producía un menor aumento de la creatinina plasmática y una menor disminución del filtrado glomerular57. Se necesitarán más estudios con potencia adecuada para definir el papel de este agente en la prevención de la IRA en este contexto.
La clonidina (agonista alfa-2) ha sido utilizado para disminuir la actividad del sistema nervioso simpático que se estimula durante la cirugía cardiovascular. Existe un pequeño estudio con 48 pacientes en los que se objetivó que el uso de clonidina previa al procedimiento disminuía el riesgo de deterioro de la función renal58. Los inhibidores de la fosfodiesterasa se han empleado por sus cualidades vasodilatadoras e inotropas positivas. La eficacia de la teofilina como preventivo de la IRA poscirugía cardiovascular fue probada en un estudio de 56 pacientes con función renal previa que recibieron un bolo inicial de 4 mg/kg siguiendo con perfusión continua de 0,25 mg/kg/h comparado con aquellos que recibieron suero salino durante 96 horas. No se observaron diferencias significativas en la incidencia de IRA. Un inhibidor selectivo de la fosfodiesterasa III, la enoximona, ha demostrado tener efectos renoprotectores, aunque en estudios sin eventos renales clínicos31. Asimismo, el levosimendan también ha demostrado sus efectos beneficiosos sobre la función renal, aunque se precisan más estudios con variables renales duras. La eritropoyetina se está evaluando en ensayos que aún no han finalizado. Un estudio piloto ha demostrado beneficio de una dosis de Epo (300 U/kg) después de la operación en 71 pacientes, con una incidencia de IRA del 8% en los que la recibieron frente al 29% en los que no lo hicieron (p = 0,035). La terapia celular con células pluripotenciales es un área de investigación intensa en modelos experimentales y está en marcha, en clínica, un ensayo para evaluar el efecto del tratamiento de célules pluripotentes estromales alogénicas en la prevención de la IRA poscirugía cardíaca (clinicaltrials.gov NCT00733876). Finalmente, los inhibidores del sistema renina-angiotensina, como el enalaprilato, han demostrado tener un efecto beneficioso en el corazón y en el riñón en población sometida a cirugía cardíaca (revisado en Joannidis et al.31).
En cuanto al uso de TRS de forma profiláctica, existen pocos estudios y con un número limitado de pacientes. En uno de ellos, 44 pacientes con creatinina basal >2,5 mg/dl antes del procedimiento fueron divididos en dos grupos: uno que recibía TRS profiláctico y otro que lo recibía cuando lo requería por su insuficiencia renal, demostrando una menor mortalidad en el grupo que recibía una sesión de hemodiálisis profiláctica. No obstante, dado el tamaño del estudio, sin duda hacen falta más estudios en este ámbito para recomendar la diálisis profiláctica en este contexto59.
PREVENCIÓN SECUNDARIA: TRATAMIENTO ESPECÍFICO DE LA IRA
La evolución de la IRA por necrosis tubular aguda (NTA) se ha dividido en una serie de fases clínicas que ayudan a entender el proceso fisiopatológico subyacente. La primera fase, fase prerrenal o vasomotora, es potencialmente reversible y es donde incide la prevención primaria. Después de esta fase, si no se ha revertido, siguen otras en las que existe daño renal progresivo: iniciación del daño, extensión del daño, fase de mantenimiento y, finalmente, fase de reparación. Es importante recordar que el riñón tiene capacidad de regeneración y que, por tanto, un episodio de IRA es, en potencia, reversible. De esta manera, la prevención secundaria, o tratamiento de la IRA, tiene como objetivos principales evitar o frenar la progresión del daño renal y favorecer los procesos de regeneración renal. A continuación se revisan las principales medidas de tratamiento de la IRA que se han ensayado en la clínica. Hay que decir que en modelos experimentales se han ensayado con éxito múltiples medidas que después han fracasado en la clínica. Esto se debe a que en la clínica existen una serie de factores limitantes: heterogeneidad y complejidad de los pacientes por la existencia de comorbilidades, diagnóstico y aplicación de las medidas relativamente tardíos o heterogeneidad en los criterios de definición de IRA. Desde hace unos años, por un lado, se han generalizado las clasificaciones RIFLE y AKIN de la IRA, lo que permitirá llevar a cabo comparaciones entre ensayos clínicos y por otro, van emergiendo biomarcadores de lesión renal que permitirán un diagnóstico más temprano de la IRA y, por lo tanto, una aplicación más temprana de la prevención secundaria.
El tratamiento no farmacológico de los pacientes con IRA establecida debe encaminarse a evitar más agresiones sobre los riñones prestando atención en evitar nefrotóxicos, en el ajuste de las dosis de los fármacos y en la monitorización y optimización de la hemodinámica sistémica (PAM) y volemia para asegurar una correcta presión de perfusión renal. En general, las medidas farmacológicas probadas hasta el momento no han demostrado una eficacia en acelerar la recuperación de la función renal o en evitar o retrasar la necesidad de TRS. Uno de los problemas de los ensayos clínicos realizados hasta la fecha es que estas medidas se han aplicado en fases relativamente evolucionadas de la IRA. A continuación se presenta la evidencia de la que se dispone sobre los principales agentes ensayados.
Fármacos vasoactivos
Dopamina
Al igual que ocurre en la prevención primaria, las dosis bajas de dopamina, a pesar de que pueden producir un aumento en la diuresis no tienen ningún efecto en la IRA establecida y, por lo tanto, su empleo nos e recomienda17,19.
Fármacos vasodilatadores
Fenoldopam
El fenoldopam (infusión durante 3 días) se ha ensayado en pacientes con IRA establecida demostrando que menos pacientes del grupo activo precisan TRS que los que reciben placebo, aunque la diferencia no era estadísticamente significativa, probablemente por la baja potencia del estudio53. Posteriormente, en otro ensayo clínico en pacientes críticos hemodinámicamente estables con IRA (temprana) (oliguria >6 h y/o creatinina entre 1,5 y 3,5 mg/dl), se aleatorizaba la administración de fenoldopam a 0,1 µg/kg/min durante 4 días frente a dopamina 2 µg/kg/min con el objetivo de detectar diferencias en el pico y los incrementos máximos de creatinina durante el tratamiento60. Si bien no se observaron diferencias en estas variables principales, sí que se observaron diferencias a favor de fenoldopam en otras variables secundarias entre el primer y el último día de tratamiento (cambios absolutos de creatinina, descensos de creatinina). No se observaron diferencias en efectos secundarios. El metanálisis comentado en la prevención primaria23 podría aplicarse parcialmente a la prevención secundaria, ya que en algunos estudios los pacientes tenían IRA establecida. Aunque no significativo, el uso de fenoldopam se asocia con más hipotensión o com mayor necesidad de emplear fármacos vasoactivos. Estos estudios sugieren un posible beneficio de fenoldopam en pacientes críticos con IRA temprana.
Péptidos natriuréticos
El anaritide (péptido natriurético atrial, ANP) y el nesiritide (péptido natriurético cerebral, BNP) se han empleado en la prevención de la IRA basándose en sus efectos de vasodilatación de la arteriola aferente y vasoconstricción de la arteriola eferente del glomérulo, aumentando así la tasa de filtración glomerular, además de por sus efectos natriuréticos en el túbulo renal. Existen varios estudios que han evaluado la eficacia de los péptidos natriuréticos en la IRA establecida. En un ensayo multicéntrico ya clásico, se administró anaritide (ANP sintético) o placebo a 500 pacientes críticos con IRA establecida durante 24 h, teniendo como variable principal la supervivencia renal libre de diálisis61. En el conjunto, no hubo diferencias entre los dos grupos, pero los pacientes inicialmente oligúricos y que dejaban de serlo tras la administración de anaritide tenían una supervivencia renal mayor. No obstante, los pacientes no oligúricos se veían perjudicados por la administración de anaritide. Por ello, se realizó otro ensayo clínico exclusivamente en pacientes oligúricos, pero esta vez, la administración de anaritide no tuvo ningún efecto beneficioso62. Es de destacar que, en el primer estudio, la cifra de creatinina media de los pacientes al ser incluidos en el estudio era de 5 mg/dl, lo que indica que la intervención se realizaba en fases muy avanzadas de la IRA. Otra posible explicación del fracaso de anaritide es que en estos estudios la dosis administrada durante 24 h era muy elevada (200 ng/kg/min), lo que puede ser causa de hipotensión. De hecho, en los pacientes no oligúricos que recibían anaritide la presión arterial sistólica media después del fármaco era 20 mmHg inferior que en los que recibían placebo61. Esto ha llevado a ensayar dosis más bajas (50 ng/kg/min) durante períodos más prolongados (hasta la necesidad de TRS o hasta la reducción en la cifra de creatinina) en pacientes con NTA posquirúrgica63. Aunque este estudio carece de potencia estadística adecuada, mostró un efecto beneficioso de anaritide respecto a una menor frecuencia de necesidad de diálisis. Son necesarios estudios de mayor tamaño en la IRA establecida para definir el papel de los péptidos natriuréticos en la evolución de este proceso.
Fármacos diuréticos
Los diuréticos de asa, como la furosemida, aumentan la diuresis y la natriuresis, con un posible efecto vasodilatador. Al inhibir el transporte de Na en el asa de Henle se reduce el consumo de oxígeno en ese segmento tubular, ya de por sí hipóxico, y podría, en teoría, reducir el daño isquémico. Además, por su efecto diurético podría atenuar la obstrucción tubular y la retrodifusión del filtrado que tienen lugar en la IRA. Todavía sigue siendo una práctica habitual la administración de furosemida a dosis altas en la IRA oligúrica establecida con el objetivo de convertirla en no oligúrica, de mejor pronóstico. Es cierto que los pacientes oligúricos que dejan de serlo al recibir furosemida mejoran el pronóstico, pero éste es igual que los que son espontáneamente no oligúricos, de lo que se infiere que el efecto no es intrínsecamente del fármaco, sino de una IRA más leve en los pacientes que responden. Existen numerosos estudios que han demostrado que, efectivamente, la furosemida aumenta la diuresis pero no tiene efecto sobre la recuperación de la función renal, necesidad de TRS, ni sobre la supervivencia del paciente o la estancia hospitalaria64. El estudio más amplio se realizó en casi 400 pacientes con IRA que requerían TRS, con la administración de dosis muy altas de furosemida (hasta 2,5 g/día)65, sin un efecto sobre el pronóstico renal (tiempo hasta TRS, número de diálisis) ni en la supervivencia, a pesar de que un mayor porcentaje de pacientes lograba una diuresis superior a 2 litros por día (57% frente al 33%). Un metanálisis de estudios, tanto de prevención primaria (n = 3) como de prevención secundaria (n = 6) demuestra que la furosemida no tiene efecto sobre la mortalidad intrahospitalaria, riesgo de necesitar TRS, número de sesiones de TRS e incluso en la proporción de pacientes con oliguria persistente66. Estas conclusiones se mantenían cuando se separaban los estudios de prevención primaria de los de prevención secundaria. Por el contrario, su uso por períodos cortos de tiempo para el mejor control de la volemia está justificado, siempre que las dosis sean adecuadas. Dosis de 1 g/día no tienen justificación y exponen a los pacientes a presentar efectos secundarios como la pérdida de audición, con un riesgo relativo de 3,9766.
El manitol es un diurético osmótico con propiedades antioxidantes y vasodilatadoras que se ha ensayado tanto en prevención primaria como en secundaria, sin que se haya observado un efecto beneficioso, excepto como integrante de la solución de conservación en el trasplante renal y posiblemente en la prevención de la IRA en la rabdomiólisis4. Se debe tener precaución en su uso, ya que puede producir sobrecarga de volemia y edema pulmonar en los pacientes oligúricos y también puede inducir una lesión renal (nefrosis osmótica).
Terapia celular
En 2008 se publicó el resultado de un estudio de fase II de un sistema de TRS continuo con un filtro de diálisis recubierto por la parte interna de células tubulares renales desarrolladas en cultivo. La idea de este tratamiento es que las células realizan las funciones que no realizan los filtros convencionales de diálisis ni el riñón en la fase establecida de la IRA (absorción, metabolismo, endocrinas e inmunomoduladoras)67. Los resultados de este estudio son alentadores en el sentido de que a los 28 días un 53% de los pacientes tratados con este sistema recuperaron la función renal frente a un 28% de los pacientes controles y de que a los 180 días la mortalidad era significativamente más baja. Estos resultados se deben confirmar en ensayos aleatorizados.
CONCLUSIONES
En el ámbito de la prevención, tanto primaria como secundaria de la IRA, existen múltiples estudios. El punto más importante, en la prevención, es asegurar una buena hemodinámica con una adecuada perfusión renal, básicamente con expansores del plasma y evitar al máximo los nefrotóxicos. Las medidas farmacológicas utilizadas en los diferentes ensayos clínicos actuales no han demostrado una eficacia clara a la hora de reducir la incidencia de IRA, de promover la aceleración de la recuperación de la función renal o de evitar TRS. Por ello, en la actualidad ningún fármaco está recomendado con un grado de evidencia suficiente en este contexto, aunque los resultados con fenoldopam en UCI y en cirugía cardíaca son alentadores y demandan la realización de ensayos de tamaño y potencia adecuados para definir su papel en este contexto. La TRS con células también está a la espera de los resultados de un ensayo de fase II.
PUNTOS CLAVE
1. En prevención primaria es básico mantener un buen estado de hidratación y evitar nefrotóxicos.
2. En la prevención de la NIC es importante una buena hidratación y el uso predominante de contrastes no iónicos. No existe beneficio claro de la NAC.
3. En prevención de la IRA en la UCI en las diferentes publicaciones se han estudiado las medidas preventivas de forma aislada. Dada la complejidad del proceso, se necesitan estudios que evalúen en efecto de la aplicación conjunta de diferentes medidas preventivas.
4. Existen diferentes estudios que sugieren beneficios en el uso del fenoldopam como prevención en cirugía cardiovascular.
5. En prevención secundaria es fundamental mantener una buena perfusión renal y evitar nefrotóxicos sin que exista ningún fármaco con evidencia clara de alterar el curso de la IRA.
Tabla 1. Factores de riesgo generales de insuficiencia renal aguda
Tabla 3a. Sistema de puntuación para la evaluación del riesgo de IRA tras cirugía cardíaca (tomado de la referencia 48)
Tabla 3b. Frecuencia de IRA según la puntuación de la escala de riesgo de Cleveland y de Toronto (SRI) en las cohortes originales y en una cohorte de pacientes de un hospital de Madrid (referencia 48)
Tabla 4. Principales estudios de prevención de la IRA poscirugía cardíaca con fenoldopam
Figura 1. Nefropatía inducida por contraste (NIC). Algoritmo de actuación.
Tabla 2a. Sistema de puntuación para la evaluación del riesgo de nefropatía por contraste yodado (tomado de la referencia 37)
Tabla 2b. Estimación del riesgo de nefropatía por contraste (NIC) o de hemodiálisis (HD) según la puntuación obtenida