INTRODUCCIÓN
Un elevado porcentaje de los pacientes en tratamiento renal sustitutivo con hemodiálisis tiene enfermedades añadidas no relacionadas con la enfermedad renal original que son causa de una elevada morbi-mortalidad. El estudio DOPPS (Dialysis Outcomes and Practice Patterns Study) recoge información de 8.615 pacientes en hemodiálisis y encuentra una elevada prevalencia de enfermedad coronaria, insuficiencia cardiaca, enfermedad cerebrovascular y enfermedad vascular periférica, entre otras muchas1. La evaluación de esta comorbilidad se puede hacer de forma cuantitativa, expresada mediante el índice de Charlson bien absoluto o ajustado a la edad (ICCE)2, 3. La utilidad de este parámetro de comorbilidad se ha contrastado en distintos estudios4, 5 y su intensidad está relacionada con mayor coste sanitario, aumento del número de ingresos y de días de hospitalización6.
La mayoría de los pacientes incluidos en programa de diálisis tienen anemia y el tratamiento de la misma con agentes estimuladores de la eritropoyesis (AEE) ha demostrado su eficacia. Esta anemia se asocia a elevada mortalidad (independientemente de las patologías asociadas, cuantificadas mediante el ICCE)7, mayor riesgo de hospitalización8, complicaciones cardiovasculares9, hipertrofia ventricular izquierda10, menor calidad de vida11 y muchos otros problemas12, 13. Las Guías europeas del manejo de la anemia en la enfermedad renal crónica, publicadas en 2004, recomiendan que estos pacientes tengan unas cifras de hemoglobina iguales o superiores a 11 g/dL14. Sin embargo, los resultados del estudio DOPPS anteriormente mencionado, señalan que un porcentaje considerable de pacientes mantiene unas cifras de hemoglobina inferiores a este valor diana15. Se acepta que hay resistencia a los AEE cuando no se logran alcanzar niveles de hemoglobina adecuados a pesar de recibir tratamiento con dosis elevadas (rHuEPO superiores a 300 UI/kg/semana o de darbopoetina superiores a 1,5 μg/kg/semana)14. No obstante, para medir el grado de resistencia a AEE es más adecuado utilizar el denominado «Indice de respuesta o resistencia a eritropoyetina» (IRE), calculado como dosis semanal de AEE/peso (en kg)/Hb (en g/dL). Se considera normal o aconsejable un IRE menor o igual a 10. Por encima de estos valores se acepta que hay resistencia a los AEE y su evolución a lo largo del tiempo indica el grado de respuesta a los mismos. El estudio EuCliD realizado en pacientes en hemodiálisis de varias ciudades españolas encuentra un IRE medio de 9,316. Entre las causas más frecuentes de resistencia al tratamiento destaca el déficit absoluto o funcional de hierro14, 17, 18. Otras causas son: inflamación o infección, hiperparatiroidismo secundario, intoxicación por aluminio, hemoglobinopatías, déficit de vitaminas, mieloma múltiple, tumores, malnutrición, hemólisis, infradiálisis o el empleo de IECAS14, 19-21.
Dada la elevada comorbilidad de los pacientes en hemodiálisis y la ausencia de respuesta al tratamiento de la anemia con AEE nos preguntamos: ¿las patologías asociadas en los pacientes en hemodiálisis se relacionan con la intensidad de la anemia o con su respuesta a los AEE? Los objetivos de este trabajo son: i) estudiar las distintas patologías que presentan los pacientes de nuestra Unidad de hemodiálisis hospitalaria y su cuantificación mediante el ICCE; ii) conocer el control de la anemia, las dosis de AEE empleadas y la respuesta a dicho tratamiento mediante el IRE, y iii) evaluar la relación entre el ICCE y los niveles de hemoglobina, las dosis de AEE y el IRE.
PACIENTES Y MÉTODOS
Realizamos un estudio retrospectivo con diseño de casos y controles, donde incluimos todos los pacientes de la Unidad de Hemodiálisis del Hospital General de Ciudad Real, con fecha 1 de marzo de 2006 y que hubieran permanecido en esta modalidad de tratamiento al menos 6 meses.
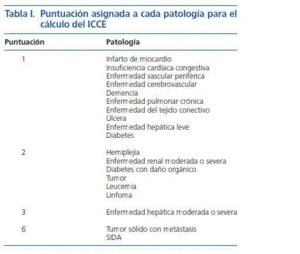
Incluimos un total de 58 pacientes. Revisamos las historias clínicas de cada uno de ellos e identificamos las patologías presentes en el momento del estudio, señalando aquellas que se incluyen en el índice de comorbilidad de Charlson, según las definiciones establecidas en el artículo original publicado en 19872. Estas patologías incluidas en el índice de comorbilidad de Charlson son: infarto de miocardio; insuficiencia cardíaca congestiva; hipertensión arterial; enfermedad vascular periférica; enfermedad cerebrovascular; demencia; enfermedad pulmonar crónica; enfermedad del tejido conectivo; úlcera péptica; enfermedad hepática leve, moderada o severa; diabetes con o sin daño orgánico; hemiplejía; leucemia; linfoma; tumor sólido con metástasis; SIDA y enfermedad renal moderada o severa. Una vez concocida la comorbilidad de los pacientes, puntuamos cada entidad según lo indicado en la tabla I, siendo la suma de todos ellos el valor del índice de comorbilidad de Charlson (ICC). Obviamente todos nuestros pacientes presentaban la puntuación correspondiente a «enfermedad renal moderada o severa» (2 puntos). Para calcular el índice de comorbilidad de Charlson ajustado a la edad (ICCE), añadimos un punto por cada década por encima de los cincuenta años al valor obtenido del ICC. Los valores obtenidos (tanto en el ICC como en el ICCE) los hemos agrupado en cuatro categorías según sus valores fueran 1-2, 3-4, 5-7 o mayor o igual a 8.
Revisamos además las analíticas realizadas a cada paciente en los seis meses previos a 1 de marzo de 2006 y obtuvimos las cifras medias de hemoglobina (medida en g/dL) y hematocrito en ese periodo. Registramos los tratamientos administrados en las sesiones de hemodiálisis en ese tiempo y la dosis media semanal de AAE. El factor de conversión entre dosis de darbopoetina y rHUEPO es 200, es decir, 200 x μg de darbopoetina = UI de eritropoyetina alfa o beta. Calculamos también el peso seco medio en esos últimos seis meses. Una vez calculado el peso, la dosis de AEE y la hemoglobina media en los seis meses previos, establecimos el IRE, calculado como dosis semanal de eritropoyetina (UI)/peso (kg)/Hb (g/dL). Separamos dos grupos de pacientes según el IRE fuera mayor o menor de 10.
El análisis descriptivo de las variables cualitativas se describe mediante frecuencias y el de las variables cuantitativas mediante medias y desviación estándar o medianas según presentaran distribución normal o no en el test de Kolmogorov-Smirnov. El análisis bivariante entre las variables cualitativas se hizo mediante chi cuadrado. La relación entre variables cualitativas y cuantitativas, mediante t de student o ANOVA si la variable cuantitativa es normal o mediante tests no paramétricos de Mann-Whitney o Kruskal-Wallis en caso de distribución no normal de la variable cuantitativa. La relación entre variables cuantitativas se realizó mediante correlación lineal. El análisis multivariante se hizo mediante análisis de regresión lineal. Los datos referentes a las historias clínicas de los pacientes, pautas de hemodiálisis y datos analíticos se extraen del programa Nefrosoft HD V3. Con todos estos datos se crea una base de datos en SPSS V 8.0, donde se hace el estudio estadístico. Se considera significación estadística si p < 0,05 en prueba bilateral.
RESULTADOS
Estudiamos 58 pacientes, 31 varones (53,4%) y 27 mujeres (46,6%), con una edad comprendida entre los 24 y 88 años (mediana de 69,5 años). La etiología de la enfermedad renal fue nefropatía diabética en el 24%; no filiada, 22%; glomerulonefritis, 21%; nefroangioesclerosis/HTA, 14%; pielonefritis/nefropatía tubulointersticial crónica, 12%; poliquistosis, 2% y otras en el 5% de los casos.
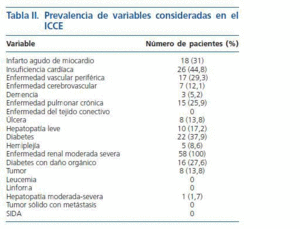
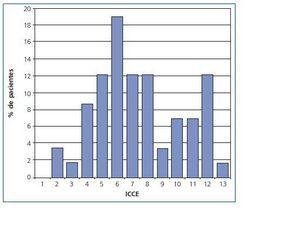
En la tabla II se muestra la frecuencia de las distintas patologías que definen el índice de Charlson. El índice de Charlson medio fue de 5,2 ± 2,4 y el ajustado a la edad (ICCE) de 7,4 ± 2,8; en el análisis estadístico hemos considerado únicamente el ICCE. En la figura 1 se muestra la distribución de los distintos valores del ICCE. Los valores del ICCE variaron entre 2 y 13; el 3,4% de los pacientes tenían un Índice de Charlson ajustado a la edad de 2, el 10,3% de 3 o 4; el 43,2% entre 5 y 7 y el 43,1% mayor o igual a 8.
La hemoglobina media fue de 11,7 ± 1,2 g/dL, con valores comprendidos entre 8,5 y 14,7 g/dL. Todos los pacientes estaban recibiendo derivados eritropoyéticos en el momento del estudio: 62,1% recibían epoetina alfa; 12,1%, epoetina beta y 25,9% eran tratados con darbepoetina. El 24,1% de los pacientes (14) presentaban hemoglobina inferior a 11 g/dL y de ellos, sólo 3 (5,1%), cumplían criterios de resistencia a AEE según la definición de las guías europeas, es decir, eran tratados con más de 300 UI/semana de eritropoyetina. Los restantes 11 pacientes con hemoglobina menor de 11 g/dL estaban siendo tratados con dosis inferiores a 300 UI/semana. Seis pacientes (10,3%) tenían hemoglobina superior a 11 g/dL pero recibían tratamiento con dosis elevadas de eritropoyetina (más de 300 UI/kg semanales). En total, un 15,5% de los pacientes (9) eran tratados con dosis elevadas de AEE: 3 mantenían Hb 11 g/dL y 6 tenían Hb < 11 g/dL. La dosis media semanal de AEE fue de 163,7 ± 114,5 UI/kg, con cifras que oscilaron entre las 18 y 500 UI/kg. Las cifras medias de IRE encontradas fueron de 14,1 ± 9,7 UI/kg/semana/Hb, con un rango entre 1,41 y 39,6. Más de la mitad (57%) de los pacientes presentaban un IRE por encima de 10.
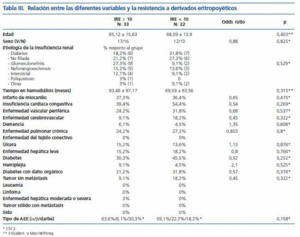
En la tabla III se indican los valores de las diferentes variables relacionas con la comorbilidad y su relación con el IRE. No encontramos relación entre ninguna de ellas y el IRE.
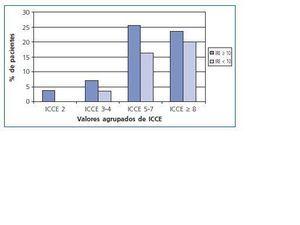
En la figura 2 mostramos la relación entre la comorbilidad evaluada mediante ICCE y la respuesta a derivados eritropoyéticos valorada mediante el IRE. Los valores de los índices de respuesta o resistencia para los distintos valores de ICCE (20,9 UI/kg/sem/g/gL para ICCE de 2; 23,3 UI/kg/sem/g/gL para ICCE de 3-4; 11,9 UI/kg/sem/g/gL para ICCE 5-7 y 13,2 UI/kg/sem/g/gL para ICCE 8) no muestran diferencias estadísticamente significativas (p = 0,276).
Los pacientes con hemoglobina inferior a 11 g/dL presentaron un ICCE ligeramente superior (8 ± 3,3) respecto a los que presentaban hemoglobina mayor o igual a 11 g/dL (7,3 ± 2,7). No encontramos significación estadística en estos resultados.
En el análisis multivariante tampoco encontramos relación entre la comorbilidad y el IRE.
DISCUSIÓN
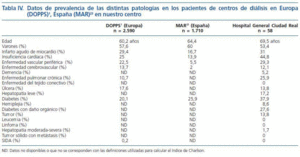
La prevalencia de pacientes en hemodiálisis en España es de 425 por millón de habitantes22. Muchos de estos pacientes presentan un número importante de patologías asociadas, como pone de manifiesto el estudio DOPPS1. Cuando comparamos las características de los 2.590 pacientes de centros europeos incluidos en el citado estudio, con los obtenidos en nuestro estudio (tabla IV), vemos que la prevalencia de infarto de miocardio, enfermedad cerebrovascular y úlcera péptica, es similar. En cambio, hemos encontrado un mayor porcentaje de insuficiencia cardíaca, enfermedad vascular periférica, enfermedad pulmonar crónica y diabetes en nuestra muestra que los datos que señala el estudio DOPPS. En el estudio MAR7, 23 (Morbidity and mortality Anemia Renal study), un estudio prospectivo en una muestra representativa de pacientes en hemodiálisis en España, se recogen datos de comorbilidad cardiovascular y control de anemia de 1.710 pacientes. Al comparar nuestros datos con este estudio (tabla IV) confirmamos una mayor prevalencia de patología cardiovascular como infarto agudo de miocardio, insuficiencia cardíaca, enfermedad vascular periférica, enfermedad cerebrovascular y diabetes en nuestras muestras.
Charlson validó en 1987 el índice de comorbilidad asociado a la edad (ICCE) para predecir la mortalidad al cabo de diez años2. Este índice es utilizado posteriormente en pacientes en hemodiálisis4, 5. En el citado estudio MAR7, 23 se calcula el ICCE, obteniendo un valor medio de 6,5 ± 2,3, que es algo inferior al encontrado en nuestro trabajo (7,4 ± 2,5). De los pacientes incluidos en nuestro trabajo, únicamente 8 no presentaban comorbilidad asociada a la enfermedad renal crónica, es decir, su puntuación en el ICC fue sólo de 2 (la puntuación correspondiente a la enfermedad renal). El resto de pacientes, en total 50, presenta alguna de las patologías incluidas en el índice de Charlson, lo que refleja la elevada prevalencia de enfermedades asociadas en nuestra muestra de pacientes hemodializados.
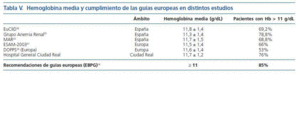
La hemoglobina media obtenida en nuestros pacientes (11,7 g/dL) es similar a la recogida en otros estudios realizados en España y en Europa (tabla V). Las Guías europeas de manejo de anemia en la enfermedad renal crónica14 recomiendan que, al menos un 85% de los pacientes de las unidades de hemodiálisis, mantengan cifras de hemoglobina superiores a 11 g/dL. En nuestro centro, esta cifra es menor: 24% de los pacientes estudiados no alcanza la hemoglobina diana. No obstante, esta hemoglobina diana tampoco se consigue en el resto de Europa, España incluida, según varios estudios epidemiológicos (tabla V). En el estudio DOPPS24, únicamente el 53% de los pacientes europeos incluidos superaba los 11 g/dL de hemoglobina. En España23, el 31,2% de los pacientes en hemodiálisis presenta cifras de hemoglobina inferiores a 11 g/dL. Por tanto, podemos afirmar que, a pesar de la revolución que ha supuesto el uso de AEE para el tratamiento de la anemia en la insuficiencia renal, aún nos encontramos lejos de un control adecuado de la anemia en estos pacientes, sobre todo si analizamos el porcentaje de pacientes fuera de rango. En nuestro trabajo, además de comprobar que la cuarta parte de los pacientes tiene Hb por debajo del valor recomendado, encontramos que más de la mitad de ellos (57%) tienen un IRE superior a 10. Esta cifra indica que ciertos pacientes con hemoglobina normal reciben tratamientos en rango de resistencia a AEE o, dicho de otro modo, alcanzan cifras adecuadas de hemoglobina a expensas de una dosis elevada de AEE. Por este motivo es preferible medir la respuesta a los AEE mediante el IRE más que por el concepto de resistencia que sólo contempla las dosis absolutas no corregidas con la hemoglobina25,26. El empleo de dosis elevadas de AEE puede normalizar la hemoglobina a pesar de existir cierta resistencia a estos tratamientos, más o menos subyacente. En nuestro estudio el 21% de los pacientes con hemoglobina superior a 11 g/dL reciben dosis muy elevadas de AEE. En el estudio Eu-CliD16, que incluye 4.426 pacientes en hemodiálisis, se analiza el IRE de los pacientes que llevaban más de seis meses en hemodiálisis, obteniendo un valor medio de 9,3; en nuestro estudio el IRE medio es superior (14,1). En EuClid se describe que el IRE es mayor si los AEE se empleaban por vía intravenosa que si se hacía por vía subcutánea (11,6 vs 9,6). En nuestro caso, todos los pacientes reciben tratamiento por vía intravenosa, y observamos que, si comparamos con el subgrupo de pacientes incluidos en EuCliD tratados únicamente con EAA intravenosos, el IRE obtenido en nuestro centro sigue siendo superior (14,1 en nuestro centro y 11,63 en EuCliD). Es decir, la respuesta a derivados eritropoyéticos en nuestros pacientes es inferior a la que aparece en otras unidades de diálisis en España. En nuestro estudio no hemos incluido la descripción de parámetros que se conoce afectan a la respuesta a derivados eritropoyéticos por encontrarse fuera de los objetivos definidos al principio de este texto, como son la ferropenia (absoluta o funcional), la desnutrición, inflamación, infradiálisis u otros. A pesar de esta importante limitación, hemos encontrado que en nuestra unidad existe un «exceso de tratamiento» o bien una disminución de la respuesta a AEE. Si únicamente utilizáramos las cifras de hemoglobina para evaluar el correcto manejo de la anemia en estos pacientes, puede que estuviéramos enmascarando casos de resistencia o sobretratamiento que se ponen de manifiesto cuando establecemos comparaciones con el índice de respuesta a AEE. Entre los sesgos de nuestro estudio señalamos que, además, se trata de un estudio retrospectivo y que la muestra escogida se basa en pacientes incluidos en programa de diálisis hospitalaria. Por tanto recoge la información de pacientes complejos, de mayor edad y con patologías graves asociadas, y con mayor número de circunstancias que favorecen la resistencia a derivados eritropoyéticos.
Cuando realizamos el estudio por grupos según el ICCE y estudiamos en cada uno de ellos el grado de control de la anemia y la respuesta a derivados eritropoyéticos, no encontramos diferencias significativas (fig. 2). Hemos encontrado que la resistencia a eritropoyetina, medida por el IRE, es similar en los distintos grupos establecidos según la comorbilidad, aunque sin significación estadística (p = 0,276).
No encontramos relación entre las distintas variables que miden la patología asociada en los pacientes en hemodiálisis y los valores de IRE (tabla III). Según los resultados de nuestro estudio, el grado de comorbilidad no influye en la respuesta de estos pacientes a los AEE, si bien estos datos habría que compararlos con pacientes de otras unidades de hemodiálisis extrahospitalaria, que a menudo tienen menor grado de comorbilidad. Previamente no se había estudiado dicha relación y, desde nuestro grupo, consideramos este aspecto relevante dado el elevado grado de comorbilidad que presentan los pacientes en hemodiálisis. Según nuestro estudio, por tanto, no podemos afirmar que exista relación entre la comorbilidad que presentan estos pacientes y el correcto control de la anemia o la respuesta a derivados eritropoyéticos, evaluada mediante el IRE.
Concluimos que a pesar de encontrar unos elevados índices de comorblidad y de anemia no controlada con aumento de la resistencia a los AEE en los pacientes incluidos en programa de hemodiálisis no parece existir una clara relación entre ellos. Muy posiblemente la respuesta de los AEE depende de otros factores que no guardan relación con las condiciones que determina la comorbilidad.
Tabla 1.
Tabla 2.
Tabla 3.
Tabla 4.
Tabla 5.
Figura 1.
Figura 2.