Los trastornos linfoproliferativos son complicaciones graves y potencialmente fatales en receptores de trasplante de órganos sólidos y células hematopoyéticas, como resultado de la inmunosupresión. Representan aproximadamente el 20% del conjunto de neoplasias malignas en esta población, aunque la incidencia global es aproximadamente del 1% en la población trasplantada a los 10 años.
Presentamos el caso clínico de un varón de 59 años, con enfermedad renal crónica secundaria a nefropatía mesangial IgA, que inicia tratamiento renal sustitutivo con hemodiálisis en 1989, y que recibe trasplante renal de donante cadáver en enero de 1991. En el postrasplante inmediato presenta 2 episodios de rechazo agudo celular, el primero en el cuarto día, con buena respuesta a esteroides, y el segundo en el vigésimo día, que precisó tratamiento con anticuerpos monoclonales OKT3, con buena respuesta clínica. El paciente comienza a los 25 años postrasplante con cuadro febril persistente de meses de evolución, síndrome constitucional asociado y pérdida ponderal, sin foco infeccioso asociado.
Se realiza estudio inicial con ecografía abdominal sugestiva de colecistitis y en analítica destaca elevación de reactantes de fase aguda, alteración del perfil hepaticobiliar, con aumento de transaminasas, enzimas de colestasis y anemización, por lo que se inicia estudio de síndrome febril sin foco infeccioso.
Se realiza estudio microbiológico con cultivos estériles, quantiferón y reacción en cadena de la polimerasa de citomegalovirus negativo, serología para Coxiella y ricketsias negativo. En el estudio radiológico, se realiza tomografía computarizada toracocabdominal con contraste yodado intravenoso, en el que únicamente se objetiva litiasis en vesícula biliar con dudosa imagen de colecistitis. Por este motivo se realiza colecistectomía abierta, continuando posteriormente con fiebre elevada persistente.
Ampliamos el estudio con reacción en cadena de virus de Epstein-Barr, que fue positiva, y realizamos tomografía por emisión de positrones body, pese a tener estudio radiológico sin datos significativos, objetivándose adenopatías supra- e infradiafragmáticas hipermetabólicas, compatibles con un proceso linfoproliferativo. Se procede a biopsia ganglionar, que fue diagnóstica de linfoma de Hodgkin clásico con hibridación in situ cromogénica para virus de Epstein-Barr: EBER.
INTRODUCCIÓN
El incremento de la población con trasplante de órganos y tejidos, así como la supervivencia del injerto y del paciente, ha sido posible gracias al desarrollo de los diferentes fármacos inmunosupresores. Sin embargo, consecuentemente al estado de inmunosupresión y al aumento de la supervivencia, se observa una mayor incidencia de infecciones y procesos de malignidad.
El desarrollo de síndrome febril en el postrasplante renal tiene elevada prevalencia en esta población. Aunque la causa más frecuente es de origen infeccioso, con infecciones bacterianas, oportunistas, por micobacterias o fúngicas, no debemos olvidar el origen tumoral. Si descartamos la patología infecciosa como causa del síndrome febril, debemos pensar en la posibilidad de un proceso tumoral como causante de este. Estos huéspedes generalmente tienen menos manifestaciones clínicas de infección y pocos o ningún hallazgo por radiología convencional. Por lo tanto, técnicas de imagen más sensibles, como la tomografía computarizada (TC) y la resonancia magnética son esenciales para evaluar la presencia y la naturaleza de los procesos infecciosos y malignos. Ningún hallazgo radiológico es lo suficientemente diagnóstico para excluir la causa del síndrome febril y, en algunos casos, es necesario el uso de procedimientos invasivos diagnósticos para obtener tejido para el cultivo y la histología.
CASO CLÍNICO
Varón de 59 años, con hipertensión arterial de larga duración, cardiopatía isquémica revascularizada con implantación de 3 stents en 2011, enfermedad renal crónica secundaria a glomerulonefritis mesangial IgA, que inicia tratamiento renal sustitutivo con hemodiálisis en 1989. Recibe trasplante renal de donante cadáver en enero de 1991. En el postrasplante inmediato presenta 2 episodios de rechazo agudo celular, el primero en el cuarto día, con buena respuesta a esteroides, y el segundo en el vigésimo día, precisando tratamiento con anticuerpos monoclonales OKT3, con buena respuesta clínica, y evoluciona con mejoría de la función renal, que presenta creatinina basal 1,1 mg/dl en tratamiento inmunosupresor de mantenimiento con prednisona y ciclosporina.
El paciente comienza con cuadro febril de meses de evolución, síndrome constitucional asociado y pérdida de peso, sin foco infeccioso asociado.
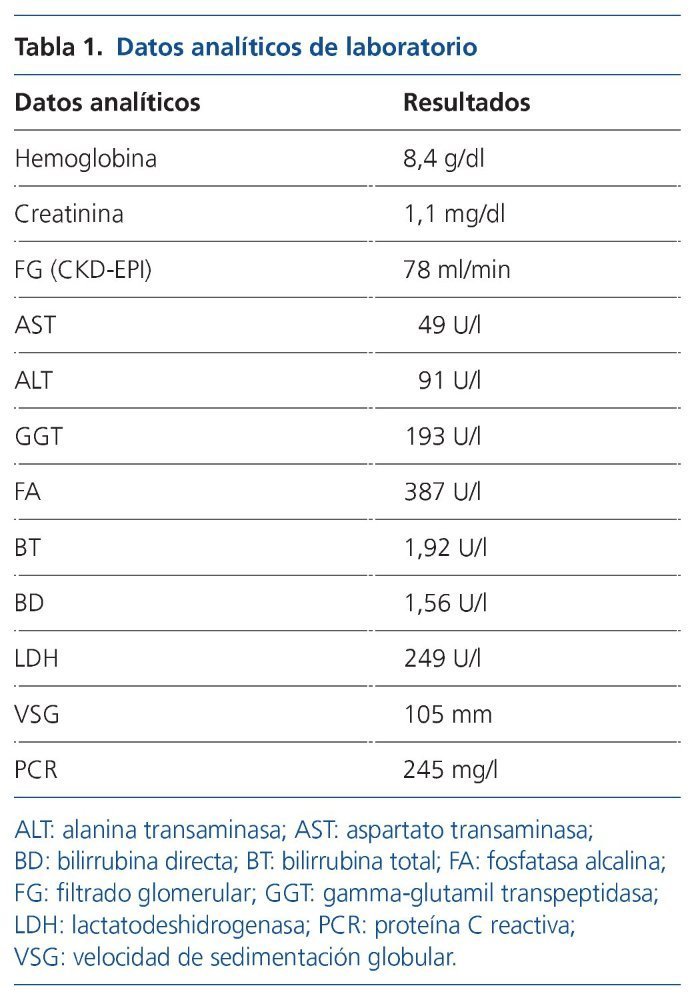
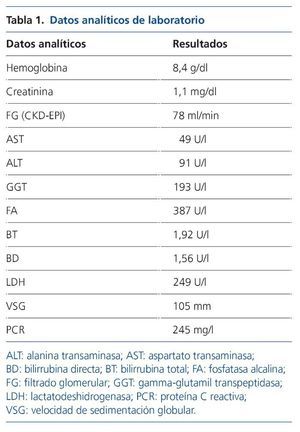
Por este motivo se realiza estudio inicial con ecografía abdominal, en la que únicamente destaca colelitiasis con pared vesicular no engrosada (de 2 mm) no sugestiva de colecistitis, y en analítica se objetiva elevación de reactantes de fase aguda, lactatodeshidrogenasa (LDH), alteración del perfil hepatobiliar y anemización (tabla 1). Inicialmente se interpreta como probable colecistitis aguda litiásica y se inicia tratamiento antibiótico, con hemocultivo y urocultivo estériles, mejorando parcialmente pero persistiendo el cuadro clínico.
Al disponer de cultivos estériles se amplía el estudio microbiológico mediante quantiferón, ADA (adenosín deaminasa), esputo con auramina y Lowenstein-Jensen, serología para leishmanía, rickettsias, Coxiella burnetti, Rosa de Bengala, VHB (virus de la hepatitis B), VHC (virus de la hepatitis C), VIH (virus de la inmunodeficiencia humana) y PCR-CMV (reacción en cadena de la polimerasa de citomegalovirus), que resultan negativos. En coprocultivo se hallaron huevos de Ascaris lumbricoides, por lo que se inició tratamiento con mebendazol 100 mg cada 12 h durante 3 días, sin expulsión fecal de parásitos y sin mejoría clínica.
Se realizó estudio radiológico, y en TC toracoabdominal con contraste se objetiva litiasis en vesícula biliar, con dudosa imagen de colecistitis; el ecocardiograma fue normal, sin otros hallazgos. Ingresa en enero de 2017 para realizar colecistectomía abierta; el resultado anatomopatológico de la pieza quirúrgica resulta normal. Tras la intervención continúa con fiebre.
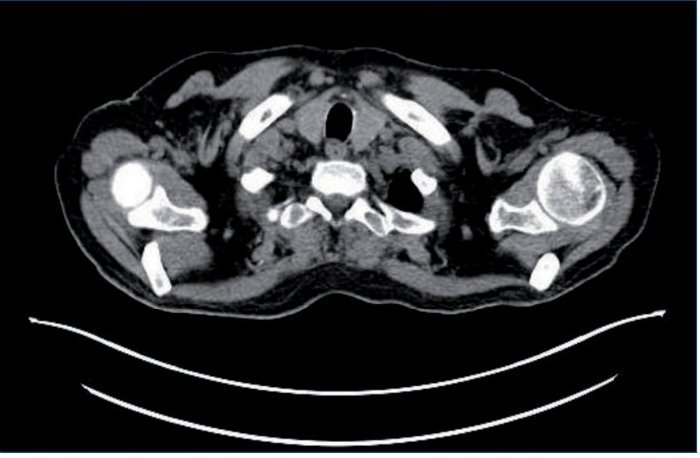
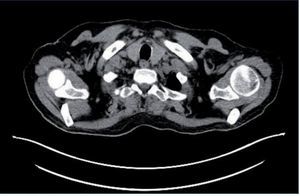
Se detecta PCR-VEB (PCR de virus Epstein-Barr) positiva con 14.000 copias/ml. Se realiza PET-TC (tomografía por emisión de positrones) (fig. 1), a pesar de que el estudio radiológico con TC body no presentó datos significativos. Se objetivan adenopatías hipermetabólicas supradiafragmáticas (supraclavicular izquierda, axilares derechas, mediastínicas paratraqueales bilaterales, precarinal, subcarínica-paraesofágica, hiliar izquierda) e infradiafragmáticas en hilio hepático, a nivel esplénico y óseas, compatibles con malignidad. Estos hallazgos son sugerentes de síndrome linfoproliferativo (SLP) como primera opción diagnóstica.
Figura 1. Adenopatías supradiafragmáticas.
Para confirmar el diagnóstico se realiza biopsia de médula ósea, en la que se aprecia médula reticulínica con infiltrado linfocitario de carácter incierto. Se procede a biopsia ganglionar, que es diagnóstica de linfoma de Hodgkin clásico, IVs-A, IP Hassenclever, con marcadores de superficie celular CD 20–, CD45-ALC–, CD30+, PAX5+ débil, CD15–, CD79a–, CD3–. Hibridación in situ cromogénica para VEB: EBER (Epstein-Bar virus early regions).
Se inicia reducción de inmunosupresión de mantenimiento, permaneciendo en monoterapia con prednisona, y se añade quimioterapia según esquema ABVD (doxorrubicina, bleomicina, vinblastina, dacarbazina) durante 4 ciclos. Al finalizar el cuarto ciclo, en control PET se objetiva una respuesta paradójica, con desaparición parcial de lesiones ganglionares y aparición de nuevos focos, y continúa con afectación supra- e infradiafragmática, pero con predominio en retroperitoneo y cadenas ilíacas y desaparición de las lesiones óseas. Dada esta respuesta, se inicia primer ciclo con esquema GPD (gemcitabina, cisplatino, dexametasona). Actualmente el paciente está inmerso en quimioterapia de segunda línea y a la espera de evolución.
El objetivo terapéutico respecto a la inmunosupresión de mantenimiento es introducir un inhibidor mTOR tras finalizar la quimioterapia. El paciente presenta mejoría de su estado general y el injerto renal es normofuncionante, con creatinina 1,1 mg/dl.
DISCUSIÓN
Los trastornos linfoproliferativos son proliferaciones linfoides y/o plasmocíticas, con complicaciones graves y potencialmente fatales en receptores de trasplante de órganos sólidos y células hematopoyéticas, como resultado de la inmunosupresión. Representan aproximadamente el 20% del conjunto de neoplasias malignas en esta población. Aunque la incidencia global es aproximadamente del 1% en la población trasplantada a los 10 años, 30 a 50 veces mayor que en la población general, varía según el tipo de aloinjerto, población de pacientes y diferentes regímenes inmunosupresores. La incidencia acumulada en 5 años es de entre el 1 y el 3% en pacientes con trasplante renal. En más del 80% de los casos aparece durante el primer año postrasplante.
Los principales factores de riesgo son el grado de inmunosupresión de células T (este paciente presentó en su evolución postrasplante 2 episodios de rechazo, con la consecuente administración de altas dosis de esteroides y anticuerpos monoclonales OKT3), el estado serológico del VEB, el tiempo transcurrido tras el trasplante, así como el uso de terapia de inducción con anticuerpos poli- y monoclonales. En particular, el grado de inmunosupresión de células T, provocado por los fármacos inmunosupresores, parece ser el más importante, ya que la proliferación de células B está inmunomodulada por estas células, y este mecanismo de defensa disminuye o desaparece cuando la función de las células T se ve afectada por la acción de los inmunosupresores administrados para evitar el rechazo del injerto.
También existe un incremento del riesgo en receptores serológicamente negativos para el VEB pretrasplante con donantes que presentan serología VEB positiva, adquiriendo así la infección postrasplante renal o bien por reactivación (en este paciente, dado el tiempo transcurrido postrasplante, no se dispone de datos sobre el estado serológico pretrasplante del receptor y del donante). Este virus, que infecta las células B, incrementa el riesgo de proliferación maligna que no se ve frenada por células T inactivas.
Los receptores de trasplante renal sanos pueden mostrar un discreto aumento de la carga viral de VEB; la gran mayoría de pacientes con SLP VEB positivo presentará una elevación más marcada en la carga viral del VEB. Como ejemplo, en un estudio, el plasma de pacientes con SLP tenía una carga viral media de 3.225 copias/100 µl, mientras que los controles inmunosuprimidos sin evidencia de SLP presentaban menos de 740 copias/100 µl. Esta observación nos puede ayudar para el diagnóstico precoz mediante la monitorización de la carga viral, con mayor utilidad en el primer año postrasplante renal. La ausencia de VEB no excluye el diagnóstico de SLP.
Las manifestaciones clínicas son variables, y las adenopatías asociadas a clínica constitucional son su forma más frecuente de presentación. Más del 50% presenta masas extranodales y, en otras ocasiones, solo se presentan con afectación sistémica, como el caso clínico que se presenta. La infiltración del aloinjerto puede asemejarse a la presentación clínica de un rechazo. Dado que las opciones del tratamiento para ambas patologías son opuestas, el diagnóstico de certeza resulta muy importante. En nuestro caso, la fiebre persistente, la elevación de LDH y ante la ausencia de hallazgos radiológicos, la presencia de carga viral VEB nos acercó al diagnóstico de SLP, solicitando PET body y el estudio histológico, que nos confirmarían el diagnóstico de presunción.
Por ello, el diagnóstico de SLP requiere elevado índice de sospecha, con clínica compatible, datos analíticos como la alteración de las células hematológicas, la elevación de enzimas intracelulares como LDH que indican lisis celular, y masas adenopáticas y extranodales en TC. Si en esta prueba radiológica no se obtienen datos y se dispone de alta sospecha, es necesario solicitar una PET, que mostrará datos de hipermetabolismo en áreas afectadas, en las cuales se debe obtener tejido para realizar estudio histológico que confirmará el diagnóstico.
CONCLUSIONES
El SLP es una complicación rara en el postrasplante renal, pero fatal y potencialmente mortal.
Su prevalencia es mayor en el primer año postrasplante.
El estado de inmunosupresión es el factor de riesgo más importante para su presentación.
El diagnóstico de sospecha es fundamental para su detección precoz, por lo que ante cualquier síndrome febril persistente debemos pensar en él y confirmarlo con histología del tejido afectado.
Agradecimientos
Este estudio se ha financiado en parte por el Ministerio de Economía, Industria y Competitividad de España (MINECO) (beca ICI14/00016) por el Instituto de Salud Carlos III, y ha sido cofinanciado por el Fondo Europeo de Desarrollo Regional–FEDER, RETICS (REDINREN RD16/0009/0006). Asimismo, damos las gracias a Ian Johnstone por la asistencia lingüística en la preparación del texto.
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses potencial relacionado con los contenidos de este artículo.
Correspondencia: Juana Alonso Titos
Servicio de Nefrología.
Hospital Regional Universitario de Málaga.
Avenida Carlos Haya, s/n. 29010, Málaga.
juana1204988@hotmail.com
REFERENCIAS BIBLIOGRÁFICAS RECOMENDADAS
Andreone P, Gramenzi A, Lorenzini S, Biselli M, Cursaro C, Pileri S, et al. Posttransplantation lymphoproliferative disorders. Arch Intern Med. 2003;163:1997-2004.
Caillard S, Dharnidharka V, Agodoa L, Bohen E, Abbott K. Posttrans-plant lymphoproliferative disorders after renal transplantation in the United States in era of modern immunosuppression. Transplantation. 2005;80:1233-43.
Craig FE, Johnson LR, Harvey SA, Nalesnik MA, Luo JH, Bhattacharya SD, et al. Gene expression profiling of Epstein-Barr virus-positive and -negative monomorphic B-cell posttransplant lymphoproliferative disorders. Diagn Mol Pathol. 2007;16:158-68.
Fellner MD, Durand KA, Solernou V, Bosaleh A, Balbarrey Z, García de Dávila MT, et al. Epstein-Barr virus load in transplant patients: Early detection of post-transplant lymphoproliferative. Rev Argent Microbiol. 2016;48:110-8.
Kew CE 2nd, López-Ben R, Smith JK, Robbin ML, Cook WJ, Gaston RS, et al. Postransplant lymphoproliferative disorder localized near the allograft in renal transplantation. Transplantation. 2000;69:809-14.
Landgren O, Gilbert ES, Rizzo JD, Socié G, Banks PM, Sobocinski KA, et al. Risk factors for lymphoproliferative disorders after allogeneic hematopoietic cell transplantation. Blood. 2009;113:4992-5001.
McDonald RA, Smith JM, Ho M, Lindblad R, Ikle D, Grimm P, et al; CCTPT Study Group. Incidence of PTLD in pediatric renal transplant recipients receiving basiliximab, calcineurin inhibitor, sirolimus and steroids. Am J Transplant. 2008;8:984-9.
Mosialos G, Birkenbach M, Yalamanchili R, VanArsdale T, Ware C, Kieff E. The Epstein-Barr virus transforming protein LMP1 engages signaling proteins for the tumor necrosis factor receptor family. Cell. 1995;80:389-99.
Opelz G, Döhler B. Lymphomas after solid organ transplantation: a collaborative transplant study report. Am J Transplant. 2004;4:222-30.
Opelz G, Naujokat C, Daniel V, Terness P, Döhler B. Disassociation between risk of graft loss and risk of non-Hodgkin lymphoma with induction agents in renal transplant recipients. Transplantation. 2006;81:1227-33.
Patton DF, Wilkowski CW, Hanson CA, Shapiro R, Gajl-Peczalska KJ, Filipovich AH, et al. Epstein-Barr virus--determined clonality in posttrans-plant lymphoproliferative disease. Transplantation. 1990;49:1080.
Smith JM, Rudser K, Gillen D, Kestenbaum B, Seliger S, Weiss N, et al. Risk of lymphoma after renal transplantation varies with time: an analysis of the United States Renal Data System. Transplantation. 2006;81:175-80.
Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon: IARC Press; 2008.
Tsai DE, Douglas L, Andreadis C, Vogl DT, Arnoldi S, Kotloff R, et al. EBV PCR in the diagnosis and monitoring of posttransplant lymphoproliferative disorder: results of a two-arm prospective trial. Am J Transplant. 2008;8:1016-24.
Van Esser JW, Van der Holt B, Meijer E, Niesters HG, Trenschel R, Thijsen SF, et al. Epstein-Barr virus (EBV) reactivation is a frequent event after allogeneic stem cell transplantation (SCT) and quantitatively predicts EBV-lymphoproliferative disease following T-cell—depleted SCT. Blood. 2001;98:972-8.