El síndrome hemolítico urémico atípico es una enfermedad relacionada con alteración en la regulación del complemento que generalmente evoluciona a enfermedad renal crónica terminal, con alta tasa de recaída en el trasplante renal y elevado riesgo de pérdida del injerto. La terapia anticomplemento ha mejorado el pronóstico de estos pacientes, logrando tener remisión de la enfermedad en la mayoría de los casos, aumentando la posibilidad de un trasplante renal exitoso e incrementando la supervivencia del paciente y del injerto; igualmente el uso de medicamentos con bajo riesgo de inducción de microangiopatías trombóticas como el belatacept y micofenolato se han utilizado con resultados satisfactorios. Presentamos el caso de una paciente joven de alto riesgo inmunológico, con síndrome hemolítico urémico atípico por mutación del factor H, a quien se realizó trasplante renal exitoso con eculizumab, timoglobulina, belatacept, micofenolato y esteroides conservando excelente función del injerto y sin recaídas de su enfermedad.
Atypical haemolytic uremic syndrome is a disease caused by complement regulation abnormalities that generally progresses to chronic end-stage renal disease with a high rate of recurrence in kidney transplantation and a high risk of graft loss. Anti-complement therapy has improved the prognosis of these patients, achieving disease remission in most cases, increasing the likelihood of a successful kidney transplant and increasing patient and graft survival. Drugs with low risk of induction of thrombotic microangiopathies such as belatacept and mycophenolate have also been used with satisfactory results. We present the case of a young patient at high immunological risk, with atypical haemolytic uraemic syndrome due to factor H mutation, who underwent a successful kidney transplantation with eculizumab, thymoglobulin, belatacept, mycophenolate and steroids, to date preserving excellent graft function without disease recurrence.
Las microangiopatías trombóticas (MAT) son un grupo de entidades que se caracterizan por la presencia de anemia hemolítica microangiopática no inmune, trombocitopenia y falla de uno o múltiples órganos. Las causas asociadas a la aparición de las MAT son múltiples; pueden ser secundarias a déficit en la actividad de la enzima ADAMTS 13 lo que se conoce como púrpura trombocitopénica trombótica; a infecciones enteroinvasivas por bacterias productoras de toxina Shiga, dando lugar al síndrome hemolítico urémico típico; a causas secundarias por condiciones amplificadoras del complemento como embarazo, infecciones, enfermedades autoinmunes, neoplásicas, medicamentos o tóxicos; o por alteraciones en la regulación de la vía alternativa del complemento lo cual produce el síndrome hemolítico urémico atípico (SHUa) o también conocido como microangiopatías trombóticas secundarias a alteración en la regulación del complemento1,2. Previo al año 2011 cuando no se contaba con tratamiento anticomplemento, esta última entidad se asociaba con un alto riesgo de enfermedad renal crónica terminal y muerte3; y si estos pacientes recibían un trasplante renal, la supervivencia del injerto era muy baja, debido a un alto porcentaje de recurrencia del SHUa postrasplante. Por este motivo el trasplante simultáneo de hígado riñón era una de las opciones disponibles para estos pacientes, sin embargo este procedimiento tenía alto riesgo de complicaciones y muerte3.
Desde la aparición del eculizumab ha sido posible la realización de trasplante renal en pacientes con SHUa, con mejores desenlaces a corto y mediano plazo; disminuyendo su recurrencia, mejorando la supervivencia del injerto renal e incluso reduciendo la posibilidad de rechazo mediado por anticuerpos4.
A continuación presentamos el caso de una paciente con diagnóstico de enfermedad renal crónica terminal secundaria a SHUa y sensibilizada por politransfusión, quien recibió trasplante renal exitoso con protocolo de eculizumab, timoglobulina, belatacept.
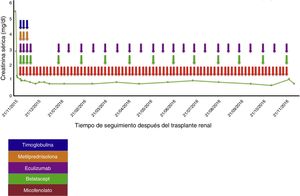
Caso clínicoPaciente femenina de 38 años de edad, con antecedentes de MAT diagnóstica en el año 2005, en quien se descartaron causas infecciosas, inmunológicas, tóxicas, metabólicas y neoplásicas. Al momento del diagnóstico la paciente recibió tratamiento con recambios plasmáticos (30 sesiones), politransfusión (20 U de glóbulos rojos), esteroides, ciclofosfamida intravenosa (IV) (6 dosis de 750mg con intervalo de un mes) y rituximab IV (4 dosis de 500mg con intervalo de una semana); terapia a la cual fue refractaria; con deterioro progresivo de la función renal hasta llegar a enfermedad renal crónica terminal y necesidad de terapia de reemplazo renal tipo hemodiálisis desde el año 2005. En el año 2008 ingresó en lista de espera para trasplante renal en otra institución, presentando en ese momento un panel reactivo de anticuerpos (PRA) clase I y clase II mayor del 85%, razón por la cual recibió protocolo de desensibilización con plasmaféresis, rituximab e inmunoglobulina. Estuvo durante más de 5 años en lista de espera sin que consiguiera el órgano. En febrero de 2014 presentó crisis hemolítica e hipertensiva documentándose anemia hemolítica microangiopática con ADAMS 13 normal. Se hace estudio genético que documentó mutación del gen del factor H de la regulación del complemento «Arg257Cyst» (mutación no reportada previamente y la cual se presentó tanto en este paciente como en uno de sus hermanos, ambos con antecedentes de MAT), razón por la cual se inició manejo con eculizumab 900mg semanal durante 4 semanas y posteriormente 1.200mg quincenal indefinidamente, previa vacunación contra meningococo y neumococo, terapia que permitió el control de su enfermedad. En noviembre de 2014 ingresó en protocolo de trasplante renal en nuestra institución estando bajo tratamiento con eculizumab. Para esa época la paciente tenía un PRA corregido por «single antigen» clase I del 87% y PRA clase II del 50%. Fue trasplantada de riñón el 21 de noviembre de 2015. Donante fallecido óptimo, tiempo de isquemia fría 19 h+30 min, tiempo de isquemia caliente 25 min. Compatibilidad con su donante 2 DR, 1A. Recibió protocolo de inmunosupresión con timoglobulina, metilprednisolona, belatacept, micofenolato y esquema de reinducción con eculizumab. Se dio profilaxis universal con valganciclovir, trimetoprim sulfametoxazol y nistatina (tabla 1). La cirugía se realizó sin complicaciones, con una función inmediata del injerto renal. La creatinina al día 6 postrasplante fue de 0,8mg/dl, la cual se ha mantenido a los 18 meses de seguimiento (fig. 1).
Protocolo de tratamiento utilizado en el trasplante renal
| Inmunosupresión | |
|---|---|
| Inducción | Mantenimiento |
| Timoglobulina 75mg IV día durante tres días | Micofenolato sódico 720mg vía oral cada 12 h desde el día 0 del trasplante |
| Metilprednisolona 500mg intravenoso al día durante tres días | Prednisolona 50mg vía oral a partir del cuarto día del trasplante con desmonte progresivo hasta lograr 10mg al día |
| Reajuste de la dosis de eculizumab al momento del trasplante a 900mg IV semanal durante cuatro semanas, 1.200mg a la semana 5 y posteriormente 1.200mg quincenal | Trimetropin sulfametoxazole 960mg interdiario |
| Belatacept: 500mg día 0, 4, 14, 28, 56, 84, y a partir del cuarto mes 250mg mensual | Valganciclovir 900mg día durante 100 días |
IV: intravenoso; VO: vía oral.
Los pacientes con SHUa que requieren trasplante renal tienen un riesgo de recurrencia de la enfermedad dos veces mayor que los trasplantados por otra causa; con una incidencia tan alta como del 40 al 60% según diferentes series, y con una posibilidad cinco veces mayor de pérdida del injerto renal5. Entre las causas genéticas del SHUa, las mutaciones en el factor H, I, B y C3 se presentan en el 60 a 70% de los casos; y los pacientes con presencia de estas mutaciones tienen un riesgo de hasta el 80% de pérdida del injerto renal; por el contrario, los pacientes con SHUa secundarios a mutaciones en la proteína cofactora de membrana (MCP, del inglés membrane cofactor protein), la recurrencia de la enfermedad posterior al trasplante renal es menor dado que el riñón trasplantado produce este regulador del complemento. De allí la importancia de un estudio genético previo al trasplante renal, lo cual permite estratificar el riesgo de recurrencia y pérdida del injerto versus el beneficio del mismo5,6; desafortunadamente, un porcentaje de pacientes no tienen una mutación genética identificada y el riesgo de recurrencia es desconocido, existiendo asociación con otras condiciones menos documentadas como el tiempo de isquemia fría, uso de anticalcineurínicos, MTOR, rechazo humoral e infecciones que son desencadenantes o agravantes del proceso4,6–8.
En la actualidad, el eculizumab es una de las terapias recomendadas para prevenir la recurrencia del SHUa posterior al trasplante renal con resultados satisfactorios en la mayoría de los pacientes5,9,10. Zuber et al.10 describen en un estudio multicéntrico retrospectivo, 22 pacientes trasplantados de riñón con SHUa a quienes se administró eculizumab; 9 de ellos lo recibieron como medida profiláctica antes del trasplante y una dosis adicional 24 h después, presentándose recurrencia de la enfermedad en solo un paciente 14 meses posterior al trasplante; los 13 pacientes restantes recibieron el anti-C5 para tratamiento de recurrencia del SHUa postrasplante presentando adecuado control de la enfermedad con mayor beneficio con el inicio temprano del medicamento y sin complicaciones infecciosas por gérmenes encapsulados. Estos hallazgos soportan el uso de eculizumab como medida preventiva de recaída del SHUa y como tratamiento de las recurrencias evitando la pérdida del injerto8,10–12. Además tiene un efecto positivo para prevenir y tratar el rechazo humoral en los pacientes sensibilizados como era el caso de nuestra paciente4,12,13.
Adicionalmente se debe tener en cuenta que algunos medicamentos utilizados como terapia inmunosupresora en el trasplante renal son disparadores de la MAT, como por ejemplo los inhibidores de la calcineurina6,14 y los inhibidores de la rapamicina15. Por este motivo, en la actualidad se buscan otras alternativas para disminuir este riesgo, como el belatacept, el cual es un inmunosupresor que se utiliza como terapia de mantenimiento en el trasplante renal. Este medicamento es una proteína de fusión compuesta por el fragmento Fc de la IgG1 humana y el dominio extracelular del CTLA-4 (cytotoxic T-Lymphocyte.associated antigen 4), uniéndose con alta afinidad al CD80 e inhibiendo selectivamente la activación de las células T por medio del bloqueo de la coestimulación14–16 e induciendo anergia y apoptosis de las células T2. El belatacept se caracteriza por no ser nefrotóxico y no inducir MAT13,17,18, posicionándose como uno de los medicamentos con buen perfil de seguridad a utilizar en el trasplante renal19.
En la literatura mundial se han documentado pocos casos del uso de belatacept en pacientes con SHUa postrasplante renal15. Merola et al. reportaron un paciente con MAT secundaria al uso de anticalcineurínicos a las 18 h del trasplante, siendo manejado con eculizumab y reemplazo del tacrolimus por belatacept, obteniendo recuperación completa de la función del injerto renal y libre de recaídas a los dos años de seguimiento14. Dedhia et al. publicaron un caso de recurrencia de SHUa por mutación homocigota del factor H a los 14 días posterior al trasplante renal, que fue tratado con eculizumab y cambio de tacrolimus por belatacept, con recuperación de la función del injerto renal y que se mantuvo estable a 2,5 años de seguimiento2. Hasta nuestro conocimiento, este es el primer caso reportado donde se utiliza en forma combinada belatacept y eculizumab como terapia preventiva de recurrencia de SHUa en una paciente trasplantada renal con antecedente de mutación del factor H.
En conclusión, aunque el trasplante renal en pacientes con SHUa se asocia frecuentemente a recaída y pérdida del injerto renal, actualmente existe la posibilidad de disminuir estos riesgos con las nuevas terapias disponibles como son el uso de eculizumab y medicamentos no inductores de MAT como belatacept, aumentando las posibilidades de realizar exitosamente el trasplante renal. En el caso reportado, se decidió inducción con timoglobulina por tratarse de una paciente altamente sensibilizada y eculizumab para prevenir la recurrencia del SHUa y el rechazo humoral. Como esquema de mantenimiento se decidió utilizar belatacept, micofenolato y esteroides evitando medicamentos potencialmente disparadores de MAT como los anticalcineurínicos, lográndose hasta el momento actual una evolución adecuada.
Conflicto de interesesEl autor John Fredy Nieto-Ríos declara que ha dictado charlas de microangiopatías trombóticas patrocinadas por Alexión pharma. El resto de los autores declaran no tener ningún conflicto de intereses.
Al Hospital Pablo Tobón Uribe por permitir la realización de este reporte de caso.