La poliquistosis renal autosómica dominante (PQRAD) es la enfermedad renal hereditaria más frecuente. Su prevalencia estimada es variable según las series, oscilando entre 1 de cada 500 y 1 de cada 2.000 personas. Representa la cuarta causa de enfermedad renal crónica terminal (ERCT), constituyendo entre el 6 y el 10% de la población en tratamiento renal sustitutivo (TRS)1.
Se caracteriza por la aparición paulatina de quistes renales y progresión a ERCT, así como por la asociación de manifestaciones sistémicas tales como hipertensión arterial, aneurismas intracraneales y poliquistosis hepática. El crecimiento de los quistes y del tamaño renal se relaciona, además de con la progresión hacia la ERCT, con síntomas asociados al compromiso de espacio abdominal y a la compresión sobre otras estructuras, generando saciedad, dolor y pseudo-obstrucción intestinal2.
El conocimiento de esta enfermedad ha ido progresando en las últimas décadas. Desde que en los años noventa se identificaran los principales genes relacionados con la PQRAD, PKD1 y PKD23,4, se ha conseguido establecer una estrecha correlación genotipo-fenotipo, así como la identificación de aquellos que confieren más riesgo de progresión. Además, se han descubierto nuevos genes implicados (GANAB, DNAJB11 y ALG9)5-7, así como algunas de las vías metabólicas implicadas en la cistogénesis, como es el caso de la sobreexpresión de adenosín monofosfato cíclico (AMPc). Esto ha permitido el desarrollo de fármacos como el tolvaptán, un antagonista del receptor V2 de la vasopresina, que reduce los niveles de AMPc en el túbulo colector y en la nefrona distal, reduciendo así la secreción de fluidos al interior del quiste y la proliferación celular, lo que provoca un enlentecimiento del desarrollo quístico y la progresión de la enfermedad8.
Actualmente, la indicación de tolvaptán está limitada al objetivo de enlentecer la progresión de la enfermedad renal, quedando restringido únicamente a los pacientes adultos con ERC estadios 1-4 y evidencia de criterios de rápida progresión1,8,9. Sin embargo, hay otros potenciales beneficios de uso, como el que expresamos a continuación.
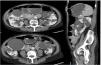
Se trata de una mujer de 69 años, con antecedentes de hipertensión, polineuropatía sensitiva axonal por síndrome CANVAS y PQRAD diagnosticada a los 40años, con confirmación posterior de mutación en PKD2. A lo largo de la evolución de la enfermedad han destacado las siguientes incidencias: punción evacuadora de los quistes que comprimían la arteria renal hace aproximadamente 30años y varios episodios de pseudo-obstrucción intestinal justificados por un megacolon adquirido secundario a compresión intestinal por los quistes renales (fig. 1) que precisaron la punción y la esclerosis de un quiste dominante de gran tamaño en el último año. A pesar de ello, la paciente persistió con dificultad para la ingesta y dolor abdominal. En ese momento la función renal se mantenía normal y no presentaba criterios de rápida progresión, lo que impedía el uso de tolvaptán según las actuales indicaciones. Sin embargo, en septiembre de 2022 se decidió ensayar tratamiento compasivo con tolvaptán de acuerdo con la paciente, con fines dirigidos a disminuir el volumen abdominal, así como un mejor control del dolor. En consonancia con este razonamiento, se prescribieron 45mg de tolvaptán por la mañana y 15mg ocho horas después.
En las revisiones de noviembre y diciembre de 2022 la paciente refiere encontrarse mejor, con disminución de la sensación de ocupación abdominal, sin nuevos episodios de pseudo-obstrucción intestinal, disminución de la saciedad y del dolor abdominal, lo que le ha permitido volver a hacer deporte, viajar y ganar 1-2kg de peso. La paciente refiere buena tolerancia a los efectos acuaréticos y no presenta alteraciones bioquímicas en los controles analíticos.
El efecto de «vaciado» de los quistes renales es rápido, ya que suele acontecer en las 3-4 primeras semanas tras el inicio de tratamiento con tolvaptán10, circunstancia que podría explicar la precoz mejoría de la enferma.
En conclusión, la PQRAD es una entidad caracterizada por la aparición de quistes renales, progresión a ERCT, manifestaciones sistémicas asociadas y sintomatología secundaria a la compresión de estructuras por los quistes renales. En el momento actual, las indicaciones de uso de tolvaptán están restringidas a enlentecer la progresión renal; sin embargo, los beneficios también pueden incluir la mejoría de clínica digestiva, como ocurre en nuestro caso.