Antecedentes: La eritropoyetina beta pegilada (PegEPO) está indicada en el tratamiento de la anemia por enfermedad renal crónica. Su larga semivida permite su administración mensual en fases de mantenimiento. Objetivo: Evaluar el uso, efectividad y coste de PegEPO en un grupo de pacientes con insuficiencia renal crónica en estadio prediálisis. Método: Estudio observacional retrospectivo en pacientes prediálisis que iniciaron tratamiento con PegEPO entre mayo de 2008 y febrero de 2009. Se recogieron: edad, sexo, niveles de hemoglobina (Hb) y dosis y frecuencia del agente estimulante de eritropoyesis (AEE) utilizado. El período de seguimiento fue de 12 meses. Resultados: Se incluyeron 198 pacientes. La Hb media al inicio de PegEPO en pacientes sin tratamiento previo fue de 10,8 g/l y de 11,6 g/l a los 90 días (p < 0,0001). En pacientes con AEE previo, la Hb media al inicio de PegEPO fue de 11,2 g/l y de 11,4 g/l a los 12 meses de tratamiento (p = 0,846). El 25% de los pacientes presentaron valores de Hb superiores a 12 g/l (p < 0,0001) a los 12 meses del inicio del tratamiento, de los cuales un 45% superó los 13 g/l. Se observa la utilización de dosis un 39% menores de las indicadas en ficha técnica y, como consecuencia, un coste inferior respecto al teórico esperado. Conclusiones: Las dosis utilizadas de PegEPO en pacientes con AAE previo fueron inferiores a las indicadas en ficha técnica manteniéndose estable la Hb a los 12 meses del inicio. Una mayor proporción de pacientes superan el límite de 13 g/l.
Background: Methoxy polyethylene glycol-epoetin beta (PEG-EPO) is indicated for the treatment of anaemia due to chronic kidney disease. Its long half-life allows it to be administered once per month in maintenance therapy. Objective: To evaluate the use, effectiveness and cost of PEG-EPO in a group of pre-dialysis chronic renal failure patients. Method: Retrospective observational study in pre-dialysis patients who began treatment with PEG-EPO between May 2008 and February 2009. The following data were gathered: age, sex, haemoglobin levels (Hb) and erythropoiesis-stimulating agent (ESA) dose and frequency. The follow-up period was 12 months. Results: We included 198 patients. Mean Hb upon starting PEG-EPO in patients who had received no prior treatment was 10.8g/l, and 11.6g/l at 90 days (P<.0001). In patients previously treated with ESA, mean Hb before starting PEG-EPO treatment was 11.2g/l, and 11.4g/l at 12 months (P=.846). Hb values were higher than 12g/l (P<.0001) after 12 months of treatment in 25% of patients; of these, 45% had values above 13g/l. We observed doses 39% lower than those indicated on the drug leaflet, resulting in a reduction in the originally expected theoretical costs. Conclusions: The doses of PEG-EPO administered to patients with a prior history of ESA treatment were lower than those indicated by the drug leaflet, and Hb remained stable after 12 months of treatment. A large portion of the patients had levels above the 13g/l threshold.
INTRODUCCIÓN
La anemia es una complicación frecuente de la enfermedad renal crónica (ERC) que se asocia con una disminución en la calidad de vida de los pacientes y un aumento en el riesgo de padecer otras complicaciones clínicas, entre ellas un importante incremento del riesgo cardiovascular. La anemia aparece en estadios precoces de la enfermedad con descenso de la hemoglobina (Hb) cuando la tasa de filtrado glomerular se sitúa alrededor de 70 ml/min (hombres) y 50 ml/min (mujeres). En estadios más avanzados y en pacientes en diálisis, alrededor del 90% de los pacientes presenta anemia1-3.
Los agentes estimulantes de la eritropoyesis (AEE) no pegilados actualmente disponibles para uso clínico son epoetina alfa, epoetina beta, darbepoetina alfa y epoetina theta. Además de los agentes citados, se han autorizado mediante procedimiento centralizado en la Unión Europea varias eritropoyetinas biosimilares a un agente biológico, siendo en todos los casos la eritropoyetina alfa el agente de referencia. Su semivida corta obliga a una administración frecuente, de una a tres veces a la semana, para conseguir niveles de Hb dentro de los límites establecidos. En 2007 se autorizó en Europa la eritropoyetina beta pegilada (PegEPO). Su mayor semivida permite su administración quincenal durante la fase de corrección, y mensual en el período de mantenimiento.
La eficacia, seguridad y tolerabilidad de la PegEPO se ha estudiado y comparado con otros AEE en seis ensayos de fase III, en los que se evaluó la eficacia y la seguridad del tratamiento de la anemia relacionada con la ERC con PegEPO. En dichos estudios se observó que PegEPO presenta un perfil de seguridad similar al de los otros AEE, y sus efectos adversos más frecuentes son la hipertensión arterial, la diarrea y la nasofaringitis. La incidencia de efectos adversos graves (neumonía e infarto de miocardio) fue ligeramente menor en el grupo tratado con PegEPO que en los grupos comparadores.
Los objetivos de nuestro estudio fueron evaluar el uso y la efectividad de pegEPO en el grupo de pacientes en prediálisis de nuestro hospital, así como el análisis del coste, comparándolo con el tratamiento previo con otro AEE.
MÉTODOS
Se realizó un estudio observacional retrospectivo en el que se incluyó a todos los pacientes de un hospital de tercer nivel con ERC en estadios 3, 4 o 5 no-D –prediálisis– que iniciaron tratamiento con PegEPO entre el 1 de mayo de 2008 y el 28 de febrero de 2009. Se excluyeron los pacientes en diálisis.
Los datos se obtuvieron del programa de dispensación ambulatoria del Servicio de Farmacia y de la estación clínica de trabajo del hospital. Se recogieron las siguientes variables: edad, sexo, Hb al inicio, al mes y a los 3, 6 y 12 meses tras el inicio de PegEPO y datos del tratamiento con AEE anterior (AEE, dosis y frecuencia) y PegEPO (dosis y frecuencia). Para los pacientes que recibían tratamiento con otro AEE antes del inicio de PegEPO, la Hb al inicio se calculó como la Hb media de los 6 meses anteriores al inicio de PegEPO.
El análisis estadístico se realizó con el programa SPSS versión 19.0.
RESULTADOS
Se incluyeron un total de 190 pacientes (101 hombres) con insuficiencia renal crónica en estadio prediálisis 3 (50 pacientes), estadio 4 (85 pacientes) y estadio 5 no-D (55 pacientes). La edad media fue de 65 años (22-93).
Durante el periodo de estudio no variaron significativamente los aportes de hierro ni tampoco las dosis de agentes potencialmente anemizantes, como los inhibidores de la enzima convertidora de angiotensina o los antagonistas del receptor de angiotensina II.
De los 190 pacientes, 127 (66,8%) habían recibido tratamiento anterior con otro AEE –67 pacientes, darbepoetina (52,7%), y 60, eritropoyetina beta (47,3%)–.
La dosis mediana de PegEPO administrada fue de 75 µg/mes (50-150) en pacientes con y sin AEE anterior. No se han observado diferencias estadísticamente significativas en la dosis de PegEPO recibida según el tratamiento anterior administrado ni según el estadio. En pacientes tratados previamente con darbepoetina, la dosis mediana de PegEPO administrada fue de 75 µg/mes (75-250). En pacientes que recibían eritropoyetina beta como AEE previo, la dosis mediana de PegEPO administrada fue de 75 µg/mes (50-250).
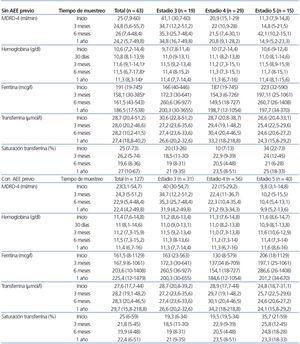
La Hb media al inicio del tratamiento con PegEPO en los pacientes sin tratamiento con AEE previo fue de 10,6 g/dl (7,2-14,4); a los 3 meses, de 11,6 g/dl (9,1-14,1) (p < 0,0001), y a los 12 meses, de 11,3 g/dl (8,3-14) (p < 0,0001). El valor de ferritina muestra diferencias estadísticamente significativas a los 3 meses de inicio del tratamiento con PegEPO con una media de 158,1 µg/l respecto a 191 µg/l al inicio. A los 12 meses el nivel de ferritina medio fue de 187 µg/l. El valor de saturación de transferrina no muestra diferencias estadísticamente significativas a los 12 meses del inicio del tratamiento con PegEPO ni tampoco el valor de filtrado glomerular a los 3,6 y 12 meses. En el análisis por estadios sólo se observa una disminución estadísticamente significativa en el nivel de ferritina para el estadio 4 a los 3 meses.
La Hb media durante los 6 meses anteriores al tratamiento con PegEPO en el grupo de los pacientes con tratamiento AEE anterior (132 pacientes) fue de 11,4 g/dl (7,2-14,8) y a los 6 meses y al año del inicio de PegEPO, fue de 11,5 g/dl (7,3-15,2) (p = 0,476) y 11,4 g/dl (6,7-16), (p = 0,846), respectivamente. Los valores de ferritina, transferrina y saturación de transferrina son estables durante todo el período de seguimiento. Los valores del filtrado glomerular no muestran diferencias para ningún estadio a los 3, 6 y 12 meses (tabla 1), pero destaca una caída no estadísticamente significativa del filtrado glomerular al final del primer año (de aproximadamente unos 6-7 ml/min) en los pacientes del estadio 3 (en pacientes en tratamiento y sin tratamiento previo con AEE).
El 13% de los pacientes requirieron un cambio de dosis de PegEPO, de los cuales el 44% (n = 11) necesitó un aumento de dosis (incremento medio: 58%), y el 56% (n = 14), una reducción de dosis (reducción media: 32%). Estos cambios de dosis no implicaron ninguna variación en la dosis mediana utilizada. El 20% de los pacientes suspendieron el tratamiento con PegEPO, de los cuales el 35% requirieron el cambio a otro AEE por mal control de Hb, el 25% fueron éxitus y el 40% fueron trasplantados. Las causas de éxitus fueron: neoplasia de pulmón (2), cardiopatía isquémica (1), insuficiencia cardíaca congestiva (2), edema de pulmón (1), fractura de clavícula complicada (1), neumonía (1) y hemorragia subaracnoidea (1). Ninguna de las muertes fue causada por el tratamiento con AEE.
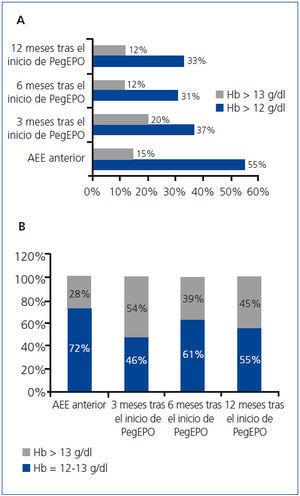
El 55% de los pacientes (n = 72) presentaron valores de Hb superiores a 12 g/dl durante el tratamiento con AEE anterior a PegEPO. Un 28% de estos pacientes presentaban valores superiores a 13 g/dl. Durante el tratamiento con PegEPO, el 19% de los pacientes (n = 37) presentaban valores de Hb superiores a 12 g/dl a los 3 meses, de los cuales un 54% (n = 20) presentaba valores por encima de 13 g/dl (p < 0,0001). A los 6 meses un 31% (n = 41) presentaba valores superiores a 12 g/dl (el 39% de los cuales, por encima de 13 g/dl) y a los 12 meses el porcentaje fue del 25% (n = 33) (el 45% de los cuales superó los 13 g/dl) (figura 1).
El coste medio mensual (precio de venta de laboratorio -PVL-) por paciente con AEE no pegilado fue de 156,5 €/paciente/mes y con PegEPO de 142,3 €/paciente/mes (p > 0,05). El coste medio mensual por paciente con darbepoetina fue de 220,1 €/paciente/mes; tras el cambio a PegEPO, el coste medio fue de 148,9 €/paciente/mes (p < 0,0001). El coste medio mensual por paciente con eritropoyetina beta fue de 86,8 €/paciente/mes; tras el cambio a PegEPO, éste aumentó a 135,1 €/paciente/mes (p < 0,0001).
DISCUSIÓN
La guía NKF-KDOQI 2006 recomienda niveles de Hb de entre 11 y 12 g/dl, sin sobrepasar nunca los 13 g/dl2,3, a diferencia de la guía de 2000, en la que no se establece ningún límite superior en los niveles de hemoglobina. Estos cambios se basan en el resultado de 22 estudios aleatorizados y controlados, entre los que cabe destacar el estudio CREATE, realizado en Europa, y el estudio CHOIR, realizado en Estados Unidos. El estudio CREATE analiza los eventos cardiovasculares, la necesidad de diálisis y la calidad de vida en pacientes con ERC no sometidos a diálisis que recibieron tratamiento con epoetina beta y se aleatorizaron a dos grupos de tratamiento: pacientes con Hb entre 13-15 g/dl (n = 301) y pacientes con Hb entre 10,5-11,5 g/dl (n = 302). Los autores observan que la normalización de la Hb mejora la calidad de vida de los pacientes, especialmente en aspectos relacionados con la función física y la salud mental, pero sin diferencias en la aparición de efectos cardiovasculares. En cambio, precisaron más diálisis y presentaron más episodios de hipertensión y cefaleas4.
En el estudio CHOIR, todos los pacientes recibían epoetina alfa y eran aleatorizados a dos grupos de tratamiento, uno para pacientes con cifras de Hb superiores o iguales a 13,5 g/dl (n = 715) y otro para pacientes con cifras de Hb de 11,3 g/dl (n = 717). Los autores concluyen que la normalización de la Hb se asocia con un incremento en el riesgo de padecer eventos cardiovasculares o de otras causas, pero sin mejoría de la calidad de vida, por lo que recomiendan mantener a los pacientes con niveles de Hb de entre 11 y 12 g/dl5. Una revisión del uso de AEE realizada por Ortega et al.6 apoya las conclusiones de dichos estudios. Los resultados de estos estudios instaron a la Food and Drug Administration (FDA) y a la European Medicines Agency (EMA) a emitir una advertencia de seguridad sobre el uso de AEE y los valores de Hb. La FDA recomienda usar las dosis de AEE más bajas posibles e incrementarlas de forma gradual para evitar la necesidad de transfusiones, pero sin superar concentraciones de Hb de 12 g/dl7. La EMA, en un informe posautorización, informa de que en pacientes con ERC una Hb superior a 12 g/dl se asocia con un aumento de las complicaciones graves cardiovasculares y de la mortalidad por cualquier causa. Por este motivo aconseja precaución cuando los valores de Hb se elevan por encima de 12 g/dl8.
La guía KDIGO 2008 concluye que niveles de Hb superiores a 13 g/dl son perjudiciales para el paciente, niveles de 9,5-11,5 g/dl aportan más beneficios que riesgos y que no hay evidencias de riesgo-beneficio en pacientes con valores de Hb de entre 11,5 y 13 g/dl9. La S.E.N. recomienda alcanzar niveles de 11 y 13 g/dl y no sobrepasar valores superiores a 13 g/dl salvo en casos concretos, como pacientes jóvenes no hemodializados o pacientes que padezcan enfermedad pulmonar obstructiva crónica10.
En nuestro estudio, el 12% del total de los pacientes alcanzaron niveles de Hb superiores a 13 g/dl durante los 6 primeros meses de tratamiento con PegEPO, frente al 15% con el tratamiento con AEE no pegilado anterior. Cabe destacar que, dentro del grupo de pacientes con Hb superior a 12 g/dl, el porcentaje de pacientes que alcanzan a superar el límite de 13 g/dl llegó a ser del 45% a los 12 meses frente al 28% durante los 6 últimos meses de tratamiento con otro AEE no pegilado. En la figura 2 se muestran los porcentajes de pacientes con Hb superior a 13 g/dl.
En el estudio ARCTOS (pacientes diabéticos con ERC en estadios 3 y 4), la Hb media con PegEPO cada 2 semanas fue de 11,8 g/dl y cada 4 semanas de 11,7 g/dl, comparado con 11,2 g/dl con darbepoetina. En nuestro estudio, la Hb con AEE no pegilada fue de 11,19 g/dl (intervalo: 7,2-14,8) y con PegEPO fue de 12,9 g/dl (intervalo: 6,84-15,9). La Hb media de los 6 meses anteriores al tratamiento con PegEPO respecto a los valores de Hb durante los 12 meses siguientes al inicio de PegEPO no muestra diferencias estadísticamente significativas.
En el estudio CORDATUS, 307 pacientes con ERC en estadios 3-4 fueron aleatorizados para recibir PegEPO mensual o darbepoetina alfa cada 2 o 4 semanas. El incremento de Hb fue más rápido en los pacientes del grupo de darbepoetina y más progresivo en el de PegEPO. El tiempo medio de respuesta de Hb 12 g/dl fue de 43 días para PegEPO y de 29 días para el grupo de darbepoetina alfa. Un menor número de pacientes alcanzó cifras de Hb superiores a 12 g/dl en el grupo de PegEPO (14,3%) comparado con el grupo de darbepoetina (23,1 %) (p < 0,05)11. En nuestro estudio, los valores de hemoglobina medios al inicio del tratamiento con PegEPO en los 66 pacientes sin tratamiento con AEE previo fue de 10,6 g/dl (7,2-14,4); al mes del tratamiento con PegEPO fue de 10,8 g/dl (7,3-15,9); a los 3 meses, de 11,6 g/dl (9,1-14,1), y a los 12 meses, de 11,3 g/dl (8,3-14) (p < 0,0001).
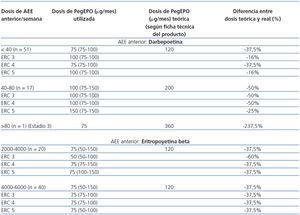
En la ficha técnica de PegEPO se establecen las dosis requeridas para el cambio de un AEE no pegilado a PegEPO. En la tabla 2 se muestran las dosis de PegEPO administradas según la dosis de AEE anterior y las dosis de PegEPO teóricas que se deberían usar según la ficha técnica para realizar el cambio de AEE no pegilada a PegEPO en nuestro grupo de pacientes; estos valores se han comparado con las dosis de PegEPO reales utilizadas. Tanto en el grupo de pacientes que recibía darbepoetina como en el de eritropoyetina beta se observan claras diferencias, con una tendencia a la utilización de dosis menores a las indicadas en la ficha técnica con un buen control de la Hb durante los 3 meses posteriores al cambio a PegEPO. Las dosis reales utilizadas fueron un 39,2% menores que la teórica (43,5% menor para el grupo de darbepoetina como tratamiento previo y un 34,5% menor para el grupo de epoetina beta) (p < 0,0001; intervalo de confianza [IC] 95% δ: –68,18 a –51,21).
Respecto al resto de las variables analizadas en nuestro estudio en los pacientes sin tratamiento previo con AEE, sólo fue significativa una disminución de la ferritina a los 3 meses, que se podría explicar por la elevada variabilidad en la tolerancia de hierro oral, ya que se mantuvieron estables los aportes.
En el caso de los pacientes con AEE previo, los valores de ferritina, transferrina y saturación de transferrina no experimentan cambios. La función renal se mantiene estable en todos los grupos.
En la figura 2 se muestra el análisis económico que compara el coste real del cambio a PegEPO y el coste teórico esperado según la dosificación teórica de PegEPO. Usando las dosis indicadas en ficha técnica, el coste mensual con PegEPO sería de 218,4 €/paciente/mes (coste real: 142,3 €/paciente/mes; p < 0,0001; IC 95% δ: –91,77 a –60,45). El coste medio por paciente y mes con PegEPO para pacientes que recibían darbepoetina y eritropoyetina beta previa sería de 268,1 y 163,98 €/paciente/mes, respectivamente (p < 0,0001 comparado con el coste real).
Nuestro estudio tiene como principal limitación la de ser un estudio retrospectivo; sin embargo, permite una valoración de la utilización y la efectividad de PegEPO en los primeros meses de la introducción de ésta, así como una medida del impacto económico producido con el cambio.
En el estudio se han utilizado dosis inferiores a las recomendadas en la ficha técnica de PegEPO y se ha conseguido un buen control de la Hb. A la vista de nuestros resultados, podríamos aconsejar disminuir las dosis iniciales de PegEPO, respecto a lo recomendado en la ficha técnica, en un 44% para pacientes en tratamiento con darbepoetina y en un 35% para pacientes en tratamiento con eritropoyetina beta. Sin embargo, dado que se trata de un estudio retrospectivo, creemos más importante recomendar el diseño de estudios específicos para determinar la dosis de PegEPO más adecuada en función de los valores de Hb o de la dosis previa de otro AEE.
CONCLUSIONES
El tiempo medio transcurrido hasta alcanzar un nivel de Hb superior a 11 g/dl para el grupo de pacientes que iniciaron PegEPO sin tratamiento previo fue de 3 meses, manteniéndose el valor medio de Hb estable hasta los 12 meses de tratamiento.
En nuestro estudio, el cambio de un AEE no pegilado a PegEPO no supuso diferencias significativas en la media de la hemoglobina alcanzada. A pesar de que el número total de pacientes que alcanzaron valores de Hb > 12 g/dl fue similar entre PegEPO y AEE no pegilado previo, el porcentaje de pacientes en la franja de valores superiores a 13 g/dl fue mayor.
Las dosis utilizadas en el cambio de AEE no pegilado a PegEPO fueron inferiores a las teóricas según las indicaciones de la ficha técnica, consiguiendo un buen control de los niveles de Hb dentro del período de 12 meses posteriores al cambio y un coste medio inferior al esperado.
Los resultados obtenidos pueden ser útiles en el manejo y la optimización del tratamiento con PegEPO.
Conflictos de interés
El Dr. A. Martínez-Castelao ha realizado colaboraciones con los laboratorios Novartis, Boëhringer, Abbott, Shire, Amgen y Roche, y es asesor de los laboratorios Abbott, Amgen y Roche.
El resto de los firmantes declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Porcentaje de pacientes con hemoglobina superior a 12 g/dl
Figura 2. Comparación del coste real del cambio a PegEPO y el coste teórico esperado según la dosificación teórica de PegEPO
Tabla 2. Dosis de PegEPO reales y teóricas según dosis de AEE anterior
Tabla 1. Valores medios de hemoglobina, filtrado glomerular, ferritina, transferrina y saturación de transferrina a 1, 3, 6 y 12 meses del inicio de PegEPO