En Argentina no se han realizado estudios destinados a establecer la prevalencia de disglucemias (glucemia alterada en ayunas [GAA], tolerancia alterada a la glucosa [TAG] y diabetes mellitus [DM]) en pacientes con enfermedad renal. Se decidió realizar un estudio observacional, evaluando la frecuencia con prueba de tolerancia oral a glucosa (PTOG) en pacientes con enfermedad renal crónica (ERC), sin registro de disglucemia en sus historias clínicas.
Se realizó PTOG a 254 pacientes (60,62% masculinos), con ERC estadios 3, 4 y 5, en tratamiento conservador, hemodiálisis o trasplante.
Los resultados mostraron pacientes con valores de DM: 10 pacientes según ayunas exclusivamente (3,94%; IC 95%: 1,35-6,53%); exclusivamente segunda hora, 11 pacientes (4,33%; IC 95%: 1,63-7,03%); por ambos criterios, 15 pacientes (5,91%; IC 95%: 2,81-9,00%); por al menos un criterio, 36 pacientes (14,17%; IC 95%: 9,69-18,66%). En análisis multivariado, la DM se asoció con valor de cintura (OR=1,033 por cm; IC 95%: 1,005-1,062; p=0,019) y con tratamiento sustitutivo vs. conservador (OR=0,41; IC 95%: 0,19-0,92; p=0,028). La GAA (criterio ADA) fue del 19,75% en tratamiento conservador vs. 9,24% en tratamiento sustitutivo, con diferencia estadísticamente significativa. No fue significativa la diferencia de TAG que evidenció 24,6 y 20,3% en tratamiento conservador y sustitutivo, respectivamente.
Se propone la realización de PTOG en todo paciente con ERC, ya que permite la detección de todo el rango de disglucemias desconocidas, evitando el subdiagnóstico y favoreciendo la realización de tratamientos para evitar su progresión, en caso de estar ante la presencia de un grupo de riesgo para DM (GAA o TAG), así como la elección de la medicación más adecuada para el trasplante o el inicio del tratamiento de nuevos casos de DM no diagnosticada, para disminuir la morbimortalidad.
In Argentina, there have been no studies aimed at establishing the prevalence of dysglycaemia (impaired fasting glucose [IFG], impaired glucose tolerance [IGT] and diabetes mellitus [DM]) in patients with chronic kidney disease (CKD). Our group decided to conduct an observational study to evaluate the frequency with oral glucose tolerance test (OGTT) in CKD patients with no previous data for dysglycaemia in their medical records.
OGTT was performed in 254 patients (60.62% male) with stage 3, 4 and 5 CKD under conservative treatment, haemodialysis or transplantation.
Results for DM were found in 10 patients according to fasting glucose alone (3.94%; 95% CI: 1.35-6.53%), 11 patients with exclusively the second hour criterion (4.33%; 95% CI: 1.63-7.03%), 15 with both criteria (5.91%; 95% CI: 2.81-9.00%) and 36 patients with at least one criteria (14.17%; 95% CI: 9.69-18.66%). In a multivariate analysis, DM was associated with waist circumference (OR=1.033 per cm; 95% CI, 1.005 to 1.062; P=.019) and with conservative treatment vs. replacement therapy (OR=0.41; 95% CI: 0.19-0.92; P=.028). IGT was evident in 24.6% and 20.3 on conservative vs. replacement therapy, with no statistically significant difference. IFG (ADA criteria) was 19.75 vs. 9.24% in conservative vs. replacement therapy, with a statistically significant difference.
OGTT is suggested for all CKD patients since it is able to detect the full range of unknown dysglycaemias, which avoids underdiagnoses and favours performing treatments to prevent progression in DM risk groups (IFG and/or IGT). It also aids in the selection of the most appropriate medication for transplantation or treatment initiation in new cases of undiagnosed DM to decrease morbidity and mortality.
En la actualidad existen numerosos trabajos en población general1 de prevención de aparición de diabetes mellitus (DM)2, así como de la DM y sus complicaciones renales, cardiovasculares o muerte prematura3. Menor interés se ha centrado en el estudio de las alteraciones metabólicas4 de los pacientes con enfermedad renal crónica (ERC) sin DM, que podrían generar la aparición de hiperglucemia.
La ERC se caracteriza por la disminución de la sensibilidad periférica a la insulina5, disminución de la secreción de misma6, modificaciones en los niveles de varias sustancias como leptina7,8, citocinas o modificaciones propias de la ERC (hiperparatiroidismo, activación del sistema renina angiotensina, anemia, déficit de vitamina D, estado inflamatorio, etc.) que favorecen la vulnerabilidad de estos pacientes a presentar hiperglucemia9 e hipoglucemia10.
En la actualidad, se observa un aumento alarmante de la incidencia de DM postrasplante o new onset diabetes mellitus after trasplant (NODAT)11,12, cuya prevalencia es del 25% en algunos estudios13. Sin embargo, existe un conocimiento parcial de la incidencia de nuevos casos de DM en los pacientes con ERC en lista de espera14, sospechándose, a partir de algunos estudios, que durante la hemodiálisis se desarrollan nuevos casos de DM (new onset diabetes mellitus after dialysis [NODAD])15. Este hecho ha sido confirmado por otros grupos que también alertaron sobre este hallazgo16 y generaron la inquietud de que se tratara de pacientes que hubieran sido subdiagnosticados en etapas anteriores por haber mejorado sus cifras glucémicas ante la instalación del burnt-out de la ERC17.
Llama la atención la falta de protocolos para su detección en estos pacientes o la validación para que los criterios empleados a la población general les sean aplicados a ellos.
Es un desafío realizar estudios para poder prevenir el desarrollo de nuevos casos de DM, identificando la presencia de las diferentes alteraciones de la glucemia, así como de otros factores de riesgo en los diferentes estadios de ERC.
En nuestro país no se han realizado hasta la fecha estudios destinados a establecer la prevalencia de disglucemia (entendiendo como tal a la glucemia alterada en ayunas [GAA], la tolerancia alterada a la glucosa [TAG] y la DM en pacientes con ERC, que no registran a la DM como causa subyacente o entidad concomitante en sus historias clínicas. Motivados por la escasez de estudios prospectivos y sospechando que su prevalencia y significado podrían diferir de los hallados en población general y en otros países, decidimos, a través del protocolo «Alteraciones metabólicas de pacientes con enfermedad renal crónica» (AMPERC) de la Sociedad Argentina de Nefrología, realizar un estudio observacional en pacientes con ERC según la clasificación propuesta por la National Kidney Foundation (NKF)3, evaluando la frecuencia de disglucemia en pacientes sin registro de DM previa en sus historias clínicas. El objetivo fue evaluar a pacientes con ERC en tratamiento conservador, hemodiálisis o trasplante y su relación con los factores de riesgo a través de la prueba de tolerancia a la glucosa (PTOG) descrita por la OMS18. Se decidió dicha valoración con esta metodología porque se consideraron observaciones previas que definían que la evaluación solo de la muestra en ayunas resultaría en un subdiagnóstico de las alteraciones de la glucemia19,20.
Materiales y métodosMuestra, criterios de inclusión y de exclusiónFueron incluidos en el estudio 254 pacientes (60,62% de ellos de sexo masculino). Los pacientes para ser incluidos en el estudio debían cumplir los siguientes criterios: edad≥18 años, pacientes con diagnóstico de ERC en tratamiento conservador, hemodiálisis o trasplante, según la NKF3, que no presentaran alteraciones conocidas diagnosticadas previamente a la glucemia, que aceptaran la PTOG, que no tuvieran ninguna contraindicación para que se les aplicara y que hubieran firmado el consentimiento informado antes de realizar cualquier procedimiento específico del estudio.
Se excluyó a pacientes con diagnóstico previo de DM, TAG, o GAA o uso de hipoglucemiantes o insulina, corticoides o anabólicos, con enfermedad concomitante severa (es decir expectativa de vida menor a 2 años), con eventos agudos en los últimos 2 meses previos (IAM, cirugía, etc.), hipotiroidismo, enfermedades hepáticas, embarazadas, lactando o que estuvieran realizando otro protocolo de investigación con intervención específica de algún medicamento y a aquellos que se negaran a realizar la prueba de sobrecarga a la glucosa.
Ingresaron al estudio pacientes consecutivos con ERC en tratamiento conservador (definida según criterios NKF) atendidos en consultorio a partir de fecha fijada para inicio del estudio. El diagnóstico de ERC debía tener una antigüedad mayor de 3 meses. Los estadios de ERC (≤60mL/min/1,73 m2) fueron evaluados a través de la fórmula MDRD 4 abreviada3.
Asimismo, fueron incluidos pacientes en tratamiento sustitutivo de hemodiálisis o trasplantados, iniciados o con una antigüedad mayor de 3 meses de la fecha fijada para el inicio del estudio, de los que se desconociera previamente enfermedad relacionada con la glucemia.
La PTOG siguió el siguiente protocolo: durante 3 días previos a la realización del estudio el paciente fue instruido a realizar una dieta irrestricta, rica en hidratos de carbono, con un mínimo de 150g/día de hidratos de carbono. La prueba se llevó a cabo con al menos 8 h de ayuno. Se indicó abstinencia de 24 h de tabaco. Cada paciente debió permanecer en reposo y no fumar durante el transcurso de la prueba. Se realizó una extracción inicial (ayunas: tiempo 0) luego de la que se le suministrara una solución de glucosa al 20% (75g de glucosa disueltos en 375ml de agua acidulada con el jugo de ¼ de limón); la solución fue ingerida en un período de 5-10 min. Desde el momento en que cada paciente finalizara la ingesta se dejaron transcurrir 120 min para realizar la segunda extracción de sangre (120 min) y el dosaje de glucosa. Fueron criterios diagnósticos para DM los siguientes: a) glucemia de ayunas mayor o igual a 126mg/dL; b) glucemia a los 120 min mayor o igual a 200mg/dL. Los puntos de corte para el diagnóstico de GAA fueron tomados en consideración siguiendo 2 directivas: a) el criterio ADA, es decir, mayor o igual a 100mg/dL o, b) el criterio seguido por la Sociedad Argentina de Diabetes21 y OMS18 es decir, mayor o igual a 110mg/dL. En ambos casos, el límite superior para esta categoría fue 126mg/dL, a partir del que los pacientes se clasificaron como DM. Un valor ubicado entre 140 y 200mg/dL a los 120 min clasificó a los pacientes como portadores de una TAG.
La etiología y antigüedad de la ERC fue cuidadosamente documentada, así como la naturaleza e inicio del tratamiento instituido (conservador, sustitutivo: hemodiálisis, trasplante renal). Fueron registrados los antecedentes personales de hipertensión arterial (según criterios del JNC), arritmias, insuficiencia cardíaca, angina de pecho o infarto de miocardio, y de las medicaciones instaladas para el tratamiento de cualquiera de estas entidades clínicas. Se registró el antecedente de hipertrofia del ventrículo izquierdo, así como el antecedente de enfermedad cerebrovascular. La historia de claudicación intermitente, lesión ulcerosa de miembros inferiores, neuropatía periférica, retinopatía, catarata, glaucoma, amputación no traumática, gota o hiperuricemia, hipercolesterolemia, hipertrigliceridemia, enfermedades inmunológicas (lupus, artritis reumatoidea, Hashimoto, otras), enfermedades neoplásicas, HIV-sida, hepatitis A, B, C o tuberculosis, enfermedad infecciosa actual, fue específicamente colectada. En las mujeres se registró el antecedente de DM gestacional. El grado de actividad física, tabaquismo o consumo de alcohol fueron registrados; la adicción a drogas fue específicamente explorada. Las medicaciones recibidas al momento del ingreso al estudio fueron asimismo registradas. Se recolectaron los antecedentes familiares de enfermedades renales, hipertensión arterial, DM, obesidad, eventos cardiovasculares en hombres<55 años y mujeres<65 años.
El día de ingreso al estudio, se recabaron los siguientes datos clínicos y paraclínicos: talla en cm, peso corporal, peso «seco» estimado en kg, cintura y cadera en cm, presión arterial (mmHg), glucemia en ayunas previa y HbA1c si estaba registrada previamente.
Asimismo, fue solicitada la evaluación de hemoglobina, recuento de leucocitos, creatininemia, uricemia, colesterol total, colesterol HDL, LDL, y triglicéridos séricos. Los valores de hormona paratiroidea intacta (PTHi) fueron también registrados.
Para la determinación del índice de masa corporal se utilizó una balanza tipo báscula o electrónica calibrada con altímetro incluido o de pared. El altímetro de pared consiste en una superficie vertical rígida con una escala en centímetros fijada a ella y una superficie horizontal móvil en ángulo recto con la anterior que deslizará libremente en sentido vertical. El plano inferior está dado por el suelo o cualquier plano de apoyo sobre él, que sea coincidente con el 0 de la escala de medición. El sujeto debe disponerse en bipedestación, de espaldas a la superficie vertical de manera tal que sus talones, nalgas y cabeza estén en contacto con ella; los talones deben permanecer juntos y los hombros relajados, para minimizar desviaciones de la columna. La cabeza debe sostenerse de forma tal que el borde inferior de la órbita esté en el mismo plano horizontal que el meato auditivo externo (plano de Frankfurt), las manos deben estar sueltas y relajadas. Se le pidió a cada paciente que hiciera una inspiración profunda, que relajara los hombros y se estirase lo más alto posible. El estiramiento minimiza la variación en estatura que ocurre durante el día y que pueda llegar hasta 2cm. Se desliza entonces una superficie horizontal hacia abajo a lo largo del plano vertical y en contacto con este, hasta que toque la cabeza del sujeto. Se efectúa entonces la lectura correspondiente en la escala (en centímetros).
Para la determinación de la circunferencia o perímetro de la cintura se empleó una cinta métrica de acero flexible calibrada en cm con grabaciones en mm, que contará con un espacio en blanco de al menos 3cm antes de la línea de registro del cero. El paciente tuvo que permanecer de pie. La medición se realizó en un plano horizontal, a una distancia intermedia entre el borde inferior de la última costilla y la cresta ilíaca. Se debió palpar y marcar cada uno de esos puntos y marcar el punto medio con una cinta métrica. Cuando los pies están juntos con los glúteos relajados nos situamos enfrente al paciente y efectuamos la medición a la altura del trocánter en coincidencia con la sínfisis pubiana (esa medida debe incluirse en cadera en centímetros).
Para la determinación de la presión arterial, todos los equipos tanto aneroides, mercuriales como electrónicos, fueron validados y debidamente calibrados. Todos los equipos utilizados en el estudio fueron controlados contra un instrumento cuya precisión y exactitud fue evaluada con anterioridad. El responsable de la medición de la presión arterial fue entrenado en la técnica estándar, y el paciente debió estar adecuadamente preparado y posicionado. Los pacientes debieron permanecer sentados y en reposo al menos 5 min en una silla, con los pies en el suelo, la espalda recostada sobre el respaldo y el brazo a nivel cardíaco. El registro se realizó al menos 30 min después de la ingesta de cafeína, el ejercicio y el consumo de tabaco. Con esfigmomanómetro aneroide y mercurial fue empleado el método auscultatorio. Debió emplearse un manguito de tamaño adecuado que abarcara al menos el 50% de la circunferencia del brazo, y el 80% de su longitud para asegurar la exactitud. La línea media del manguito inflable se ubicó sobre la arteria braquial. Se tomaron al menos 2 mediciones para calcular la media del registro. Para determinaciones manuales, se estimó la presión arterial sistólica por obliteración del pulso radial; el manguito debió inflarse 20 o 30mmHg por encima del nivel de la determinación auscultatoria en un segundo tiempo.
La velocidad de desinflado del manguito para la medida auscultatoria fue de 2mmHg/s. La presión sistólica fue establecida a partir del primero de 2 o más sonidos de Korotkoff claros (inicio de la fase 1), y la desaparición de los ruidos de Korotkoff (inicio de la fase 5) se utilizó para definir la diastólica. En el caso de que la rigidez arterial determinase ruidos soplantes hasta un valor cercano a 0, se consignó el valor correspondiente a la amortiguación de los ruidos. Para pacientes con un acceso vascular, la presión arterial se determinó en el brazo contralateral.
Análisis estadísticoLas variables cuantitativas, salvo aclaración, se describen bajo la forma de media±desvío estándar. La naturaleza de la distribución de las variables cualitativas se exploró a través del empleo del test de Shapiro-Wilk. La prueba de Chi2 se empleó a efectos de comparar entre proporciones; la comparación entre 2 grupos de datos cuantitativos de distribución normal se llevó a cabo a través del empleo del test t de Student para muestras independientes. Las diferencias entre 3 grupos de datos de distribución normal se establecieron a través del empleo de ANOVA de una vía (prueba post hoc de Scheffe). En caso de otra distribución, se empleó el test de Kruskal-Wallis. A efectos de evaluar la asociación mulivariada entre la presencia de DM y diversos covariados independientes, se empleó la regresión logística múltiple (máxima verosimilitud, quasi-Newton). Todo valor de p<0,05 fue considerado como estadísticamente significativo.
ResultadosFueron incluidos 100 mujeres y 154 varones, de edad media 59,86±17,23 años. El grupo conservador tenía 81 pacientes (46 varones), hemodiálisis 140 (87 varones) y trasplante 33 (21 varones), respectivamente.
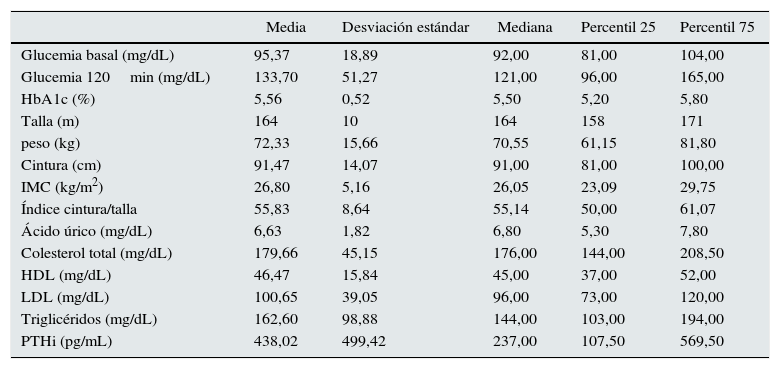
Las características antropométricas y metabólicas generales se muestran en la tabla 1.
Características antropométricas y metabólicas de la población
| Media | Desviación estándar | Mediana | Percentil 25 | Percentil 75 | |
|---|---|---|---|---|---|
| Glucemia basal (mg/dL) | 95,37 | 18,89 | 92,00 | 81,00 | 104,00 |
| Glucemia 120min (mg/dL) | 133,70 | 51,27 | 121,00 | 96,00 | 165,00 |
| HbA1c (%) | 5,56 | 0,52 | 5,50 | 5,20 | 5,80 |
| Talla (m) | 164 | 10 | 164 | 158 | 171 |
| peso (kg) | 72,33 | 15,66 | 70,55 | 61,15 | 81,80 |
| Cintura (cm) | 91,47 | 14,07 | 91,00 | 81,00 | 100,00 |
| IMC (kg/m2) | 26,80 | 5,16 | 26,05 | 23,09 | 29,75 |
| Índice cintura/talla | 55,83 | 8,64 | 55,14 | 50,00 | 61,07 |
| Ácido úrico (mg/dL) | 6,63 | 1,82 | 6,80 | 5,30 | 7,80 |
| Colesterol total (mg/dL) | 179,66 | 45,15 | 176,00 | 144,00 | 208,50 |
| HDL (mg/dL) | 46,47 | 15,84 | 45,00 | 37,00 | 52,00 |
| LDL (mg/dL) | 100,65 | 39,05 | 96,00 | 73,00 | 120,00 |
| Triglicéridos (mg/dL) | 162,60 | 98,88 | 144,00 | 103,00 | 194,00 |
| PTHi (pg/mL) | 438,02 | 499,42 | 237,00 | 107,50 | 569,50 |
HbA1c: hemoglobina glucosilada; HDL: colesterol de alta densidad; IMC: índice de masa corporal; LDL: colesterol de baja densidad; PTHi: parathormona intacta.
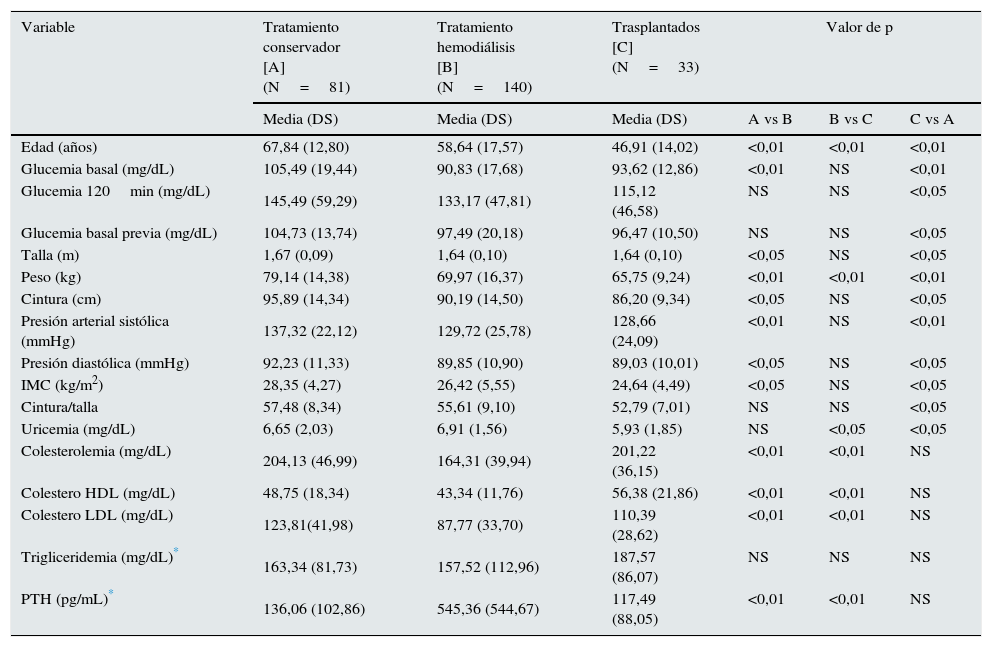
Entre los pacientes bajo tratamiento conservador, diálisis o trasplante se registraron diferencias en las variables que se exponen en la tabla 2.
Diferencias entre el tratamiento conservador, diálisis y trasplante
| Variable | Tratamiento conservador [A] (N=81) | Tratamiento hemodiálisis [B] (N=140) | Trasplantados [C] (N=33) | Valor de p | ||
|---|---|---|---|---|---|---|
| Media (DS) | Media (DS) | Media (DS) | A vs B | B vs C | C vs A | |
| Edad (años) | 67,84 (12,80) | 58,64 (17,57) | 46,91 (14,02) | <0,01 | <0,01 | <0,01 |
| Glucemia basal (mg/dL) | 105,49 (19,44) | 90,83 (17,68) | 93,62 (12,86) | <0,01 | NS | <0,01 |
| Glucemia 120min (mg/dL) | 145,49 (59,29) | 133,17 (47,81) | 115,12 (46,58) | NS | NS | <0,05 |
| Glucemia basal previa (mg/dL) | 104,73 (13,74) | 97,49 (20,18) | 96,47 (10,50) | NS | NS | <0,05 |
| Talla (m) | 1,67 (0,09) | 1,64 (0,10) | 1,64 (0,10) | <0,05 | NS | <0,05 |
| Peso (kg) | 79,14 (14,38) | 69,97 (16,37) | 65,75 (9,24) | <0,01 | <0,01 | <0,01 |
| Cintura (cm) | 95,89 (14,34) | 90,19 (14,50) | 86,20 (9,34) | <0,05 | NS | <0,05 |
| Presión arterial sistólica (mmHg) | 137,32 (22,12) | 129,72 (25,78) | 128,66 (24,09) | <0,01 | NS | <0,01 |
| Presión diastólica (mmHg) | 92,23 (11,33) | 89,85 (10,90) | 89,03 (10,01) | <0,05 | NS | <0,05 |
| IMC (kg/m2) | 28,35 (4,27) | 26,42 (5,55) | 24,64 (4,49) | <0,05 | NS | <0,05 |
| Cintura/talla | 57,48 (8,34) | 55,61 (9,10) | 52,79 (7,01) | NS | NS | <0,05 |
| Uricemia (mg/dL) | 6,65 (2,03) | 6,91 (1,56) | 5,93 (1,85) | NS | <0,05 | <0,05 |
| Colesterolemia (mg/dL) | 204,13 (46,99) | 164,31 (39,94) | 201,22 (36,15) | <0,01 | <0,01 | NS |
| Colestero HDL (mg/dL) | 48,75 (18,34) | 43,34 (11,76) | 56,38 (21,86) | <0,01 | <0,01 | NS |
| Colestero LDL (mg/dL) | 123,81(41,98) | 87,77 (33,70) | 110,39 (28,62) | <0,01 | <0,01 | NS |
| Trigliceridemia (mg/dL)* | 163,34 (81,73) | 157,52 (112,96) | 187,57 (86,07) | NS | NS | NS |
| PTH (pg/mL)* | 136,06 (102,86) | 545,36 (544,67) | 117,49 (88,05) | <0,01 | <0,01 | NS |
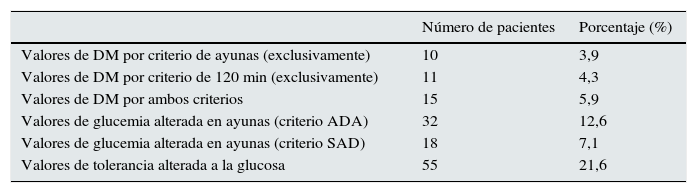
La tabla 3 muestra la prevalencia de DM y de grupo de riesgo para DM (GAA o TAG) en la muestra total.
Frecuencia de diabetes mellitus, glucemia alterada en ayunas, tolerancia alterada de la glucosa
| Número de pacientes | Porcentaje (%) | |
|---|---|---|
| Valores de DM por criterio de ayunas (exclusivamente) | 10 | 3,9 |
| Valores de DM por criterio de 120 min (exclusivamente) | 11 | 4,3 |
| Valores de DM por ambos criterios | 15 | 5,9 |
| Valores de glucemia alterada en ayunas (criterio ADA) | 32 | 12,6 |
| Valores de glucemia alterada en ayunas (criterio SAD) | 18 | 7,1 |
| Valores de tolerancia alterada a la glucosa | 55 | 21,6 |
Como puede observarse, el número de pacientes sin DM por ninguno de los criterios empleados (ayunas o segunda hora tras la carga de glucosa) fue de 218 (85,82%); con DM según criterio de ayunas exclusivamente (sin criterio de segunda hora) fue de 10 (3,94%; IC 95%: 1,35-6,53%); con DM según criterio de segunda hora exclusivamente (sin criterio de ayunas) hubo 11 pacientes (4,33%; IC 95%: 1,63-7,03%); con DM por ambos criterios hubo 15 (5,91%; IC 95%: 2,81-9,00%) y los pacientes con DM por al menos un criterio fueron 36 (14,17%; IC 95%: 9,69-18,66%).
La frecuencia de DM resultó diferente según el tipo de tratamiento. Fue más frecuente entre los tratados convencionalmente, cuando se compara con los individuos bajo tratamiento sustitutivo: 19 casos (23,45%) vs. 17 (9,82%) (p=0,001).
Asimismo, la frecuencia de GAA (criterio ADA) difirió entre tratamientos: fue de 19,75% en tratados de manera conservadora vs. 9,24% en los pacientes en tratamiento sustitutivo (p=0,02). La frecuencia de TAG fue también mayor en los tratados conservadoramente (24,6 vs. 20,23%) aunque la diferencia no resultó estadísticamente significativa (p=0,521).
En el análisis multivariado por regresión logística múltiple, la condición de DM (por cualquier criterio de los aceptados) se asoció con el valor de la circunferencia de cintura (OR=1,033 por cm; IC 95%: 1,005-1,062; p=0,019) y con el tipo de tratamiento sustitutivo vs. conservador (OR=0,41; IC 95%: 0,19-0,92; p=0,028). No mostró significación para las otras variables.
DiscusiónLos valores actuales de glucemia para diagnóstico de DM cuyo criterio se basó en la predicción de la aparición de retinopatía22 así como la GAA en población general23 han experimentado varias modificaciones en los últimos años. Este último es hasta hoy un tema en debate si consideramos que diferentes entidades como la American Diabetes Association (ADA)24 y la OMS18 sitúan el valor significativo en 100 o 110mg/dl, respectivamente. La glucemia de los 120 min de la prueba de poscarga estandarizada por la OMS18 que permite el diagnóstico de TAG o DM no ha sido modificada. Las dificultades de esta clasificación es la no concordancia entre ambos valores (ayuno o poscarga) cuando se trata de identificar a pacientes en riesgo para desarrollar DM, así como en el desarrollo de la enfermedad cardiovascular25. En el 2010, la ADA agrega para el diagnóstico de DM y los estados intermedios el uso de la hemoglobina glucosilada estandarizada26.
Existen datos de la aparición de DM en los pacientes con ERC en tratamiento conservador20, hemodiálisis15,19 y trasplante renal12. Sin embargo, en la Argentina, a pesar de conocerse que esta enfermedad se acompaña de modificaciones que podrían favorecer el desarrollo de alteraciones de la glucemia9, son escasos los estudios. En el año 2006 se publicó un trabajo19 en el que se evaluó solo a pacientes en tratamiento con hemodiálisis con PTOG, detectando nuevos casos de DM y de TAG en un 6,7 y en un 20%, respectivamente. Esta observación, junto con la discusión abierta por la falta de respuesta a si la valoración de estos pacientes debería seguir los protocolos de la población general o realizarse de otra manera para sensibilizar la detección, nos alentó a ampliar la muestra a otros estadios de ERC (conservador y trasplante).
El aporte de este trabajo es haber realizado la PTOG en forma estandarizada e incluir pacientes en 3 estadios diferentes de ERC, para detectar pacientes cuya alteración hubiera sido ignorada si solo se realizaba la muestra de glucemia en ayunas.
Los resultados obtenidos muestran un porcentaje de pacientes con valores compatibles con DM, según criterios empleados de la ADA: con ayunas exclusivamente 3,94% (IC 95%: 1,35-6,53%); con segunda hora exclusivamente 4,33% (IC 95%: 1,63-7,03%); con ambos criterios 5,91% (IC 95%: 2,81-9,00%); por al menos un criterio 14,17% (IC 95%: 9,69-18,66%), respectivamente.
Vemos que otros autores, como el estudio de Salifu MO15, también detectaron subdiagnóstico de DM luego del análisis de 59.340 datos de USRDS, detectando un 7,6% de nuevos casos de DM en hemodiálisis (NODAD), previamente desconocidos. Su seguimiento mostró un riesgo de muerte mayor en 3 años, que en los que no la desarrollaron. Los datos del Taiwan National Health Insurrance Research Database27, con un número significativo de pacientes incidentes (51.487), mostró una incidencia acumulada de nuevos casos de DM de 4% el primer año, que alcanzó el 21% a los 9 años considerando hemodiálisis y diálisis peritoneal, sin diferencias significativas entre las modalidades. Otro trabajo14, que evaluó su presencia en pacientes en lista de espera para trasplante, demostró una incidencia del 6% y, en los trasplantados, el hallazgo mostró de 18 a 30%, dependiendo en este caso de la medicación administrada. Basturk realizó PTOG en pacientes en estadio 3-4 de ERC y observó 59,3% de GAA, 59,3% de TAG y 9,7% de DM28; otro estudio realizado por Rufino20 en estadio 4 y 5 evidenció que, de los pacientes sin alteración en ayuno, un 38% mostró TAG y un 5% DM, lo que indica la necesidad de realizar la prueba para diagnosticar adecuadamente todas las alteraciones presentes en estos estadios.
Si bien la mayoría de los trabajos, igual que el nuestro, confirman el subdiagnóstico, no son comparables ya que los primeros fueron realizados a través de revisión de datos y los últimos 2 que realizaron PTOG utilizaron diferentes pautas.
La interpretación de la divergencia entre la prevalencia hallada por ayuno o glucemia poscarga podría ser la presencia de insulinorresistencia muscular periférica hallada en la uremia29, que es detectada principalmente con la realización de la PTOG30. Sabemos, además, que ambas metodologías expresan grupos de pacientes con alteraciones fisiopatológicas diferentes31–33, lo que pudiera estar presente en los diferentes subgrupos de ERC. Otro dato que apoya su realización es que el riesgo de progresión a DM, así como el cardiovascular, es mayor si ambas alteraciones (GAA y TAG) se observan simultáneamente en la población general en riesgo, lo que justifica su detección, ya que estos datos se desconocen en la población con ERC.
Cuando uno analiza según el tipo de tratamiento, los datos de la frecuencia de valores compatibles con DM resultan diferentes entre los tratados convencionalmente, comparada con los individuos bajo tratamiento sustitutivo: 19 casos (23,45%) vs. 17 (9,82%) (p=0,001). Lo mismo sucede al analizar los datos de los estadios de los grupos de riesgo para DM, donde observamos que la frecuencia de valores para glucosa alterada en ayunas (criterio ADA) difirió entre tratamientos, resultando en un 19,75% en tratados de manera conservadora vs. 9,24% en los pacientes en tratamiento sustitutivo (p=0,02). La frecuencia de TAG fue también mayor en los tratados conservadoramente (24,6 vs. 20,23%) aunque la diferencia no resultó estadísticamente significativa (p=0,521).
Estos hechos observados en nuestro trabajo podrían hallar diferentes interpretaciones. Una relacionada con que el grupo de pacientes conservadores presentaban en este caso mayor índice de masa corporal, obesidad y cintura, probablemente conformando grupos no comparables. Cabe aclarar que nuestro objetivo no ha sido comparar los grupos sino confirmar la sospecha de que en ERC hay un gran subgrupo de pacientes en los que ignoramos sus alteraciones glucémicas y, por ende, su significado.
Debemos señalar que son muy escasas las publicaciones que estudian la prevalencia o la incidencia de los valores de los grupos de riesgo de DM en ERC, destacando que la alta prevalencia observada en este estudio justifica su detección precoz. Por otro lado, considerando que la insulinorresistencia en ERC se observa aun en los pacientes sin DM y en las etapas tempranas de ERC34,35, podría interpretarse que la mayor prevalencia de alteraciones glucémicas en el grupo conservador pudiera ser atribuida de alguna manera a su presencia o podrían deberse a las modificaciones fisiopatológicas que acarrea el inicio del tratamiento sustitutivo, al mejorar la uremia y la acidosis, así como mostrar mejoría significativa en la presión, dislipidemia y menor nivel de parathormona que, como sabemos, influyen en el desarrollo de la insulinorresistencia o secreción36. Estas modificaciones podrán tener sus consecuencias sobre la disglucemia, como ha sido demostrado también por otros estudios37–39.
En el análisis multivariado por regresión logística múltiple, se observa que la condición de valores para DM (por cualquier criterio de los aceptados) se asoció con el valor de la circunferencia de cintura (OR=1,033 por cm; IC 95%: 1,005-1,062; p=0,019) y con el tipo de tratamiento (OR=0,41; IC 95%: 0,19-0,92; p=0,028). No mostró significación para las otras variables, probablemente por una de las limitaciones de este trabajo de contener un número escaso en cada subgrupo.
Las limitaciones de este estudio fueron el escaso número de pacientes en cada subgrupo, que no permitió diferenciar las alteraciones en los pacientes en los estadios 3, 4, 5 en tratamiento conservador, la realización de solo una prueba por paciente y, quizás, no haber apareado los pacientes por peso y sexo para hacer los grupos comparables entre sí.
Sin embargo, el aporte de este estudio observacional es haber tomado 3 estadios de la ERC, no hay otro trabajo en la bibliografía de estas características, y haber confirmado el subdiagnóstico de las alteraciones de los valores de glucemia intermedios (denominado por ADA en 2015 grupo de riesgo para DM) y de DM en todos los estadios.
Este trabajo permite proponer que, para detectar todas las alteraciones glucémicas en pacientes con ERC, se debería realizar la PTOG en todas las etapas de ERC y muy especialmente en los pacientes en lista de espera para trasplante. Además, permite proponer la necesidad de protocolizar esta metodología en este grupo de pacientes, dado que, igual que otros trabajos como el de Rufino20, si no se hubiera realizado la PTOG, muchos pacientes desconocerían la presencia de disglucemia. Se debe destacar que la OMS18 también propone realizar preferentemente la PTOG en población general y la ADA26 la indica en forma opcional con la HbA1c o glucemia de ayuno.
Esta alternativa permite, no solo la detección precoz de disglucemias, sino realizar tratamientos preventivos para evitar su progresión en caso de los grupos de riesgo para DM a DM, así como la determinación de la medicación más adecuada durante el trasplante o la posibilidad del inicio precoz del acceso al tratamiento de los nuevos casos de DM previamente ignorados para disminuir el aumento de la morbimortalidad.
Conflicto de interesesLos autores no presentan conflictos financieros de interés.
Agradecemos a los miembros del Grupo de Metabolismo de la Sociedad de Nefrología Argentina, al que pertenecemos, por la colaboración en este trabajo.