El infarto renal agudo (INRA) es una patología de diagnóstico infrecuente, cuya incidencia real es probablemente superior a la detectada, y que asocia una evolución desfavorable en un alto porcentaje de casos.
ObjetivosDescribir las principales características clínicas, bioquímicas y radiológicas, y determinar qué factores se asocian a una peor evolución (muerte o deterioro permanente de la función renal).
Material y métodosEstudio retrospectivo y observacional, que incluyó a todos los pacientes diagnosticados de INRA mediante TAC con contraste en un único hospital durante 18 años. Los pacientes fueron clasificados según el origen cardiogénico o no cardiogénico del INRA. Se analizaron las principales características clínicas, bioquímicas y radiológicas, y, mediante un modelo de regresión logística multivariante, se determinaron los factores asociados a una peor evolución.
ResultadosSe incluyeron 62 casos, de los que 30 fueron de origen cardiogénico. Los 32 pacientes con INRA no cardiogénico eran más jóvenes, con menos comorbilidad y menor frecuencia de tratamiento previo con anticoagulación. La extensión media de daño isquémico por radiología fue del 35%, sin observarse diferencias entre los subgrupos etiológicos. El 38% de los pacientes tuvo una evolución desfavorable, y los principales determinantes fueron: la función renal al diagnóstico (eGFR) (OR=0,949; IC 95%: 0,918-0,980; p=0,002) y la anticoagulación oral antes del episodio agudo (OR=0,135; IC 95%: 0,032-0,565; p=0,006).
ConclusionesEl INRA es una patología infrecuente, con manifestaciones clínicas poco específicas y, en más de la mitad de los casos, no asociada a enfermedad cardiaca o arritmias. Una alta proporción de pacientes evoluciona desfavorablemente. La función renal al diagnóstico es uno de los principales factores pronósticos.
Acute renal infarction (ARI) is an uncommon disease, whose real incidence is probably higher than expected. It is associated with poor prognosis in a high percentage of cases.
ObjectivesTo describe the main clinical, biochemical and radiologic features and to determine which factors are associated with poor prognosis (death or permanent renal injury).
Materials and methodsThe following is a retrospective, observational, single-hospital-based study. All patients diagnosed with ARI by contrast-enhanced computed tomography (CT) over an 18-year period were included. Patients were classified according to the cardiac or non-cardiac origin of their disease. Clinical, biochemical and radiologic features were analysed, and multiple logistic regression model was used to determine factors associated with poor prognosis.
ResultsA total of 62 patients were included, 30 of which had a cardiac origin. Other 32 patients with non-cardiac ARI were younger, had less comorbidity, and were less frequently treated with oral anticoagulants. CT scans estimated mean injury extension at 35%, with no differences observed between groups. A total of 38% of patients had an unfavourable outcome, and the main determinants were: Initial renal function (OR=0.949; IC 95% 0.918-0.980; p=0.002), and previous treatment with oral anticoagulants (OR=0.135; IC 95% 0.032-0.565; p=0.006).
ConclusionsARI is a rare pathology with non-specific symptoms, and it is not associated with cardiological disease or arrhythmias in more than half of cases. A substantial proportion of patients have unfavourable outcomes, and the initial renal function is one of the main prognostic factors.
El infarto renal agudo (INRA) es el daño isquémico del parénquima renal como consecuencia de la interrupción repentina de su flujo sanguíneo. Se trata de una causa poco frecuente de fracaso renal agudo, con una incidencia en las series publicadas que oscila entre 0,007 y 1,4%1,2. Sin embargo, es probable que su incidencia reconocida sea menor a la real debido a las dificultades diagnósticas.
La forma de presentación clínica habitual suele ser la de un dolor abdominal difuso o lumbar de aparición repentina, junto con cortejo vegetativo, de difícil control analgésico y, en ocasiones, asociado a fiebre. Todo este conjunto de síntomas inespecíficos puede fácilmente ser confundido con otras enfermedades más comunes, como son la urolitiasis, pielonefritis o enfermedad gastrointestinal3.
Las causas más frecuentes de INRA son: el embolismo renal, cuyo origen más habitual es el cardiaco y el desencadenante más común la fibrilación auricular, y la trombosis de las arterias principales renales debido a lesión en el transcurso de procedimientos diagnóstico-terapéuticos o traumáticos. Otras causas no infrecuentes son la disección de arteria renal o la displasia fibromuscular, y la trombosis espontánea asociada a estados de hipercoagulabilidad. No obstante, hay entre un 29 y un 59% de todos los casos en los que no es posible determinar el origen del INRA4–8.
El tratamiento precoz con anticoagulantes o fibrinolíticos puede revertir la isquemia y mejorar el pronóstico funcional renal9,10. Desgraciadamente es muy frecuente la demora diagnóstica, por lo que es importante incluir siempre esta patología en el diagnóstico diferencial de pacientes con la sintomatología antes descrita.
En este estudio se presenta una serie de 62 pacientes con INRA en riñones nativos (excluidos trasplantados) diagnosticados en el Hospital Ramón y Cajal en un periodo de 18 años. Los objetivos del estudio fueron describir las principales características clínicas, bioquímicas y radiológicas de esta enfermedad, analizar las diferencias según la etiología, y determinar qué factores se asociaban a una peor evolución (muerte o deterioro permanente de la función renal).
Material y métodosSe realizó una búsqueda de pacientes diagnosticados por métodos radiológicos de INRA durante el periodo comprendido entre enero de 1996 y diciembre de 2014. Se excluyó a los pacientes con riñón trasplantado.
De la historia clínica se recogieron las características basales, incluyendo los datos demográficos, el índice de comorbilidad (Charlson), los factores de riesgo cardiovascular (antecedentes de hipertensión, diabetes mellitus, dislipidemia, tabaquismo, cardiopatía isquémica, arritmias, trombofilias y embolismos previos), los antecedentes de enfermedad renal crónica y tratamiento previo con antiagregantes plaquetarios o anticoagulación oral.
El diagnóstico de INRA se realizó mediante tomografía computarizada (TC) axial o helicoidal según el periodo de estudio y con administración de contraste intravenoso.
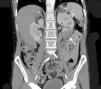
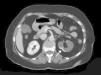
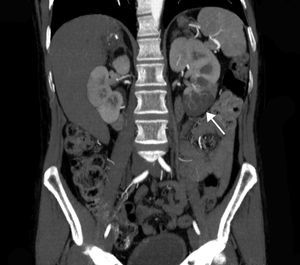
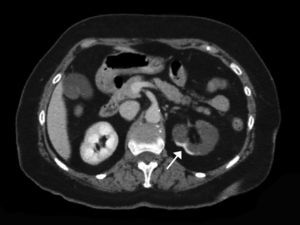
La extensión del daño isquémico se estimó en cada paciente considerando el total de la masa renal como un conjunto formado por 6 partes, de tal forma que un INRA polar y sin alteraciones en el resto del riñón y del contralateral, se consideró una extensión de daño del 1/6 (17%) (figs. 1 y 2). Así, todos los pacientes tuvieron una estimación de extensión de daño que podía oscilar entre 1/6 (17%) y 6/6 (100%).
Corte transversal de TC con contraste mostrando hallazgos compatibles con infarto renal con afectación de la práctica totalidad del riñón izquierdo. Se aprecia un área de hipercaptación cortical marginal (cortical rim sign) (flecha). La extensión de daño en este caso sería de 3/6 (50% del total del parénquima renal).
Se recogieron datos analíticos basales: parámetros hematológicos (hemoglobina, leucocitos totales, neutrófilos y plaquetas), y bioquímicos como la creatinina sérica, lactato deshidrogenasa (LDH) y proteína C reactiva (PCR). La función renal se estimó mediante el cálculo del filtrado glomerular (eGFR) por la fórmula MDRD-411, y se consideró deterioro de función renal la existencia de eGFR<60ml/min/1,73 m2 en el momento del diagnóstico o durante la primera semana de evolución, en los pacientes que no tenían antecedente de enfermedad renal previa. Todos los métodos de laboratorio fueron los convencionales, aunque con las diferencias metodológicas propias de los distintos periodos en los se produjeron los eventos de estudio.
Los pacientes fueron divididos en 2 subgrupos según la causa de INRA fuera de origen cardiaco o no cardiaco, y se compararon las características de estos subgrupos.
La censura de datos evolutivos se realizó 6 meses después del episodio inicial de INRA. Los criterios para considerar la evolución como no favorable fueron el fallecimiento por cualquier causa o la no recuperación de la función renal parcial o total antes de los 6 meses. Se consideró recuperación parcial cuando el paciente presentó una insuficiencia renal (eGFR <60ml/min/1,73 m2), o eGFR inferior al conocido antes del episodio de INRA en los casos de pacientes en los que ya se conocía la existencia de una insuficiencia renal.
Diseño del estudio y análisis estadísticoEste estudio es retrospectivo y de observación, y describe las características clínicas y bioquímicas de los pacientes diagnosticado de INRA.
Para la comparación de 2 variables continuas independientes se utilizó el test t de Student para muestras no apareadas, o el test no paramétrico de Mann-Whitney según las necesidades por las características de distribución de las variables. Para la comparación de variables discretas se utilizó el test chi-cuadrado con corrección continua.
Para establecer los determinantes clínicos asociados a una evolución no favorable del episodio de infarto agudo renal se utilizó un modelo de regresión logística multivariante, en el que se introdujeron las siguientes variables independientes: edad, sexo, índice de comorbilidad, días de evolución desde la aparición de síntomas hasta el inicio del tratamiento, origen etiológico (cardiogénico o no), filtrado glomerular al diagnóstico, leucocitos totales, LDH, antiagregantes plaquetarios y anticoagulación oral previa al episodio agudo.
Para evitar colinealidad no se introdujeron en el modelo ni el recuento de neutrófilos, ni la extensión del daño renal por radiología (ver apartado de Resultados). Para evitar sobreajuste se forzó la entrada de variables en el modelo multivariante con una significación de al menos p<0,01. La elección de las variables en el modelo multivariante se realizó de forma automática mediante el proceso de inclusión progresiva condicional (hacia adelante).
Los datos se presentan como media y desviación estándar (±DE), o como mediana y rangos intercuartiles o valor mínimo-máximo. Una p<0,05 fue considerada como estadísticamente significativa.
El análisis estadístico se realizó con el programa IBM SPSS versión 21.
ResultadosCaracterísticas demográficas y clínicas de los pacientes con INRAEn el periodo de estudio se identificó a 62 pacientes con el diagnóstico de INRA en riñones nativos. Las características demográficas y clínicas se muestran en la tabla 1.
Características demográficas y clínicas del total de pacientes y según subgrupos etiológicos
| % | Total | Causa cardiogénica | Causa no cardiogénica | p* |
|---|---|---|---|---|
| Número | 62 | 30 (48) | 32 (52) | |
| Edad en años | 67±16 | 77±11 | 58±14 | <0,0001 |
| Sexo, hombres | 48 | 43 | 53 | 0,441 |
| Índice de Charlsona | 5 [2,75–7] | 6 [4–7] | 3 [1–5,75] | 0,005 |
| Hipertensión arterial | 69 | 83 | 56 | 0,042 |
| Diabetes mellitus | 22 | 30 | 16 | 0,2900 |
| Dislipidemia | 32 | 50 | 16 | 0,009 |
| Tabaquismo | 23 | 13 | 31 | 0,167 |
| Cardiopatía isquémica | 23 | 40 | 6 | 0,004 |
| Antecedentes de arritmias | 37 | 70 | 6 | <0,0001 |
| Antecedentes de embolias | 21 | 20 | 22 | 1,000 |
| Antecedentes de enfermedad renal crónica | 11 | 17 | 6 | 0,3700 |
| Tratamiento previo con antiagregantes | 32 | 28 | 37 | 0,6500 |
| Tratamiento previo con anticoagulantes | 32 | 53 | 13 | 0,002 |
| Dolor abdominal | 97 | 100 | 94 | 0,501 |
| Dolor flanco | 90 | 93 | 88 | 0,729 |
| Náuseas | 60 | 60 | 59 | 1,000 |
| Vómitos | 34 | 37 | 31 | 0,856 |
| Fiebre | 23 | 20 | 25 | 0,868 |
| Días de evoluciónb | 1 [<1–10] | 1,5 [1–6] | 1 [<1–10] | 0,651 |
| Tensión arterial sistólica al diagnóstico en mmHg | 149±32 | 153±27 | 145±37 | 0,296 |
| Tensión arterial diastólica al diagnóstico en mmHg | 77±18 | 79±16 | 76±20 | 0,465 |
| Frecuencia cardiaca al diagnóstico en lpm | 80±19 | 82±18 | 77±19 | 0,305 |
| Creatinina sérica basal en mg/dl | 1,44±0,71 | 1,63±0,76 | 1,26±0,60 | 0,035 |
| eGFR en ml/min/173 m2 | 51,1±22,1 | 41,5±17,4 | 60,1±22,5 | 0,001 |
| Leucocitos totales en sangre por mm3 | 13.035±5.051 | 12.543±3.558 | 13.497±6.157 | 0,462 |
| Neutrófilos por mm3 | 10.334±5.107 | 9.754±3.727 | 10.879±6.140 | 0,391 |
| LDH U/l | 841±486 | 999±531 | 693±392 | 0,012 |
| Proteína C reactivaa en mg/l | 76 [32–206]a | 127 [48–220]c | 72 [29–132]d | 0,287 |
| Extensión del daño renal por TC | 35±17 | 36±16 | 34±19 | 0,607 |
El número de casos diagnosticados de INRA siguió una tendencia creciente en los sucesivos años del periodo estudiado. Analizando la incidencia de INRA por periodos de 4 años, la gran mayoría (48 casos) se diagnosticaron en los últimos 8 años.
En 30 pacientes (48%) se consideró que la causa del INRA era embolígena de origen cardiaco. La fibrilación auricular fue la única arritmia asociada, siendo el INRA la primera manifestación clínica de esta arritmia en el 48% de los casos, y en el resto de los pacientes el factor precipitante de la formación del émbolo fue probablemente el mal control de la anticoagulación. No hubo ningún caso de endocarditis.
Las patologías relacionadas con el origen de los 32 casos (52%) de INRA no cardiogénico fueron: daño o lesión de las arterias renales provocados por disección aórtica y renal (6 casos), tras cirugía abdominal (4 casos), panarteritis nodosa (un caso), estenosis-trombosis de arteria renal (3 casos), trombofilias (un caso de policitemia y 7 casos de alteraciones hereditarias de la coagulación), shock séptico (un caso), neoplasias (5 casos) y de origen indeterminado (4 casos).
Los pacientes con INRA de origen no cardiogénico fueron más jóvenes, con menos comorbilidad y también menos antecedentes de factores de riesgo cardiovascular que los pacientes con INRA cardiogénico (tabla 1). Un 53% de los pacientes con INRA cardiogénico ya estaban en tratamiento con anticoagulación oral frente a tan solo un 13% de los pacientes con INRA no cardiogénico. La anticoagulación era exclusivamente con acenocumarol. No se observaron diferencias en cuanto a los porcentajes de tratamiento con antiagregantes plaquetarios.
El 95% de los pacientes con INRA cardiogénico que tomaban anticoagulación oral se encontraban con INR por debajo del rango terapéutico en el momento del diagnóstico. Tan solo un paciente con INRA cardiogénico presentaba INR dentro de rango terapéutico al diagnóstico, aunque los síntomas se habían iniciado 72 h antes.
El 87% de los casos fue diagnosticado en el Servicio de Urgencias, y el resto en pacientes hospitalizados (Medicina Interna, Cirugía), sin observarse diferencias significativas en el tiempo de demora diagnóstica en los hospitalizados con respecto a los diagnosticados en Urgencias.
Las manifestaciones clínicas más frecuentes fueron el dolor abdominal, dolor de flanco y náuseas (tabla 1). Los vómitos y fiebre fueron manifestaciones menos frecuentes. No se observaron diferencias en las manifestaciones clínicas generales de los pacientes con INRA cardiogénico o no cardiogénico (tabla 1). Tampoco hubo diferencias entre los subgrupos en el tiempo de demora hasta el diagnóstico, que osciló desde menos de 2 h hasta 10 días, con una mediana de 1-1,5 días.
En 35 pacientes (65%) que no tenían antecedente de enfermedad renal previa, se observó un deterioro de función renal en el momento del diagnóstico. La función renal (eGFR) al inicio del episodio fue significativamente más baja y las concentraciones de LDH séricas más elevadas en los pacientes con INRA cardiogénico (tabla 1). Sin embargo, no se observaron diferencias entre subgrupos en el recuento de leucocitos, neutrófilos ni de proteína C reactiva.
La extensión media de daño isquémico estimada por TC fue del 35% (2/6 del parénquima renal total), con hallazgos de hipoperfusión periférica en forma de cuña en el 70% de los casos, afectación global en el 21% y multifocal en el 9%. Ningún paciente era monorreno ni tenía atrofia renal previamente descrita. No se observaron diferencias entre subgrupos (tabla 1), ni afectación predominante de riñón derecho o izquierdo.
Esta estimación radiológica del daño isquémico se correlacionó significativamente de forma inversa y lineal con el eGFR (R=−0,39; p=0,001).
Una vez establecido el diagnóstico de INRA, se inició anticoagulación con heparina sódica intravenosa (con el objetivo de mantener el tiempo de tromboplastina activada de 1,5-2 veces el normal), con posterior secuenciación a anticoagulación oral (acenocumarol para conseguir INR entre 2-2,5). Tan solo en 4 pacientes se realizó fibrinólisis local con perfusión de urocinasa (dosis inicial de 200.000 UI y posterior perfusión de 100.000 UI/h durante 6 h). El empleo de la fibrinólisis estuvo condicionado por la experiencia del equipo médico tratante, considerando los riesgos asociados, y en especial que el INRA se hubiera producido en menos de 24 h. De ellos, 3 pacientes fueron tratados con éxito, con recuperación completa de función renal. El cuarto paciente presentó hemorragia digestiva alta que obligó a la suspensión del tratamiento. Ningún paciente fue tratado mediante revascularización quirúrgica.
Determinantes de una evolución no favorableEn 24 pacientes (39%) se observó una evolución no favorable del INRA: 8 pacientes fallecidos, 5 insuficiencias renales terminales y 14 insuficiencias renales recuperadas parcialmente a los 6 meses (3 pacientes fallecieron además de desarrollar insuficiencia renal).
En 9 pacientes (15%) se produjeron embolismos extrarrenales (ictus isquémico, isquemia mesentérica, embolismos en miembros inferiores), sin encontrarse diferencias entre subgrupos.
En la tabla 2 se muestran las diferencias entre los que presentaron una evolución combinada favorable y desfavorable. No hubo diferencias demográficas ni en el índice de comorbilidad, ni en los días de evolución hasta el diagnóstico. Los pacientes con una peor evolución tenían una función renal inicial más baja, un recuento de leucocitos y neutrófilos en sangre significativamente más elevados, y unas concentraciones de LDH y proteína C reactiva más elevadas que los pacientes con mejor evolución, aunque las diferencias de estos 2 últimos parámetros no alcanzaron la significación estadística.
Características clínicas, bioquímicas y radiológicas en los pacientes con evolución favorable o no favorable combinada (muerte o deterioro función renal parcial o total a los 6 meses del infarto)
| Favorable | No favorable | p* | |
|---|---|---|---|
| Pacientes, (%) | 38 (61) | 24 (39) | |
| Edad, años | 65±18 | 70±12 | 0,205 |
| Sexo, % hombres | 45 | 54 | 0,469 |
| Índice de Charlson | 5 [1,75–7] | 5 [3,4,5,6,7] | 0,337 |
| Origen cardiogénico/no cardiogénico | 19/19 | 11/13 | 0,749 |
| Días de evolución hasta el diagnósticoa | 2 [1,2,25] | 1 [1,2] | 0,358 |
| Creatinina sérica al inicio, mg/dl | 1,21±0,42 | 1,79±0,91 | 0,001 |
| eGFR inicial, ml/min/1,73 m2 | 57,4±19,8 | 41,0±22,2 | 0,004 |
| Leucocitos totales en sangre, por mm3 | 11.964±3.770 | 14.730±6.317 | 0,035 |
| Neutrófilos en sangre, por mm3 | 9.058±3.892 | 12.356±6.152 | 0,012 |
| LDH, U/l | 772±460 | 951±515 | 0,159 |
| Proteína C reactivaa, mg/l | 73 [25–146]b | 155 [73–226]c | 0,070 |
| Estimación radiológica extensión del daño, % | 30±12 | 43±19 | 0,003 |
| Antiagregación previa, % | 34 | 29 | 0,679 |
| Anticoagulación oral previa, % | 42 | 17 | 0,071 |
La extensión del daño isquémico por TC fue significativamente mayor en los pacientes que presentaron una peor evolución.
Una observación también destacable fue la mayor frecuencia de anticoagulación oral previa en los INRA con buena evolución.
En la tabla 3 se muestra el grado de asociación de cada una de las variables estudiadas con la mala evolución combinada. En esta misma tabla también se muestran las variables que entraron a formar parte del mejor modelo multivariante predictivo de mala evolución combinada.
Regresión logística uni- y multivariante de una evolución desfavorable combinada (muerte o deterioro permanente de función renal) asociada al infarto renal agudo
| Univariable | Multivariante* | |||
|---|---|---|---|---|
| Variable | OR (IC 95%) | p | OR (IC 95%) | p |
| Edad, años | 0,955 (0,886–1,030) | 0,233 | ||
| Sexo (hombre) | 1,004 (0,207–4,883) | 0,996 | ||
| Comorbilidad, índice de Charlson | 1,592 (1,036–2,447) | 0,034 | ||
| Antiagregación (hombre) | 0,412 (0,086–1,972) | 0,412 | ||
| Anticoagulación (hombre) | 0,054 (0,008–0,371) | 0,003 | 0,135 (0,032–0,565) | 0,006 |
| Días de demora diagnóstica, por día | 1,188 (0,766–1,843) | 0,442 | ||
| Filtrado glomerular, por ml/min/1,73 m2 | 0,927 (0,881–0,975) | 0,003 | 0,949 (0,918–0,980) | 0,002 |
| LDH, por UI/ml | 1,000 (0,998–1,002) | 0,980 | ||
| Recuento total de leucocitos (por 1.000/mm3) | 1,237 (1,028–1,489) | 0,024 | ||
El análisis por separado de los determinantes de fallecimiento antes de los 6 meses (8 casos) mostró al índice de comorbilidad como la única variable asociada significativamente con este evento (OR=1,60; IC 95%: 1,07-2,41; p=0,023).
El análisis por separado de los determinantes de deterioro persistente de la función renal a los 6 meses sin tener en cuenta la mortalidad fueron: el filtrado glomerular inicial (OR=0,804; IC 95%: 0,695-0,930; p=0,003) y la prescripción de anticoagulación antes del evento (OR=0,037; IC 95%: 0,002-0,803; p=0,036).
DiscusiónLos resultados de este estudio muestran que el INRA es una dolencia de diagnóstico infrecuente, con manifestaciones clínicas poco específicas y asociada habitualmente con procesos comórbidos (cardiopatías, arritmias, etc.), que eventualmente ayudan a sospechar su diagnóstico, aunque es importante señalar que más de la mitad de los pacientes estudiados, sobre todo los más jóvenes, no presentaban patología cardiaca asociada.
Aproximadamente un 40% de los pacientes tuvo una evolución desfavorable en cuanto a supervivencia o deterioro renal establecido, y los principales determinantes de esta peor evolución fueron la función renal al diagnóstico y la ausencia de tratamiento con anticoagulantes orales antes del episodio agudo.
Este estudio recoge una de las series más numerosas de casos publicados de INRA en un único centro hospitalario. Teniendo en cuenta que la población dependiente de la atención del Hospital Ramón y Cajal es de unos 600.000 habitantes, se puede estimar que la incidencia aproximada de INRA fue de 5,7 casos por millón de habitantes-año. Esta cifra es probablemente inferior a la incidencia real de esta enfermedad, sobre todo si se tiene en cuenta el envejecimiento de la población y la alta prevalencia de enfermedad cardiovascular que se atiende en nuestro hospital, además de la posibilidad de casos inadvertidos por desarrollo poco sintomático de INRA2. No es posible determinar si la incidencia creciente de INRA observada en el periodo de estudio es resultado de una mayor destreza clínica o debida a un aumento real de casos.
En nuestra serie, el origen más frecuente de INRA fue el cardioembólico, en relación con fibrilación auricular. Estos hallazgos difieren de los comunicados por otros autores, en los que la etiología más frecuente fue la trombótica por daño en la arteria renal4,5.
En tan solo 4 casos no se logró determinar la causa del INRA tras estudios diagnósticos exhaustivos12,13. Esta patología requiere un alto índice de sospecha ante cuadros de dolor abdominal de predominio en flanco, especialmente en pacientes con factores de riesgo cardiovascular o en riesgo de poder padecer algún evento trombótico6,14.
El deterioro de función renal en el contexto del INRA es fundamentalmente debido a la hipoperfusión renal, aunque la clínica asociada (vómitos, disminución de la ingesta), o el empleo de contrastes intravenosos pueden contribuir a dicho deterioro. La determinación de LDH ha demostrado ser de gran utilidad en el diagnóstico: se incrementa en las primeras 24 h y puede permanecer elevada hasta 2 semanas después6,9,15.
En ocasiones la orina puede aportar indicios sobre el diagnóstico de INRA. Se ha descrito que, cuando se produce una obstrucción bilateral de las arterias renales, las concentraciones urinarias de sodio, creatinina y urea son similares a las plasmáticas16. Por otra parte, los niveles de LDH medidos en orina pueden estar más elevados respecto a los plasmáticos cuando el origen de la isquemia es renal15. En este estudio no fue posible disponer de la analítica de orina en muchos pacientes, ni determinar el porcentaje de pacientes que presentó oliguria o hematuria. Por este motivo, la orina no fue incluida como dato de estudio.
El diagnóstico firme de INRA requiere una prueba de imagen. Existe controversia en la literatura sobre la técnica de imagen de elección para un diagnóstico correcto, aunque en la mayoría de las series se empleó la TC abdominal con contraste4,6,7,9,17,18.
La TC con contraste muestra defectos de perfusión, acompañados en ocasiones de áreas de hipercaptación marginal cortical (cortical rim sign), que se corresponden con el flujo que aportan las arterias colaterales19 (fig. 2). Si debido a un bajo índice de sospecha o contraindicación no se emplea contraste intravenoso, esta dolencia puede pasar inadvertida20.
Por otra parte, la arteriografía es una prueba de confirmación diagnóstica y que aporta, además, la localización y extensión más exacta de la oclusión arterial. Sin embargo, presenta mayores riesgos como la nefrotoxicidad asociada a la mayor exposición de contraste radiológico, ateroembolismo, o roturas arteriales13. Otras técnicas alternativas son el renograma isotópico o la ecodoppler renal. De esta última cabe señalar que, aunque es accesible e inocua, no ha demostrado ser suficientemente sensible9. La ecografía con contraste parece mejorar los resultados, aunque es necesaria una más amplia experiencia para su validación como prueba diagnóstica efectiva21.
En este estudio, todos los casos fueron diagnosticados mediante TC con contraste. La extensión media del daño isquémico fue similar tanto en los INRA de origen cardiogénico como en los de origen no cardiogénico, con hallazgos similares a los descritos en otras series20.
Los posibles tratamientos incluyen la anticoagulación sistémica, la fibrinólisis y la cirugía abierta, aunque el recurso a esta última es excepcional. La fibrinólisis parece una buena alternativa, aunque es preciso valorar el tiempo de evolución y la comorbilidad del paciente22,23.
La anticoagulación sistémica es el procedimiento estándar, sobre todo cuando existe una causa cardiológica subyacente. En nuestra serie, tan solo 4 pacientes fueron tratados mediante fibrinólisis local con urocinasa. En estos casos el diagnóstico de INRA se había hecho durante una estancia hospitalaria por otro motivo, con una demora diagnóstica de tan solo pocas horas.
Un hallazgo destacable fue la mejor evolución en los pacientes que estaban con tratamiento anticoagulante oral previo al INRA, aunque los tiempos de protrombina no estuvieran en rangos de anticoagulación óptimos. Algunas especulaciones para justificar este hallazgo podrían ser: una más fuerte sospecha diagnóstica de INRA, menor tamaño de los trombos formados, y mayor facilidad y rapidez para alcanzar una anticoagulación efectiva.
El 30% de los pacientes diagnosticados de INRA en nuestra serie mostraban un deterioro permanente de la función renal (ERC) 6 meses después del evento inicial, siendo estos datos semejantes a los registrados en otros estudios9,24. Se ha descrito que la elevación de creatinina al ingreso son parámetros predictores de desarrollo de ERC24. Otra secuela posterior que puede aparecer con frecuencia es la hipertensión arterial refractaria al tratamiento25.
La mortalidad global de los pacientes estudiados fue del 13%, aunque probablemente el INRA se pueda interpretar, no tanto como un desencadenante de la muerte, sino como un epifenómeno dentro de la situación de gravedad en la que se encontraban los pacientes (cáncer en estadio avanzado, sepsis o disección aórtica severa)5. La presencia de embolismos extrarrenales condicionaron un aumento de la morbimortalidad y de la estancia hospitalaria. En otros estudios se ha descrito el fallecimiento de pacientes tras el alta hospitalaria en relación con daño isquémico sobre otros órganos vitales18, lo que demuestra la importancia de un adecuado control de los factores embolígenos o de la causa desencadenante del INRA para reducir la mortalidad asociada5.
Este estudio tiene limitaciones. Se trata de un estudio retrospectivo en un único centro hospitalario, en el que no fue posible recoger todas las variables en todos los pacientes. Además, el diagnóstico y seguimiento no fue realizado por un único equipo médico, por lo que el manejo no fue uniforme ni protocolizado. La estimación del daño de extensión isquémico por TC no se realizó con métodos de alta precisión (estimación aproximada), aunque es reseñable la significativa correlación con la función renal basal.
En conclusión, aunque el INRA es una enfermedad de diagnóstico infrecuente, siempre debe ser tenida en cuenta ante determinadas manifestaciones clínicas y peculiaridades bioquímicas, incluso en pacientes sin cardiopatías ni arritmias. El daño renal permanente parcial o total es una complicación frecuente, y un tratamiento precoz podría ayudar a disminuir la extensión y gravedad del daño isquémico renal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecimiento al Servicio de Radiología del Hospital Ramón y Cajal.