En la actualidad se ha evidenciado el rol de la composición dietética en el equilibrio ácido-base, al proveer precursores ácidos y álcalis. De manera general, los alimentos altos en proteína, como la carne, los quesos, huevo, entre otros, incrementan la producción de ácidos en el organismo, mientras que las frutas y los vegetales incrementan los álcalis. La capacidad que tiene un alimento para producir precursores ácidos o bases se denomina carga ácida potencial renal (PRAL). Dietas con PRAL elevados ocasionan un estado de acidosis metabólica de bajo grado, el cual se ha asociado con el desarrollo de alteraciones metabólicas como resistencia a la insulina, diabetes, hipertensión, enfermedad renal crónica, alteraciones óseas y baja musculatura, entre otras complicaciones. El objetivo del presente trabajo es realizar una revisión de la evidencia disponible a la fecha que evalúa la asociación entre el PRAL de la dieta con la incidencia de enfermedades crónicas y alteraciones metabólicas, mencionando los mecanismos involucrados en su desarrollo.
Diet composition has long been known to influence acid-base balance by providing acid or base precursors. In general, foods rich in protein, such as meat, cheese, eggs, and others, increase the production of acid in the body, whereas fruit and vegetables increase alkalis. The capacity of acid or base production of any food is called potential renal acid load (PRAL). Diets high in PRAL induce a low-grade metabolic acidosis state, which is associated with the development of metabolic alterations such as insulin resistance, diabetes, hypertension, chronic kidney disease, bone disorders, low muscle mass and other complications. The aim of this paper is to review the available evidence which evaluates the association of the PRAL of the diet with the incidence of chronic diseases and metabolic disorders, as well as related mechanisms involved in their development.
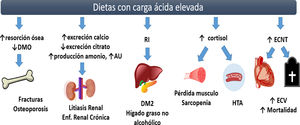
En la actualidad, las enfermedades crónicas no transmisibles (ECNT) representan un problema de salud pública al ser las responsables del 70% de las muertes en los países en desarrollo. Las principales ECNT son la enfermedad cardiovascular, cáncer, enfermedades respiratorias crónicas y diabetes1. De forma histórica se ha reportado una asociación entre el patrón de alimentación y el desarrollo o progresión de alteraciones metabólicas y ECNT2. Uno de los aspectos estudiados en los últimos años es el impacto del perfil de micronutrimentos en el mantenimiento del equilibrio ácido base, describiéndose el impacto deletéreo de la acidosis metabólica (AM) en el estado de salud. El objetivo de la presente revisión es analizar la evidencia disponible de la carga ácida de la dieta en distintas condiciones clínicas (fig. 1).
Ilustración 1. Complicaciones de las dietas con carga ácida elevada.
El consumo crónico de dietas con carga ácida elevada favorece el desarrollo de AM de bajo grado, la cual se vincula con la presencia de alteraciones metabólicas como disminución en la densidad mineral ósea y osteoporosis por activación de los osteoclastos. En los riñones, incrementa la excreción de calcio y la reabsorción de citrato en los túbulos renales, presentándose un mayor riesgo de desarrollar litos renales, además de elevar la excreción de amonio y disminuir la de AU, incidiendo en el desarrollo y progresión de la enfermedad renal crónica. La acidosis metabólica de bajo grado ocasiona hipercortisolismo, lo cual disminuye la sensibilidad a la insulina, presentándose un mayor riesgo a desarrollar DM2 e hígado graso no alcohólico, además de disminuir el anabolismo muscular y exacerbar el estado proteolítico, poniendo al individuo en un mayor riesgo de sarcopenia. El incremento en el AU, el hipercortisolismo y la RI se consideran factores de riesgo para desarrollo de HTA. De forma independiente, la carga ácida de la dieta se asocia a un mayor riesgo cardiovascular. DMO: densidad mineral ósea; AU: ácido úrico; RI: resistencia a la insulina; DM2: diabetes mellitus tipo 2; HTA: hipertensión arterial; ECNT: enfermedades crónicas no transmisibles; ECV: enfermedad cardiovascular; ↑: incremento; ↓: disminución.
Los órganos involucrados en el mantenimiento del equilibrio ácido base son los pulmones y los riñones, así como un complejo sistema de mecanismos amortiguadores (buffers). El mantenimiento del pH arterial en rangos óptimos (7.35-7.45) se logra gracias a la interacción y funcionamiento adecuado de los elementos mencionados. La condición donde el valor del pH es menor a 7.35 se denomina acidemia, y un valor mayor a 7.45 se denomina alcalemia. La función principal de los pulmones en la homeostasis ácido base radica en su capacidad para regular la presión arterial de dióxido de carbono (PaCO2) a través de su eliminación. Los riñones, por su parte, participan controlando la reabsorción y producción de bicarbonato (HCO3−), así como la excreción de ácido titulable y no titulable, este último el sistema de amonio (NH4+) en la orina. La acidosis metabólica (AM) se define como la presencia de un pH arterial <7.35 y/o concentraciones disminuidas de HCO3−3,4. La condición donde el pH está muy cercano al límite inferior (7.35) es denominada acidosis metabólica (AM) de bajo grado5.
La dieta juega un papel esencial en el mantenimiento del equilibrio ácido base. Una vez que se ingieren los alimentos, la cámara gástrica excreta hidrogeniones y el páncreas secreta álcali al tracto digestivo. El aparato gastrointestinal incide en el estado ácido-base al absorber aminoácidos sulfurados y sales álcalis, los cuales serán transportados al hígado y a tejidos metabólicamente activos como sustratos. Una vez oxidados, los aminoácidos sulfurados liberaran protones y los ácidos orgánicos álcalis, repercutiendo en la reserva ácido base, siendo excretados finalmente por los riñones. Si bien el intestino no genera ácidos o bases, las características de la dieta determinan la formación de ácidos y álcalis una vez absorbidos y metabolizado en el hígado6.
Los componentes dietéticos que liberan precursores ácidos tras su metabolismo son el fósforo y las proteínas (principalmente aquellos aminoácidos sulfurados, como cisteína, metionina y taurina, además de aminoácidos catiónicos como lisina y arginina). Los nutrimentos precursores de bases son el potasio, magnesio y calcio6.
Medición y estimación de la producción de ácidos endógenosEl cuerpo elimina a través de la orina los productos del metabolismo de algunos aniones (cloro, fósforo, sulfato), ácidos orgánicos y cationes (sodio, potasio, calcio, magnesio). Cuando la cantidad de aniones supera la de cationes, se detona un mecanismo de excreción de ácidos (iones hidrógeno H+). La cantidad total de ácidos excretadas se denomina producción neta de ácido (NEAP) [(aniones+ácidos orgánicos) – cationes], el cual puede ser medido en la orina (NEAPdirecto) con la determinación de (NH4+ácido titulable) – HCO3, o estimado a través de la composición dietética del individuo sano (NEAPestimado). La cantidad de ácidos y álcalis que se producen según el perfil de nutrimentos de la dieta se denomina carga ácida potencial renal (PRAL), a la cual se incorpora la cantidad de ácidos orgánicos sintetizados de manera endógena (OAestimado)7,8. Existen 3 distintas formas de estimar el NEAP; Frassetto LA et al propusieron dos ecuaciones para estimarlo, las cuales consideran el consumo de proteína y de potasio únicamente9. Remer T et al propusieron un modelo matemático para estimar el PRAL el cual incorpora las cantidades de micronutrimentos presentes en la dieta habitual del individuo, al cual, al añadir el OAestimado, se obtiene el NEAPestimado. Este mismo grupo de investigación propuso también un modelo para estimar el PRAL que incorpora las cantidades de micronutrimentos excretados en la orina, al cual nos referiremos en el presente trabajo como PRALurinario10 (tabla 1).
Ecuaciones para estimar la Producción Neta de Ácido (NEAP)
| Indicador | Ecuación |
|---|---|
| NEAPest (mEq/día)Frasseto LA, et al.9 | Ecuación 1=(0.91 x proteína g/d) – (0.57 x Potasio mEq/d)+21 oEcuación 2=[(54.5 x proteína g/d) / Potasio mEq/d] – 10.2 |
| NEAPest (mEq/día)Remer T, et al.7 | PRAL+OAestPRAL (mEq/día)==(0.49 x proteína g/d)+(0.037 x fósforo mg/d) – (0.021 x potasio mg/d) – (0.026 x magnesio mg/d) – (0.013 x calcio mg/d)OAest (mEq/día)=(0.007184 x talla cm 0.725 x peso kg 0.425) x 41 / 1.73 |
| PRALurinario (medición en orina)Remer et al.10 | =(2 x sulfato mmol/d+cloro)+(1.8 x fosfato mmol/d) – (2 x sodio mmol/d+potasio mmol/d+magnesio mmol/d)+(2 x calcio mmol/d). |
NEAP: producción neta de ácidos; PRAL: carga ácida potencial renal
La exactitud de las ecuaciones para estimar el NEAP ha sido poco estudiada. Parmenter BH et al reportaron una mayor exactitud en la estimación del NEAP tras utilizar las ecuaciones de Remer T, observando una baja exactitud de ambas ecuaciones propuestas por Frassetto LA et al. Sin embargo, en la literatura es frecuente se utilice una o ambas estimaciones11.
Carga ácida potencial renalEl concepto de PRAL fue acuñado por Remer y Manz en 1994, el cual refleja una estimación de la tasa de absorción intestinal de diversos nutrimentos, el balance iónico del calcio, magnesio y potasio, y la disociación de fósforo a un pH de 7.4. El PRAL puede ser calculado para cualquier alimento, categorizándolos según su capacidad de liberar ácidos o bases a la circulación, o bien, puede estudiarse el PRAL de la dieta del paciente al evaluarse el consumo diario de los nutrimentos de interés, donde dietas con PRAL positivo incrementan la producción de precursores de ácidos, mientras que dietas con PRAL negativo incrementa la producción de precursores álcalis, es decir, cuando el valor de PRAL para un tipo de alimento es <0, se considera que este alimento aumenta la alcalinidad de los fluidos corporales y, cuando es> 0, el alimento aumenta la producción de ácidos en el cuerpo, con el respectivo impacto en el estado ácido-base. En general, los alimentos como la carne, los huevos, el queso y los granos integrales tienen PRAL positivo, mientras que las frutas y verduras tienen PRAL negativo. Por otro lado, el PRAL de la leche se considera neutro, así como las grasas y azúcares, con un pequeño efecto sobre el equilibrio ácido-base10.
Alimentos y carga ácida potencial renalEl concepto de PRAL tiene bases fisiológicas y toma en cuenta la composición química de los alimentos (contenido de proteínas, cloruro, fósforo, sodio, potasio, calcio y magnesio), las diferentes tasas de absorción intestinal de minerales y proteínas con aminoácidos sulfurados, así como la cantidad de sulfatos producidos por el metabolismo proteico.
Considerando su composición, las proteínas vegetales tienen menor valor biológico comparandolas con las de origen animal debido a la proporción de cisteína y metionina, sin embargo, no se considera que la proteína de origen vegetal tenga un menor contenido de aminoácidos sulfurados por cada gramo de proteína, por lo que dietas altas en proteína, independientemente el tipo (origen animal o vegetal), suelen incrementar el PRAL12.
Alimentos con PRAL positivoLa adopción de dietas industrializadas, donde predomina un bajo consumo de frutas y vegetales, aunado a un consumo elevado de productos de origen animal y cereales, se caracterizan por tener un PRAL positivo, el cual llega a ser de 50-100 mEq/día. La cantidad de ácido excretado dependerá de qué aminoácidos estén presentes en la alimentación, ya que algunos se clasifican como neutros, otros como ácidos y otros como alcalinos. Los aminoácidos que incrementan la producción de ácidos son lisina, arginina e histidina, los cuales generan ácido clorhídrico cuando se metabolizan, mientras que cisteína y metionina, al contener azufre en su composición, producen ácido sulfúrico. Los alimentos de origen animal, como la carne, pescado y quesos, son ricos en dichos aminoácidos y son los principales determinantes de la carga ácida de la dieta13,14.
Es importante señalar que la calidad de la proteína también debe evaluarse para cuantificar la acidez de la dieta. Las proteínas animales suelen tener una cantidad elevada de fósforo, incrementando el PRAL, con excepción de la leche, cuya cantidad de fósforo es compensada por la cantidad de calcio. Por otro lado, las proteínas vegetales tienen fósforo en forma de fitato, que es menos biodisponible y no tiene el mismo efecto metabólico acidificante. Aunado a ello, las proteínas vegetales son generalmente más ricas en glutamato, el cual requiere para su metabolismo la utilización de iones de hidrógeno, pudiendo tener un efecto neutro en la carga ácida15.
Alimentos con PRAL negativoLas frutas y vegetales tienen un PRAL negativo, por lo que son considerados la mayor fuente de amortiguadores en la dieta debido a su contenido de potasio, el cual está involucrado en el equilibrio ácido-base al ayudar a la electro-neutralidad a través del intercambio de iones de hidrógeno en la parte distal de la nefrona. El metabolismo de las sales de potasio que se encuentran en las frutas y hortalizas, incluidos el citrato y el malato, conduce al consumo de iones de hidrógeno y, por consiguiente, a un efecto alcalinizante. Considerando esto, la concentración de potasio en los alimentos refleja la capacidad alcalinizante de las frutas y verduras, aunque el contenido de potasio del alimento puede verse afectado por el método de cocción empleado, viéndose disminuido de forma significativa tras cocer el alimento en agua14,16.
La presencia de oxalato en el alimento impide la metabolización del potasio y la subsecuente producción de álcalis, contribuyendo a la producción de ácidos debido al ácido oxálico. Algunos alimentos ricos en oxalato son el betabel, la espinaca, las acelgas, las moras, cerezas, uvas, frambuesas, entre otros. Es importante considerar que su composición de micronutrimentos determinará un PRAL negativo, sin embargo, la literatura sugiere no incluirlos en la dieta debido al contenido de oxalato14,16.
Implicaciones clínicas de dietas con carga ácida elevadaEl consumo de una dieta alta en proteína y fósforo, baja en potasio, calcio y magnesio, tiene un impacto en la salud a largo plazo, al considerarse dietas acidogénicas, provocando AM de bajo grado17.
Una de las complicaciones de la AM de bajo grado es el incremento en la secreción de cortisol y la disminución de su inactivación18, lo cual ocasiona hipercortisolismo, condición que incrementa el riesgo de desarrollar diversas alteraciones metabólicas como sarcopenia, resistencia a la insulina, diabetes mellitus 2 y enfermedades cardiovasculares, entre otras complicaciones (Ver Ilustración 1)19. En la tabla suplementaria se mencionan los estudios epidemiológicos que han evaluado la asociación entre carga ácida (PRAL, NEAPestimado o NEAPurinario) y el desarrollo de alteraciones metabólicos.
SarcopeniaEl hipercortisolismo parece tener un papel importante en la disminución de la musculatura, al incrementar la proteólisis e inhibir la síntesis de proteína20,21. Se ha documentado una menor reserva muscular o mayor pérdida de la misma en individuos que consumen dietas con carga acida elevada (PRAL positivo)22–24. La musculatura disminuida se asocia con un mayor riesgo de fragilidad en el adulto mayor, según lo reportado por Kataya K et al, quienes observaron una mayor prevalencia de fragilidad en mujeres japonesas que consumían dietas altas en NEAPest y PRAL25.
Baja densidad mineral ósea / osteoporosisLa AM ocasiona una disminución en la actividad de los osteoblastos y una activación de los osteoclastos, la cual está mediada por el incremento en la liberación de β-glucoronidasa. El incremento en la actividad de los osteoclastos estimula de forma directa la movilización de calcio y fósforo desde hueso, con la finalidad de amortiguar hidrogeniones y mantener el pH sérico en rangos de normalidad, lo anterior incrementa también la excreción urinaria de calcio. De forma crónica, este proceso puede ocasionar alteraciones óseas, como osteodistrofia, osteoporosis y mayor riesgo de fracturas26,27. Considerando dichos mecanismos, se ha sugerido que el consumo crónico de dietas acidificantes puede ocasionar una disminución en la mineralización ósea e incrementar el riesgo de fracturas.
Reportes de distintas cohortes prospectivas en niños documentan que el consumo de dietas con PRAL elevado se asocian con una menor área cortical ósea y menor densidad ósea28,29, incrementando el riesgo de fracturas en mujeres pero no en hombres30. En adultos, Jia T et al no observaron relación entre carga ácida de la dieta y densidad mineral ósea en una muestra de 861 hombres y mujeres mayores de 70 años31, mientras que Jonge EAL et al observaron una relación inversa entre carga ácida y la microestructura ósea evaluada a través de la estructura ósea trabecular en 4672 mujeres adultas mayores de 45 años32.
Hipertensión arterialLa AM y las dietas altas en PRAL tienen influencia en la presión arterial (TA), la cual se incrementa debido a: 1) el incremento en el cortisol y sus efectos sobre vasoconstricción, 2) el incremento en la excreción de calcio y magnesio en orina, 3) la disminución en la excreción de citrato en orina, 4) la resistencia a la insulina y 5) la alteración en la secreción de factor de crecimiento insulínico (IGF-1)33. Así mismo, una dieta alta en PRAL se asocia con un incremento en las concentraciones de ácido úrico (AU) debido a una disminución en la secreción de urato del túbulo proximal a la orina34, lo que podría explicar el efecto en el incremento en la TA a través de la hiperuricemia, el cual es un factor de riesgo independiente para el desarrollo de hipertensión arterial sistémica (HTA)35.
Zhang L et al publicaron en el 2009 una de las primeras cohortes prospectivas que reportó la asociación entre carga ácida e incidencia de HTA, en la cual se dio seguimiento durante 14 años a una muestra de 87 293 mujeres36. Otros autores no han observado una asociación entre el PRAL estimado a través de la dieta y alteraciones en la TA, reportando asociación únicamente con el PRALurinario33. Resultados similares fueron reportados por Engberink M et al, quienes no observaron una asociación entre NEAPestimado y PRAL con la TA 37. Akter S et al reportaron una relación entre el PRAL y la prevalencia de HTA al analizar a los pacientes por terciles, reportando un OR de 1.31 (IC95% 1.01-1.70, p=0.043)38. Krupp D et al evaluaron el PRAL de la dieta de 6 788 pacientes en Alemania, reportando un riesgo 45% mayor a desarrollar HTA en aquellos pacientes con PRAL elevado 39. Tielemans et al evaluaron la relación entre el PRAL y el desarrollo de eclampsia en una cohorte de mujeres embarazadas, no observando asociación entre PRAL ni NEAPestimado con la incidencia de eclampsia o HTA 40.
Resistencia a la insulina/ diabetesLa AM disminuye la sensibilidad a la insulina al provocar alteraciones en la expresión del receptor de la insulina y disminuir la fosforilación de Akt. Dichas alteraciones se han observado en pacientes con pH <7.2. En pacientes con AM de bajo grado, se ha observado resistencia a la insulina (RI) debido al incremento en la gluconeogénesis hepática y a la disminución en la captación de glucosa en músculo41. Akter S et al observaron en una muestra de 1 732 adultos una asociación positiva entre PRAL y NEAPestimado con RI42. En pacientes embarazadas, la RI es un determinante del desarrollo de diabetes mellitus gestacional (DMG), reportándose una asociación entre el PRAL y las concentraciones de glucosa, colesterol total y colesterol LDL, incrementando también el riesgo de DMG (OR 5.25, IC95% 2.99-9.24, p<0.001) ajustado a la edad y al consumo de energía43.
La RI es un factor de riesgo para el desarrollo de diabetes. Fagherazzi G et al reportaron una asociación entre NEAP y PRAL con riesgo de diabetes tipo 2 (DM2) tras dar seguimiento durante 14 años a una población de 66 485 mujeres44. Dicha asociación fue confirmada por Kiefte-de Jong JC et al, quienes evaluaron el PRAL y NEAPestimado en 3 cohortes distintas (Nurses Health Study, Nurses Healty Study II y Health Proffessionals Follow-Up Study), que en conjunto suman un total de 187 490 pacientes (19% hombres)45. Dichos resultados difieren de lo reportado por Xu H et al46, quienes no observaron relación entre el PRAL y NEAPestimado con la sensibilidad a la insulina y con el riesgo de DM2. Akter S et al no observaron relación entre el PRAL y en NEAPestimado con DM2 en mujeres pero si en hombres47. Debido a la controversia en los resultados, en el 2017 Jayedi A et al publicaron un metaanálisis en el cual se incluyeron los cuatro estudios mencionados previamente, observando un incremento en el riesgo de DM2 de 22% en pacientes con el mayor consumo de PRAL (RR 1.22, IC95% 1.09-1.35, p=0.01) y de 23% para NEAPestimado (RR 1.23, IC95% 1.10-1.36, p=0.03). Al realizar el análisis por sexo, la significancia estadística se observó solamente en mujeres48.
En pacientes japoneses con diagnóstico de DM2, se observó una mayor prevalencia de síndrome metabólico en aquellos con dietas altas en PRAL (OR 2.22, IC95% 1.04-4.83, p=0.0384) y altas en NEAPestimado (OR 2.61, IC95% 1.25-5.55, p=0.0098)49.
Hígado graso no alcohólicoLa RI asociada al consumo de dietas ácidas y la consecuente hiperglucemia parece incrementar la inflamación y RI en el hígado, pudiendo ocasionar hígado graso no alcohólico debido al incremento en la disponibilidad de ácidos grasos libres5. Krupp D et al observaron un incremento en las concentraciones de alanino aminotransferasa (ALT) y mayores puntajes en el índice de esteatosis hepática e índice de hígado graso en mujeres adolescentes con dietas altas en PRAL. Dicha asociación no se observó en los hombres participantes50. En adultos asiáticos, Chan R et al reportaron una asociación positiva entre el NEAPestimado y la infiltración de grasa en hígado, asociación no observada con el PRAL51.
Enfermedad renal crónicaDietas con alta carga ácida ocasionan un incremento en la producción de amonio en las células tubulares, cuyo objetivo es neutralizar la carga de hidrogeniones, provocando hipertrofia tubular e hiperfiltración glomerular (incremento en la tasa de filtrado glomerular (TFG)), la cual es considerada una etapa temprana y reversible de la enfermedad renal crónica (ERC). El incremento en las concentraciones intratubulares de hidrogeniones se acompaña de un incremento en la producción de endotelina-1, angiotensina II y aldosterona, sustancias que estimulan la producción de factores pro-fibróticos, ocasionando una disminución en la TFG cuando la alimentación ácida se mantiene por tiempos prolongados16.
So R et al reportaron un incremento en la TFG (hiperfiltración) asociado al consumo de dietas altas en PRAL, tras evaluar a una muestra de 123 169 adultos en Corea52. En el 2014, Banerjee T et al reportaron mayor incidencia de marcadores de daño renal (tasa de incidencia de albuminuria 57% mayor y 37% mayor en TFG disminuida) en individuos con dietas altas en NEAPestimado, tras evaluar a una muestra de 12 293 pacientes estadounidenses53. Recientemente, este mismo grupo de investigadores reportó una mayor prevalencia de albuminuria y TFG disminuida en individuos con dietas altas en PRAL tras un análisis transversal de 3 257 pacientes afroamericanos54. Rebholz CM et al dieron seguimiento durante 21 años a una cohorte compuesta por 15 055 adultos estadounidenses, en quienes estimaron el PRAL y el NEAPestimado y evaluaron su relación con la incidencia de ERC, observando una incidencia 13% mayor en aquellos individuos con el mayor consumo de PRAL y de 14% en el mayor consumo de NEAPestimado55. Estos mismos hallazgos fueron replicados por Ko BJ et al en el 2017, quienes en un estudio transversal evaluaron el NEAPestimado y la función renal en una población de 1369 adultos coreanos56.
Una vez desarrollado el daño renal, dietas altas en carga ácida ocasionan una progresión más acelerada de la enfermedad, incrementando el riesgo de enfermedad renal crónica terminal (ERCT), según lo observado por Banerjee T et al, quienes dieron seguimiento durante 14 años a una muestra de pacientes con ERC, evaluando el NEAPestimado y el tiempo transcurrido previo al inicio de terapia renal sustitutiva, identificando una progresión más acelerada a ERCT (OR 3.04, IC95%1.58-5.86, p=<0.05) en aquellos pacientes con dietas altas en NEAPestimado57.
En pacientes diagnosticados con ERC, dietas altas en PRAL y NEAPestimado se asocian de forma inversa con las concentraciones séricas de bicarbonato y con descontrol glucémico, mayores cifras de tensión arterial sistólica y mayores concentraciones de triglicéridos, pudiendo afectar de forma significativa los desenlaces clínicos58,59.
Litiasis renalEn respuesta a la AM, el riñón incrementa la reabsorción de citrato en los túbulos renales e incrementa la excreción de fósforo, cloro y sodio en orina, disminuyendo la excreción de citrato (hipocitranuria), acidificando el pH urinario. Dichos cambios en la composición urinaria incrementa el riesgo de formación de litos renales13,60,61. Trincheri A et al evaluaron el PRAL y NEAPestimado en una muestra de 123 individuos formadores de litos y 123 individuos controles, reportando un mayor riesgo de formación en aquellos con mayor PRAL y NEAPestimado62. Estos mismos hallazgos fueron reportados por Ferraro PM et al, quienes analizaron la relación entre el NEAPestimado y la incidencia de litiasis renal en tres cohortes (Health Professionals Follow-Up Study, Nurses Health Study I y Nurses Health Study II)63.
Enfermedad cardiovascular y mortalidadLas complicaciones asociadas a la AM, como RI, DM2, HTA, ERC, entre otras, son consideradas factores de riesgo para enfermedad cardiovascular. De forma independiente, las dietas con PRAL elevado se asocian a un mayor riesgo cardiovascular (ASCVD>10% en 10 años o Framingham>20% en el mismo periodo de tiempo), según lo reportado por Han E et al, tras analizar el PRAL en una muestra de 11 601 pacientes en Corea64. A la fecha, es el único estudio epidemiológico publicado que evalúa la asociación entre riesgo cardiovascular y carga ácida de la dieta.
Las enfermedades cardiovasculares representan hoy en día la principal causa de mortalidad a nivel mundial65. Considerando las complicaciones de las dietas con carga ácida elevada, se ha evaluado la posible asociación del PRAL con la mortalidad en dos estudios; Huston HK et al no observaron asociación tras evaluar el NEAPestimado en un total de 16 906 pacientes estadounidenses66, mientras que Akter S et al, al analizar en una cohorte de 92 478 japoneses la asociación entre el PRAL y NEAPestimado con la mortalidad, reportan un incremento de 13% en la mortalidad general y 16% en mortalidad de tipo cardiovascular en los individuos con PRAL elevado, con riesgos similares al analizar el NEAPestimado (12% para mortalidad general y 17% para cardiovascular)67.
Aplicaciones clínicasConociendo las implicaciones clínicas de la AM de bajo grado, es fundamental el monitoreo del equilibrio ácido base a través de métodos objetivos no invasivos. La medición del pH urinario, obtenido de una muestra al azar, ha mostrado ser un buen marcador del PRAL (β=-0.08, p=<0.001), donde un pH urinario alcalino se asocia al seguimiento de dietas con PRAL negativo68 incluso en pacientes con DM2 (r=-0.24, p=0.002), reportándose que valores de pH urinario menores de 6.0 se asocian a dietas acidificantes69, sugiriéndose realizar cuestionarios de frecuencia de consumo alimentario para la cuantificación de la carga ácida y la posterior implementación de estrategias dietéticas.
El consumo de proteínas de origen vegetal versus origen animal podría brindar beneficios, reportándose el incremento en el pH urinario tras 7 días de seguimiento de una dieta vegetariana, mismos efectos observados en pacientes tras seguir este tipo de alimentación solamente 2 o 3 días por semana70. La incorporación de lácteos (leche o yogurt) podría ayudar a cubrir el aporte proteico sin impactar la carga acida, ya que son alimentos con PRAL neutro16, mientras que la incorporación de frutas se asocia de forma inversa con el NEAPestimado, por lo que la inclusión diaria de este grupo de alimentos puede disminuir la carga ácida de la dieta, evitando aquellas con alto contenido de oxalatos71.
La disminución en el consumo de productos industrializados con aditivos de fósforo puede ayudar a disminuir la carga ácida, a través de la restricción en el consumo de bebidas carbonatadas, tés industrializados, carnes, productos congelados y demás productos con aditivos alimentarios72.
El consumo rutinario de agua mineral o bebidas adicionadas con bicarbonato ha mostrado efectos benéficos en el incremento del pH urinario, como lo muestran en sus estudios Siener R et al, quienes dieron a beber 1.4 L de agua mineral al día (3388mg/L de bicarbonato, 232mg/L de calcio y 337mg/L de magnesio)73, Heil DP, quien dio a beber a libre demanda agua mineral rica en calcio, potasio, magnesio y selenio durante 2 semanas74 y Day RO et al, al proporcionar 1.5-1.8 L/día de agua enriquecida con 650mg/L de bicarbonato y 120mg/L de magnesio75.
En pacientes con ERC, otra de las estrategias utilizadas para aminorar la AM es la suplementación de bicarbonato de sodio vía oral, a dosis de 600mg/tres veces al día durante 1 año, observando un incremento en las concentraciones séricas de bicarbonato y una disminución en la caída de la función renal en el grupo suplementado76. Esta estrategia no ha sido evaluada en la AM de bajo grado no asociada a ERC.
Para el cálculo del PRAL se requiere la utilización de un cuestionario de frecuencia alimentaria o bien de diarios de alimentos, estimando el consumo de los micronutrimentos de interés. En caso de no contar un software para el procesamiento de dichas herramientas, se sugiere la incorporación de alimentos con PRAL neutro o negativo, utilizando tablas de PRAL para porciones de alimentos (tabla 2).
PRAL estimado para 100g de alimento
| Alimento | Proteína | Fósforo | Potasio | Magnesio | Calcio | PRAL |
|---|---|---|---|---|---|---|
| BEBIDAS | ||||||
| Cerveza | 0.46 | 14 | 27 | 6 | 4 | 0.0 |
| Refresco de Limón | 0.05 | 0 | 1 | 1 | 2 | 0.0 |
| Coca Cola | 0 | 9 | 5 | 0 | 1 | 0.2 |
| Cocoa con leche | 3.5 | 105 | 197 | 23 | 114 | -0.6 |
| Café molido | 0.3 | 3 | 50 | 4 | 2 | -0.9 |
| Infusión de frutos | 0 | 0 | 167 | 0 | 0 | -3.5 |
| Té verde | 0 | 0 | 15 | 1 | 0 | -0.3 |
| Agua Mineral | 0 | 0 | 2 | 11 | 33 | -0.8 |
| Jugo de naranja | 0.7 | 17 | 200 | 11 | 11 | -3.7 |
| Vino tinto | 0.07 | 23 | 127 | 12 | 8 | -2.2 |
| Vino Blanco | 0.07 | 18 | 71 | 10 | 9 | -1.2 |
| ACEITES Y GRASAS | ||||||
| Mantequilla | 3.21 | 85 | 135 | 10 | 115 | 0.1 |
| Margarina | 0.23 | 7 | 51 | 1 | 6 | -0.8 |
| Aceite de olivo | 0 | 0 | 1 | 0 | 1 | 0.0 |
| Aceite de semilla de girasol | 0 | 0 | 0 | 0 | 0 | 0.0 |
| OLEAGINOSAS | ||||||
| Avellanas | 14.95 | 290 | 680 | 163 | 114 | -1.9 |
| Cacahuates | 25.8 | 376 | 705 | 168 | 92 | 6.2 |
| Pistaches | 20.16 | 490 | 1025 | 121 | 105 | 2.0 |
| Almendras | 20.96 | 471 | 713 | 279 | 268 | 2.0 |
| Nueces | 24.06 | 513 | 523 | 201 | 61 | 13.8 |
| PRODUCTOS DE ORIGEN ANIMAL | ||||||
| Bacalao | 22.86 | 521 | 427 | 38 | 52 | 19.8 |
| Mejillones | 23.8 | 285 | 268 | 37 | 33 | 15.2 |
| Salmón | 26.48 | 305 | 436 | 36 | 11 | 14.0 |
| Sardinas en aceite | 24.62 | 490 | 397 | 39 | 382 | 15.9 |
| Camarones | 23.98 | 237 | 259 | 39 | 70 | 13.2 |
| Carne de Res | 25.25 | 179 | 271 | 19 | 23 | 12.5 |
| Carne de pollo | 29.8 | 214 | 245 | 27 | 14 | 16.5 |
| Salchicha de cerdo | 15.27 | 130 | 283 | 15 | 12 | 5.8 |
| Carne de cerdo | 26.83 | 263 | 352 | 22 | 14 | 14.7 |
| Huevo entero | 13.61 | 215 | 152 | 13 | 162 | 9.0 |
| Clara de huevo | 10.9 | 15 | 163 | 11 | 7 | 2.1 |
| Yema de huevo | 15.86 | 390 | 109 | 5 | 129 | 18.1 |
| CEREALES Y LEGUMINOSAS | ||||||
| Arroz Integral | 2.74 | 103 | 86 | 39 | 3 | 2.3 |
| Arroz Blanco | 2.69 | 43 | 35 | 12 | 10 | 1.7 |
| Espagueti blanco | 0.66 | 14 | 117 | 11 | 21 | -2.2 |
| Papas | 2.1 | 75 | 544 | 27 | 10 | -8.5 |
| Tortilla maíz | 6.6 | 232.5 | 152.4 | 66 | 161.7 | 4.8 |
| Tortilla de Harina | 9.66 | 210 | 100 | 21 | 205 | 7.2 |
| Frijoles | 9.31 | 100 | 646 | 54 | 52 | -7.4 |
| Lentejas | 9.02 | 180 | 369 | 36 | 19 | 2.1 |
| Garbanzo | 8.86 | 168 | 291 | 48 | 49 | 2.6 |
| Soya | 12.35 | 158 | 539 | 60 | 145 | -2.9 |
| Haba | 7.6 | 125 | 268 | 43 | 36 | 1.1 |
| LÁCTEOS | ||||||
| Crema | 2.44 | 76 | 125 | 10 | 101 | -0.2 |
| Queso cottage | 11.12 | 159 | 104 | 8 | 83 | 7.9 |
| Queso Fresco | 18.09 | 385 | 129 | 24 | 566 | 12.4 |
| Gouda | 24.94 | 546 | 121 | 29 | 700 | 20.0 |
| Parmesano | 28.42 | 627 | 180 | 34 | 853 | 21.4 |
| Leche entera | 3.15 | 84 | 132 | 10 | 113 | 0.2 |
| Leche descremada | 3.37 | 101 | 156 | 11 | 122 | 0.2 |
| Yogurt Griego | 10.19 | 135 | 141 | 11 | 110 | 5.3 |
| VEGETALES | ||||||
| Espárragos | 2.4 | 54 | 224 | 14 | 23 | -2.2 |
| Brócoli | 2.38 | 67 | 293 | 21 | 40 | -3.6 |
| Zanahoria cruda | 0.93 | 35 | 320 | 12 | 33 | -5.7 |
| Coliflor | 1.84 | 32 | 142 | 9 | 16 | -1.3 |
| Apio | 0.69 | 24 | 260 | 11 | 40 | -5.0 |
| Pepino | 0.65 | 24 | 147 | 13 | 16 | -2.4 |
| Berenjena | 0.83 | 15 | 123 | 11 | 6 | -2.0 |
| Espinaca cruda | 2.86 | 49 | 558 | 79 | 99 | -11.8 |
| Tomate | 0.88 | 24 | 237 | 11 | 10 | -4.1 |
| Kale | 2.92 | 55 | 348 | 33 | 254 | -8.0 |
| Lechuga | 1.23 | 30 | 247 | 14 | 33 | -4.3 |
| Champiñones | 2.5 | 120 | 448 | 9 | 18 | -4.2 |
| Cebollas | 1.1 | 29 | 146 | 10 | 23 | -2.0 |
| Quelites | 1.49 | 37 | 488 | 67 | 78 | -10.9 |
| FRUTAS | ||||||
| Manzana | 0.26 | 11 | 107 | 5 | 6 | -1.9 |
| Plátano | 1.09 | 22 | 358 | 27 | 5 | -6.9 |
| Uvas | 0.72 | 20 | 191 | 7 | 10 | -3.2 |
| Kiwi | 1.14 | 34 | 312 | 17 | 34 | -5.6 |
| Limón | 1.1 | 16 | 138 | 8 | 26 | -2.3 |
| Mango | 0.82 | 14 | 168 | 10 | 11 | -3.0 |
| Naranja | 0.94 | 14 | 181 | 10 | 40 | -3.6 |
| Fresas | 0.67 | 24 | 153 | 13 | 16 | -2.5 |
| Sandía | 0.61 | 11 | 112 | 10 | 7 | -2.0 |
| Cereza | 0.4 | 11 | 146 | 18 | 12 | -3.1 |
Basado en USDA Food Composition Databases, EU.
La evidencia del NEAPestimado y del PRAL disponible a la fecha sugiere una relación directa con el desarrollo de complicaciones metabólicas, entre ellas un incremento en el catabolismo muscular mediado por una disminución en la sensibilidad a la insulina, disminuyendo también el anabolismo muscular. Dichos cambios incrementan la pérdida de masa muscular en la tercera edad, pudiendo influir en el desarrollo de fragilidad y de sus complicaciones17,19,20.
Dietas con carga ácida elevada se asocian a un incremento en la resorción ósea, ocasionando una disminución en la densidad ósea, sin embargo, los resultados de los estudios son controversiales, además de utilizar diferentes indicadores de carga ácida (PRALurinario, PRAL en dieta y NEAPestimado)28–31.
El hipercortisolismo y la RI son factores de riesgo para el desarrollo de HTA, documentándose una relación positiva entre PRAL y NEAPestimado con las cifras de tensión arterial sistólica en personas normotensas33,36,38,39, sin embargo el efecto en la incidencia de HTA resulta controversial, ya que hay discrepancia entre los resultados publicados a la fecha37.
La AM de bajo grado ocasionada por dietas con PRAL y NEAPestimado elevados incrementan la producción de cortisol, el cual ocasiona RI por diversos mecanismos42, incrementando con ello el riesgo de DM2 a largo plazo, según lo reportado en estudios transversales y cohortes con tamaños muestrales variados44,45,48. En mujeres embarazadas, dicha alimentación incrementa el riesgo de DMG según lo reportado en un estudio de casos y controles43.
Dietas con PRAL y NEAPestimado elevados pueden influir en el desarrollo de hígado graso no alcohólico, el cual puede explicarse por el incremento en la liberación de ácidos grasos producto de la RI, sin embargo, sólo 2 estudios han evaluado dicha asociación con resultados poco contundentes50,51.
La DM2 y la HTA son las principales causas de ERC. De manera independiente, el consumo a corto y largo plazo de dietas con carga ácida elevadas medidos a través de los distintos indicadores parece tener un impacto negativo en la salud renal, incrementando la TFG de manera temprana (fenómeno de hiperfiltración) como mecanismo adaptativo para incrementar la excreción de ácidos52, lo cual favorece el desarrollo de fibrosis renal cuando esto se presenta de forma crónica, al incrementarse la producción de algunos factores pro-fibroticos, llevando al paciente al desarrollo de ERC53,55,56 y progresión acelerada a ERCT57 por un aumento en la fibrosis intersticial y atrofia tubular. La litiasis renal es otra complicación de la AM de bajo grado, al verse incrementada la excreción de fósforo y calcio en orina, favoreciendo la reabsorción tubular de citrato y disminuyendo su excreción en orina, con el consecuente cambio en el pH urinario. Estos cambios en la composición y pH urinario incrementan la formación de complejos calcio-oxalato y calcio-fosfato, incrementando el riesgo de formación de litos renales62,63.
La DM2, HTA y ERC son enfermedades crónicas que incrementan el riesgo cardiovascular. Siendo la carga ácida de la dieta un determinante de las tres condiciones, se ha evaluado la asociación del PRAL y el NEAPestimado con la incidencia de enfermedad cardiovascular64 y tasas de mortalidad general y cardiovascular, documentándose una mayor incidencia y mayores tasas de mortalidad en los individuos con dietas altas en ambos indicadores67. Respecto a la mortalidad, Huston HK et al no observaron una asociación entre carga ácida y mayor riesgo66.
Si bien existe evidencia contundente respecto a los efectos a largo plazo de dietas con carga ácida elevada, existe un vacío en la literatura del impacto de la dieta con carga ácida baja o que aporte residuo alcalino. Al respecto, consideramos que dados los procesos metabólicos corporales generan una importante carga de hidrogeniones y además existe una siempre activa compensación ventilatoria del pH sanguíneo, el aporte alcalino de la dieta no representa un mecanismo generador o de mantenimiento de alcalosis o sus complicaciones metabólicas.
Algunos autores han sugerido la implementación de dietas vegetarianas como estrategia para aminorar la acidosis metabólica, a lo que es importante señalar que no sólo las carnes rojas o productos de origen animal son los determinantes de la carga ácida de la dieta, debiendo considerar que dichos alimentos son una fuente importante de aminoácidos esenciales, según lo descrito por Mafra D y colaboradores77, por lo que este tipo de dietas sin supervisión profesional pueden comprometer el aporte de dichos aminoácidos, promoviendo el desarrollo de patologías carenciales y afectando el anabolismo proteico, volviéndose fundamental el profesionista de la nutrición en la prescripción de este tipo de abordajes.
ConclusionesSegún la literatura, el tipo de dieta puede afectar profundamente al cuerpo al proporcionar precursores de ácido o bases. Dietas con carga ácida elevada tienen por consecuencia cambios en el equilibrio ácido base, reportándose una asociación entre la acidosis metabólica de bajo grado con el desarrollo de enfermedades crónicas no transmisibles. La implementación de estrategias orientadas a disminuir la carga ácida de la dieta a través de intervenciones nutricionales puede impactar de manera positiva en el estado de salud.
Puntos clave- •
El perfil de micronutrimentos de la dieta determina la producción de precursores de ácidos y bases en el organismo, impactando en el equilibrio ácido base.
- •
La producción neta de ácido puede ser estimada a través de la carga ácida de la dieta utilizando modelos matemáticos que consideran el consumo de calcio, magnesio, proteína, fósforo y potasio en la dieta habitual.
- •
El consumo de dietas con cargas ácidas positivas ocasiona acidosis metabólica de bajo grado, la cual se ha asociado al desarrollo de enfermedades crónicas no transmisibles, como diabetes, hipertensión, enfermedad renal crónica, litiasis renal, hígado graso no alcohólico, entre otras complicaciones.
Sin conflictos por declarar.