La endocarditis infecciosa presenta una mortalidad de 25%. La lesión renal aguda (LRA) se desarrolla en hasta 70% de los casos. El objetivo de presente estudio es determinar el impacto pronóstico de la LRA en la endocarditis y los factores asociados a la misma.
Materiales y métodosEstudio retrospectivo unicéntrico que incluyó a todos los pacientes ingresados por endocarditis entre 2015 y 2021. Basalmente se recogieron datos epidemiológicos y comorbilidades. Durante el ingreso, se recogieron datos de evolución de la función renal, variables asociadas con la propia infección y el desenlace de la misma. A través de modelos multivariables, se analizó la capacidad predictiva de la LRA en la mortalidad.
ResultadosSe incluyó a 134 pacientes (63% varones, edad media 72 ± 15 años) de los que 94 (70%) presentaron una LRA (50% AKIN-1, 29% AKIN-2 y 21% AKIN-3). Los factores asociados a presentar una LRA fueron la edad, la hipertensión arterial, tener una enfermedad renal crónica, el FGe basal, padecer insuficiencia cardiaca y enfermedad vascular periférica. El único predictor independiente para presentar una LRA fue el FGe basal (OR 0,94, p = 0,001).
Fallecieron 46 (34%) pacientes, de los que en 45 (98%) se desarrolló una LRA. A través de diversos modelos multivariantes ajustados, la LRA predijo independientemente la mortalidad. Asimismo, la pérdida de FGe (OR 1,054, p < 0,001) y el FGe basal (0,963, p = 0,012) se asociaron independientemente a fallecer durante la hospitalización.
ConclusionesEl desarrollo de una LRA y su gravedad, es decir, la pérdida de FGe y la puntuación en la escala AKIN impactan en el pronóstico de una endocarditis infecciosa.
Infective endocarditis presents a 25% mortality. Acute kidney injury (AKI) develops in up to 70% of the cases. The aim of this study is to evaluate the predictive value of AKI in mortality due to endocarditis and to assess its associated factors.
MethodsUnicentric and retrospective study including all patients with in-hospital diagnosis of endocarditis between 2015 and 2021. Epidemiological data and comorbidities were collected at baseline. During admission, renal function parameters, infection-related variables and mortality were collected. Using adjusted multivariate models, LRA predictive value was determined.
ResultsOne hundred and thirty-four patients (63% males, age 72±15 years) were included. Of them 94 (70%) developed AKI (50% AKIN-1, 29% AKIN-2 and 21% AKIN-3). Factors associated to AKI were age (p=0.03), hypertension (p=0.005), previous chronic kidney disease (p=0.001), heart failure (p=0.006), peripheral vascular disease (p=0.022) and glomerular filtration rate (GFR) at baseline (p<0.001). GFR at baseline was the only factor independently associated to AKI (OR 0.94, p=0.001).
In-hospital deaths were registered in 46 (34%) patients. Of them, 45 (98%) patients had developed AKI. AKI was independently associated to mortality through diverse multivariate models. GFR loss (OR 1.054, p<0.001) and GFR at baseline (0.963, p=0.012) also predicted mortality during admission.
ConclusionsAKI development and its severity (GFR loss and AKIN severity) impacts in in-hospital mortality due to infective endocarditis.
La endocarditis infecciosa es una patología poco frecuente con una incidencia estimada en España de entre 3,1 y 3,7 casos por cada 100.000 habitantes1. Dentro de los factores predisponentes destacan las valvulopatías reumáticas, en claro descenso en los países desarrollados, las valvulopatías degenerativas, la diabetes mellitus, el cáncer, el uso recreativo de la vía intravenosa o las cardiopatías congénitas2. A pesar de su baja incidencia y de los avances científicos en su detección y tratamiento, su pronóstico es malo alcanzando una mortalidad de hasta 25%3.
El deterioro de función renal es una complicación habitual en las endocarditis infecciosas alcanzando en algunas series hasta el 70% de incidencia4. La importancia de la lesión renal aguda (LRA) en el seno de cualquier proceso infeccioso radica en mecanismos que generan desregulación inflamatoria, trastornos microvasculares y modificaciones de la programación celular adaptativa, todas ellas causantes de un agravamiento de la situación clínica5. En lo que respecta al binomio endocarditis-LRA los datos publicados son heterogéneos, lo que se justifica por la irregular definición de LRA y por la falta de demostración etiológica (sepsis, nefrotoxicidad, patología glomerular o necesidad de cirugía)6–8. Por todo ello, actualmente no existe un consenso de manejo de la LRA.
Algunos factores han demostrado su impacto en el pronóstico de la endocarditis infecciosa, siendo los más destacados aquellos relacionados con la situación basal (principalmente comorbilidad cardiovascular). Sin embargo, a pesar de que el deterioro de función renal es una complicación habitual en el curso de una endocarditis infecciosa, hasta el momento no se ha determinado su poder predictivo pronóstico.
El objetivo del presente estudio es evaluar el impacto de la lesión renal aguda (LRA) sobre la mortalidad de pacientes hospitalizados por una endocarditis infecciosa, profundizando en los factores asociados a la misma.
MétodosPacientesSe trata de un estudio unicéntrico, observacional y retrospectivo, que incluyó a todos los pacientes con endocarditis infecciosa entre enero de 2015 y diciembre de 2021. Los criterios de inclusión fueron: necesidad de una hospitalización con diagnóstico principal de endocarditis infecciosa según los criterios de Duke9 y ser mayor de edad. Se excluyó a los pacientes en los que el episodio actual era un reingreso (definido como nueva hospitalización tras menos de 30 días respecto a la previa), a aquellos con antecedentes de endocarditis infecciosa, en los que se perdió el seguimiento (traslado a otro centro), aquellos con más de un foco infeccioso en el momento del ingreso, aquellos en los que la endocarditis se hubiera producido como complicación durante el propio ingreso o aquellos con ERC estadio 5 en programa de terapia renal sustitutiva o portadores de un injerto renal.
ObjetivosEl objetivo principal del presente estudio fue determinar el impacto pronóstico del deterioro de función renal en pacientes con endocarditis infecciosa. Como objetivos secundarios incluimos la determinación de los factores asociados a presentar una LRA, la descripción de las características clínicas (forma de presentación, complicaciones, microorganismos implicados) en la endocarditis infecciosa y la asociación entre la gravedad de la LRA y el pronóstico vital.
VariablesBasalmente se recogieron variables epidemiológicas (edad, sexo) y comorbilidades (hipertensión arterial definida según las guías de la Sociedad Internacional de Hipertensión10, diabetes mellitus según las guías de la American Diabetes Association [ADA]11, dislipemia según las guías Kidney Disease: Improving Global Outcomes [KDIGO]12, antecedentes de cardiopatía isquémica, de ictus y de insuficiencia cardiaca según las guías de la European Society of Cardiology [ESC]13). En cuanto a la función renal, se definió la presencia de enfermedad renal crónica (ERC) y su estadiaje según las guías KDIGO14. El filtrado glomerular se estimó por la fórmula de Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI).
Durante la hospitalización se recogieron datos de la afectación valvular (tipo de válvula afectada y si esta era nativa o protésica), datos ecocardiográficos de la infección, microorganismo responsable, desarrollo de bacteriemia y bacteriemia persistente, antibioterapia prescrita, evolución de parámetros infecciosos y de función renal (creatinina sérica al ingreso y en el pico máximo) y desenlace durante el ingreso. Con los datos de función renal, se estableció la gravedad de la LRA en base a la escala AKIN15. Dicha escala utiliza un criterio analítico basado en la creatinina sérica y el flujo urinario para determinar el estadio, de manera que a mayor estadio mayor gravedad:
- -
Estadio 1: aumento de 1,5 a 1,9 veces el valor de la creatinina basal o incremento superior a 0,3 mg/dL o presencia de un flujo urinario inferior a 0,5 mL/kg/h durante más de seis horas.
- -
Estadio 2: aumento de 2 a 2,9 veces el valor de la creatinina basal o la presencia de un flujo urinario inferior a 0,5 mL/kg/h durante más de 12 h.
- -
Estadio 3: aumento superior a tres veces el valor de la creatinina basal, valor de la creatinina superior a 4 mg/dL o necesidad de terapia renal sustitutiva; o flujo urinario inferior a 0,3 mL/kg/h en 24 h o anuria durante 12 h.
Se estableció la etiología de la LRA teniendo en cuenta los parámetros histológicos, si es que se había realizado una biopsia renal, los datos recogidos en la historia clínica y una evaluación a posteriori de dos nefrólogos (investigadores del estudio) que categorizaron en funcional, necrosis tubular aguda (NTA), nefritis intersticial aguda y multifactorial la misma. La definición de la etiología se basó en los parámetros urinarios y en la evolución de la LRA. Dentro de la causa multifactorial se incluyeron aquellos que casos que sin haber podido ser biopsiados, tenían al menos dos posibilidades diagnósticas para explicar la LRA.
Métodos estadísticosLas variables se expresan como media o mediana como medidas de centralización y desviación estándar o rango intercuartílico como medidas de dispersión. Las comparaciones entre variables paramétricas se realizaron mediante el test de χ2 para variables cualitativas, t de Student para variables cualitativas dicotómicas y cuantitativas, ANOVA para variables cualitativas no dicotómicas y cuantitativas, y Pearson para correlaciones entre variables cuantitativas. En el caso de variables no paramétricas, se utilizaron los test de Fisher, Mann-Whitney, Kruskal-Wallis y Spearman, respectivamente. Las variables finales (LRA y mortalidad) se analizaron mediante regresión logística univariante y multivariante ajustada para los factores considerados de confusión o relevantes en diferentes modelos asociativos. Los análisis estadísticos se realizaron con el programa SPSS 26.0®. Los gráficos se dibujan mediante el programa GraphPad 9.0® (GraphPad Software, San Diego, California, EE. UU., www.graphpad.com). Se consideró estadísticamente significativo un valor de p < 0,05.
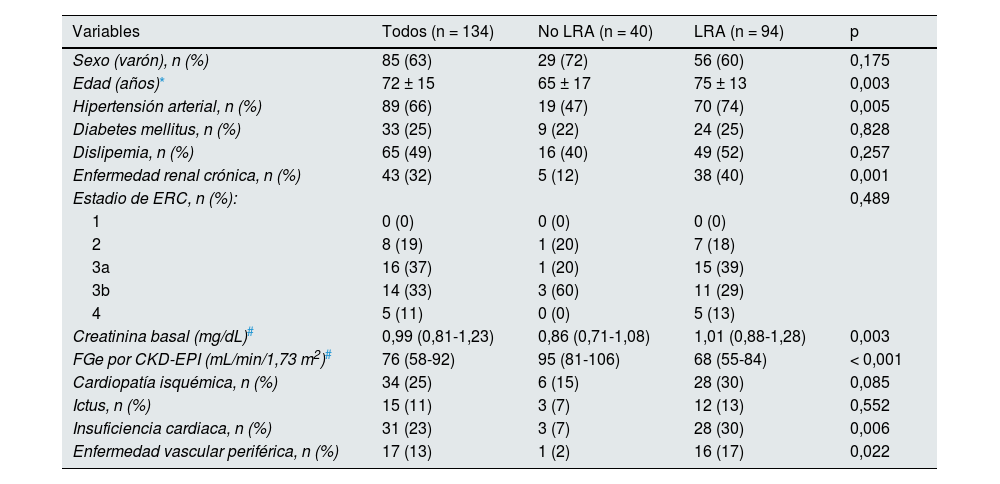
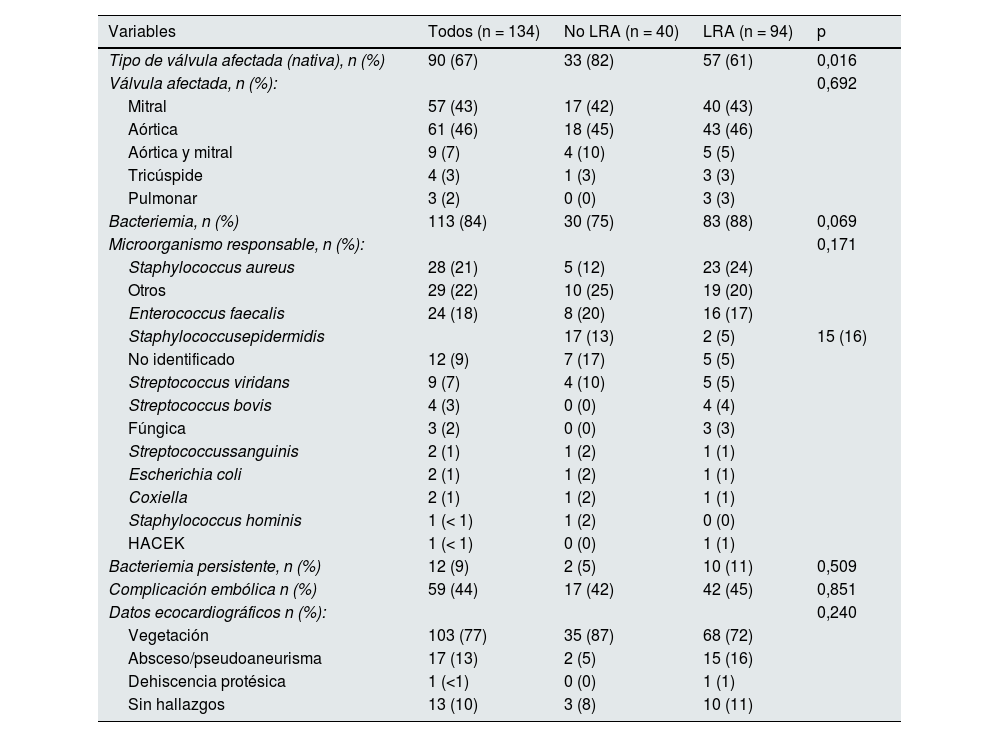
ResultadosCaracterísticas basalesSe incluyó a 134 pacientes (85 varones [63%], edad media 72 ± 15 años). Basalmente, 43 pacientes (32%) tenía una enfermedad renal crónica distribuida en los siguientes estadios: ocho (19%) pacientes estadio 2, 16 (37%) estadio 3a, 14 (33%) estadio 3b y cinco (11%) estadio 4. El filtrado glomerular estimado (FGe) basal fue 76 (58-92) mL/min/1,73 m2 (tabla 1).
Características basales de los pacientes incluidos
| Variables | Todos (n = 134) | No LRA (n = 40) | LRA (n = 94) | p |
|---|---|---|---|---|
| Sexo (varón), n (%) | 85 (63) | 29 (72) | 56 (60) | 0,175 |
| Edad (años)* | 72 ± 15 | 65 ± 17 | 75 ± 13 | 0,003 |
| Hipertensión arterial, n (%) | 89 (66) | 19 (47) | 70 (74) | 0,005 |
| Diabetes mellitus, n (%) | 33 (25) | 9 (22) | 24 (25) | 0,828 |
| Dislipemia, n (%) | 65 (49) | 16 (40) | 49 (52) | 0,257 |
| Enfermedad renal crónica, n (%) | 43 (32) | 5 (12) | 38 (40) | 0,001 |
| Estadio de ERC, n (%): | 0,489 | |||
| 1 | 0 (0) | 0 (0) | 0 (0) | |
| 2 | 8 (19) | 1 (20) | 7 (18) | |
| 3a | 16 (37) | 1 (20) | 15 (39) | |
| 3b | 14 (33) | 3 (60) | 11 (29) | |
| 4 | 5 (11) | 0 (0) | 5 (13) | |
| Creatinina basal (mg/dL)# | 0,99 (0,81-1,23) | 0,86 (0,71-1,08) | 1,01 (0,88-1,28) | 0,003 |
| FGe por CKD-EPI (mL/min/1,73 m2)# | 76 (58-92) | 95 (81-106) | 68 (55-84) | < 0,001 |
| Cardiopatía isquémica, n (%) | 34 (25) | 6 (15) | 28 (30) | 0,085 |
| Ictus, n (%) | 15 (11) | 3 (7) | 12 (13) | 0,552 |
| Insuficiencia cardiaca, n (%) | 31 (23) | 3 (7) | 28 (30) | 0,006 |
| Enfermedad vascular periférica, n (%) | 17 (13) | 1 (2) | 16 (17) | 0,022 |
De los 134 casos de endocarditis, 90 (67%) ocurrieron sobre válvula nativa. La afectación valvular más frecuente fue aórtica (46%) seguido de mitral (43%). Los organismos implicados más habituales fueron los cocos grampositivos (Staphylococcusaureus en el 21%, Enterococcusfaecalis en el 18% y Staphylococcusepidermidis en el 13%). En 59 pacientes (44%) se evidenció algún tipo de complicación embolica (27% múltiples embolismos, 44% ictus). En 12 pacientes (9%) hubo bacteriemia persistente (tabla 2). Se realizó una intervención quirúrgica en 62 (47%) pacientes.
Características de la endocarditis infecciosa de los pacientes incluidos
| Variables | Todos (n = 134) | No LRA (n = 40) | LRA (n = 94) | p |
|---|---|---|---|---|
| Tipo de válvula afectada (nativa), n (%) | 90 (67) | 33 (82) | 57 (61) | 0,016 |
| Válvula afectada, n (%): | 0,692 | |||
| Mitral | 57 (43) | 17 (42) | 40 (43) | |
| Aórtica | 61 (46) | 18 (45) | 43 (46) | |
| Aórtica y mitral | 9 (7) | 4 (10) | 5 (5) | |
| Tricúspide | 4 (3) | 1 (3) | 3 (3) | |
| Pulmonar | 3 (2) | 0 (0) | 3 (3) | |
| Bacteriemia, n (%) | 113 (84) | 30 (75) | 83 (88) | 0,069 |
| Microorganismo responsable, n (%): | 0,171 | |||
| Staphylococcus aureus | 28 (21) | 5 (12) | 23 (24) | |
| Otros | 29 (22) | 10 (25) | 19 (20) | |
| Enterococcus faecalis | 24 (18) | 8 (20) | 16 (17) | |
| Staphylococcusepidermidis | 17 (13) | 2 (5) | 15 (16) | |
| No identificado | 12 (9) | 7 (17) | 5 (5) | |
| Streptococcus viridans | 9 (7) | 4 (10) | 5 (5) | |
| Streptococcus bovis | 4 (3) | 0 (0) | 4 (4) | |
| Fúngica | 3 (2) | 0 (0) | 3 (3) | |
| Streptococcussanguinis | 2 (1) | 1 (2) | 1 (1) | |
| Escherichia coli | 2 (1) | 1 (2) | 1 (1) | |
| Coxiella | 2 (1) | 1 (2) | 1 (1) | |
| Staphylococcus hominis | 1 (< 1) | 1 (2) | 0 (0) | |
| HACEK | 1 (< 1) | 0 (0) | 1 (1) | |
| Bacteriemia persistente, n (%) | 12 (9) | 2 (5) | 10 (11) | 0,509 |
| Complicación embólica n (%) | 59 (44) | 17 (42) | 42 (45) | 0,851 |
| Datos ecocardiográficos n (%): | 0,240 | |||
| Vegetación | 103 (77) | 35 (87) | 68 (72) | |
| Absceso/pseudoaneurisma | 17 (13) | 2 (5) | 15 (16) | |
| Dehiscencia protésica | 1 (<1) | 0 (0) | 1 (1) | |
| Sin hallazgos | 13 (10) | 3 (8) | 10 (11) |
HACEK: especies de Haemophilus, Aggregatibacter actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens, Kingella kingae; LRA: lesión renal aguda.
De total de los pacientes incluidos, 94 (70%) presentaron una LRA (47 [50%] tuvieron un AKIN-1, 27 [29%] un AKIN-2 y 20 [21%] un AKIN-3). La etiología de la LRA fue en 72 pacientes (77%) funcional, en 11 (12%) secundaria a una NTA, en uno (1%) debido a una nefritis tubulointersticial y en nueve (10%) por múltiples causas. Únicamente disponíamos datos de una biopsia renal, que fue la que demostró la nefritis tubulointersticial como causa etiológica de la LRA; en el resto de los casos el diagnóstico fue clínico.
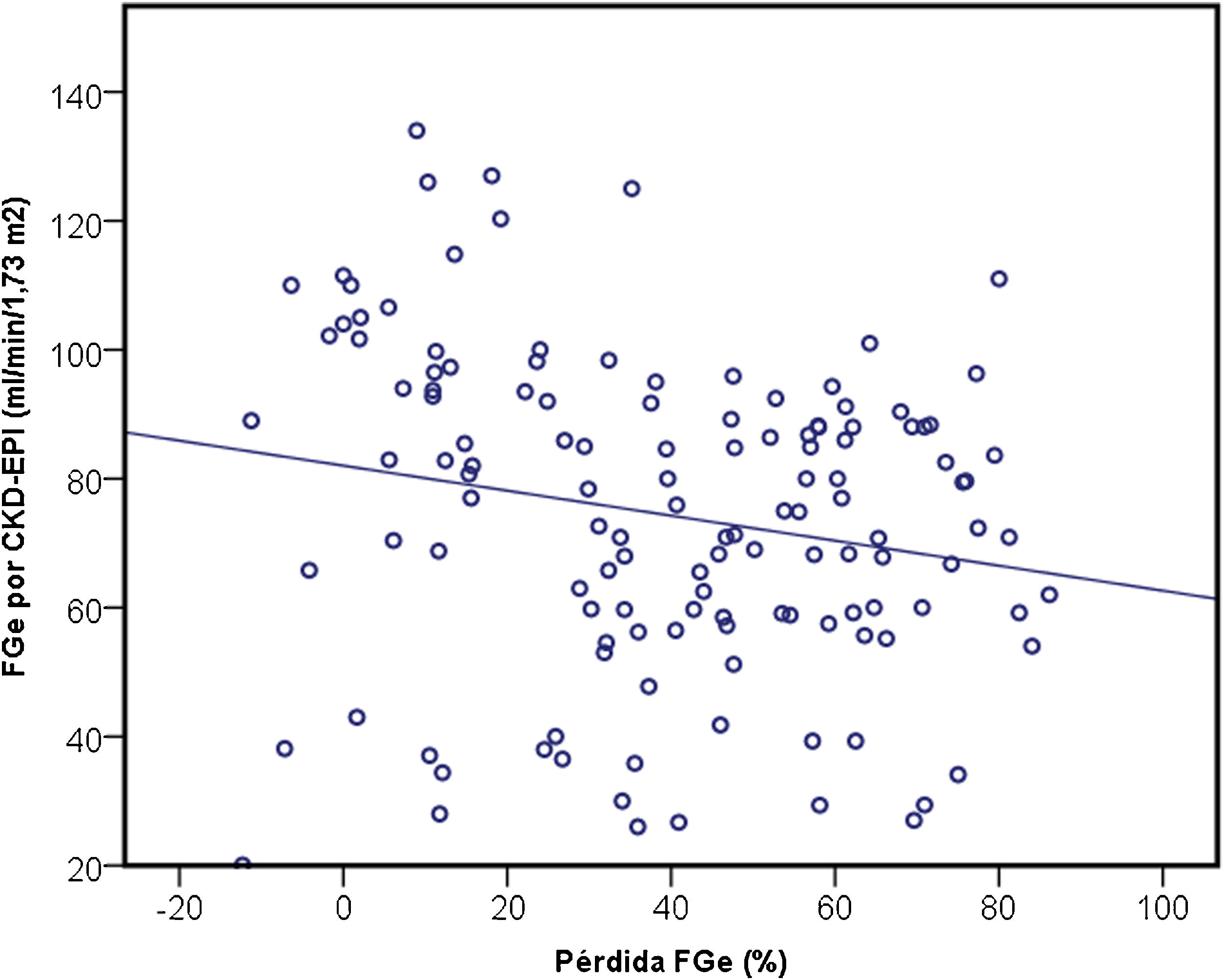
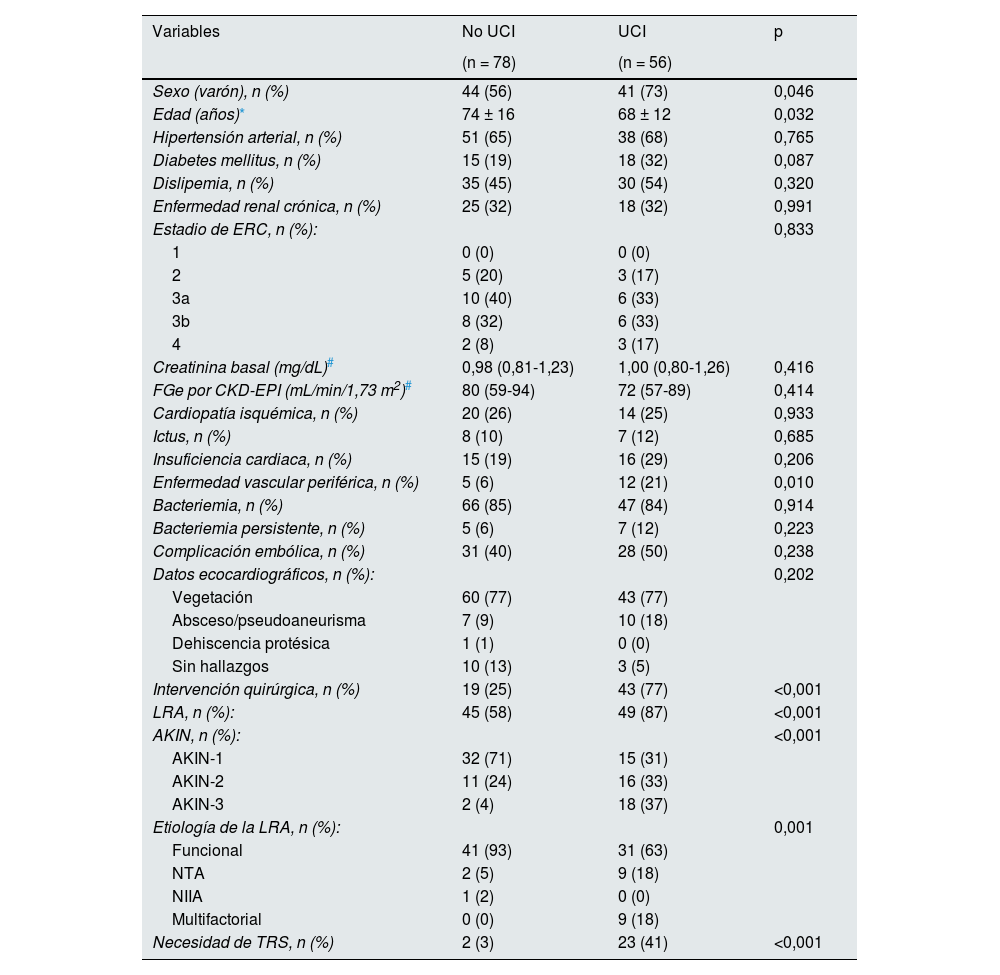
La mediana de pérdida de FGe por CKD-EPI fue 40 (16-61) %. La pérdida porcentual de FGe se correlacionó positivamente con el FGe basal (r = -0,226, p = 0,009) (fig. 1). Durante la hospitalización, 56 (42%) pacientes requirieron ingreso en la Unidad de Cuidados Intensivos (UCI) y 25 pacientes (19%) precisaron de terapia de reemplazo renal, siendo esta situación más frecuente en los pacientes con necesidad de UCI (p < 0,001) (tabla 3). Otros factores asociados a la necesidad de ingreso en UCI fueron ser varón (p = 0,046), la edad (p = 0,032), presentar enfermedad vascular periférica (p = 0,010), la necesidad de una intervención quirúrgica (p < 0,001), el desarrollo de una LRA p < 0,001), la gravedad de la LRA (p < 0,001), y la etiología de LRA (p < 0,001) (tabla 3).
Factores asociados a necesidad de ingreso en la Unidad de Cuidados Intensivos (UCI)
| Variables | No UCI | UCI | p |
|---|---|---|---|
| (n = 78) | (n = 56) | ||
| Sexo (varón), n (%) | 44 (56) | 41 (73) | 0,046 |
| Edad (años)* | 74 ± 16 | 68 ± 12 | 0,032 |
| Hipertensión arterial, n (%) | 51 (65) | 38 (68) | 0,765 |
| Diabetes mellitus, n (%) | 15 (19) | 18 (32) | 0,087 |
| Dislipemia, n (%) | 35 (45) | 30 (54) | 0,320 |
| Enfermedad renal crónica, n (%) | 25 (32) | 18 (32) | 0,991 |
| Estadio de ERC, n (%): | 0,833 | ||
| 1 | 0 (0) | 0 (0) | |
| 2 | 5 (20) | 3 (17) | |
| 3a | 10 (40) | 6 (33) | |
| 3b | 8 (32) | 6 (33) | |
| 4 | 2 (8) | 3 (17) | |
| Creatinina basal (mg/dL)# | 0,98 (0,81-1,23) | 1,00 (0,80-1,26) | 0,416 |
| FGe por CKD-EPI (mL/min/1,73 m2)# | 80 (59-94) | 72 (57-89) | 0,414 |
| Cardiopatía isquémica, n (%) | 20 (26) | 14 (25) | 0,933 |
| Ictus, n (%) | 8 (10) | 7 (12) | 0,685 |
| Insuficiencia cardiaca, n (%) | 15 (19) | 16 (29) | 0,206 |
| Enfermedad vascular periférica, n (%) | 5 (6) | 12 (21) | 0,010 |
| Bacteriemia, n (%) | 66 (85) | 47 (84) | 0,914 |
| Bacteriemia persistente, n (%) | 5 (6) | 7 (12) | 0,223 |
| Complicación embólica, n (%) | 31 (40) | 28 (50) | 0,238 |
| Datos ecocardiográficos, n (%): | 0,202 | ||
| Vegetación | 60 (77) | 43 (77) | |
| Absceso/pseudoaneurisma | 7 (9) | 10 (18) | |
| Dehiscencia protésica | 1 (1) | 0 (0) | |
| Sin hallazgos | 10 (13) | 3 (5) | |
| Intervención quirúrgica, n (%) | 19 (25) | 43 (77) | <0,001 |
| LRA, n (%): | 45 (58) | 49 (87) | <0,001 |
| AKIN, n (%): | <0,001 | ||
| AKIN-1 | 32 (71) | 15 (31) | |
| AKIN-2 | 11 (24) | 16 (33) | |
| AKIN-3 | 2 (4) | 18 (37) | |
| Etiología de la LRA, n (%): | 0,001 | ||
| Funcional | 41 (93) | 31 (63) | |
| NTA | 2 (5) | 9 (18) | |
| NIIA | 1 (2) | 0 (0) | |
| Multifactorial | 0 (0) | 9 (18) | |
| Necesidad de TRS, n (%) | 2 (3) | 23 (41) | <0,001 |
Mediana (rango intercuartílico).
FGe: filtrado glomerular estimado; ERC: enfermedad renal crónica; CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; LRA: lesión renal aguda; AKIN: acute kidney injury network; TRS: terapia renal sustitutiva; NTA: necrosis tubular aguda; NIIA: nefritis tubulointersticial aguda.
Los factores asociados a presentar una LRA fueron la edad (p = 0,03), la hipertensión arterial (p = 0,005), la enfermedad renal crónica (p = 0,001), el FGe basal (p < 0,001), la creatinina basal (p = 0,003), el antecedente de insuficiencia cardiaca (p = 0,006) y enfermedad vascular periférica (p = 0,022) (tabla 1). El único predictor independiente para presentar una LRA fue el FGe basal (odds ratio [OR] 0,940, intervalo de confianza del 95% [IC 95%] 0,906-0,975, p = 0,001) en un modelo ajustado para la edad y las diferentes comorbilidades (hipertensión arterial, ERC, ictus, enfermedad vascular periférica e insuficiencia cardiaca).
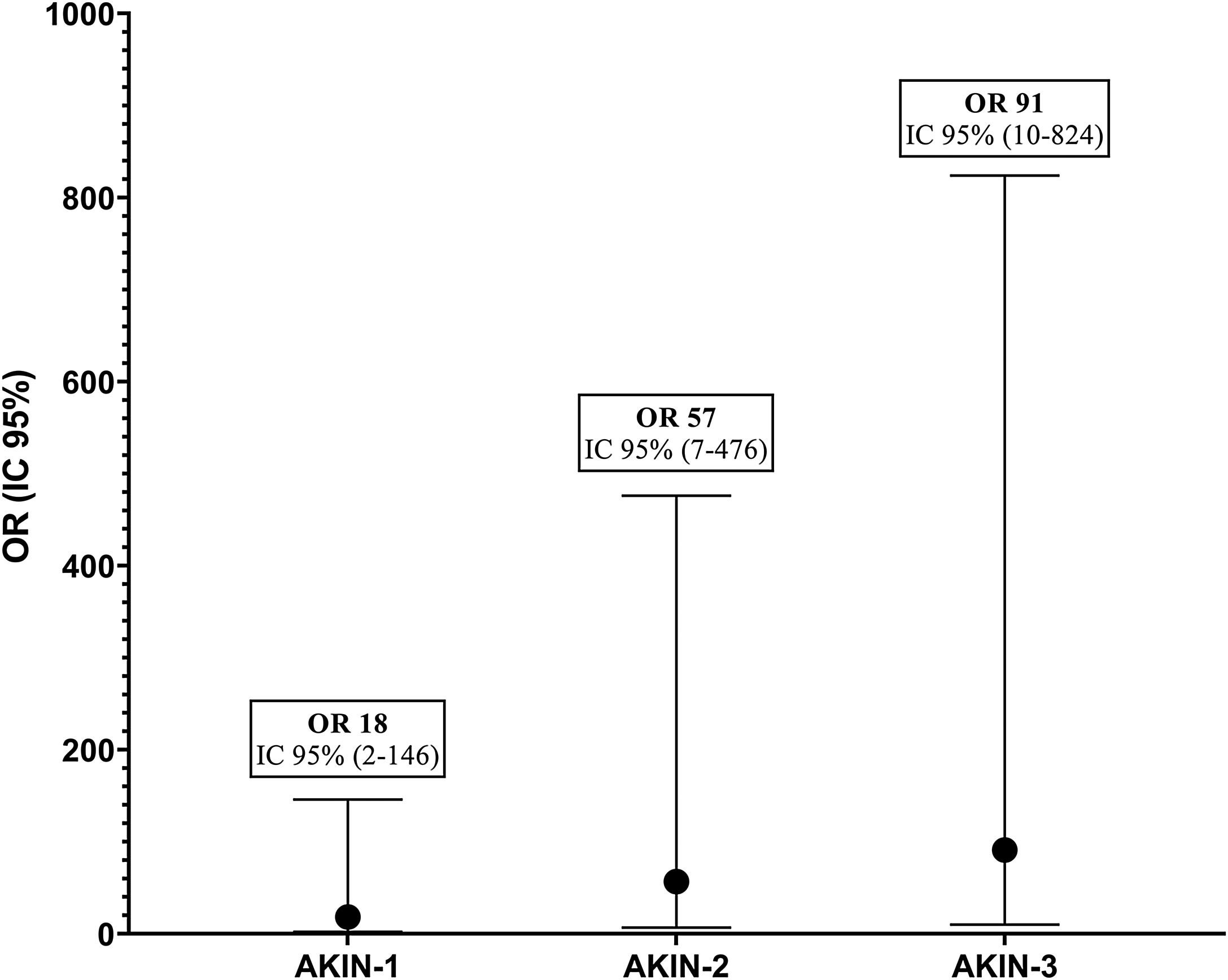
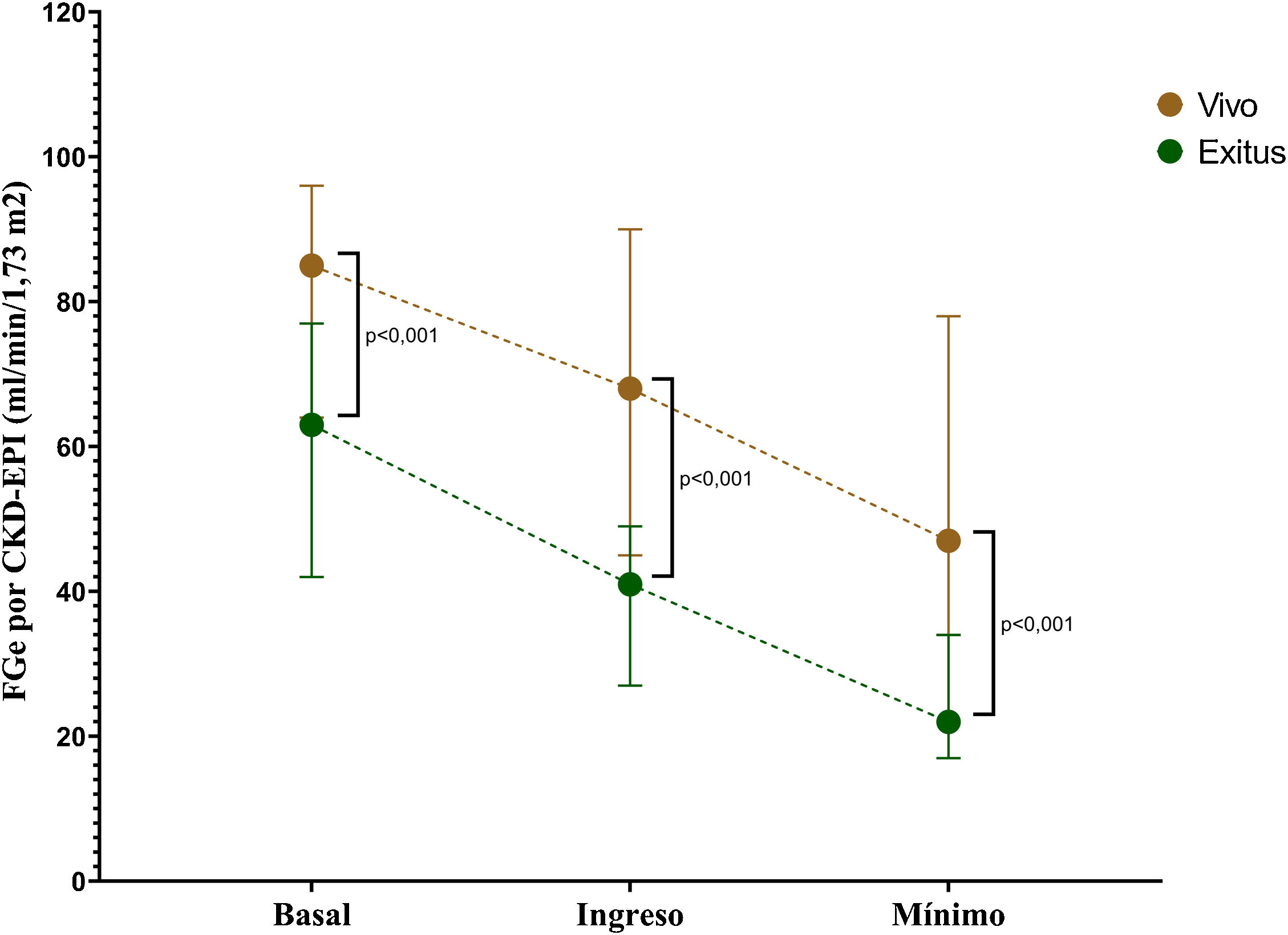
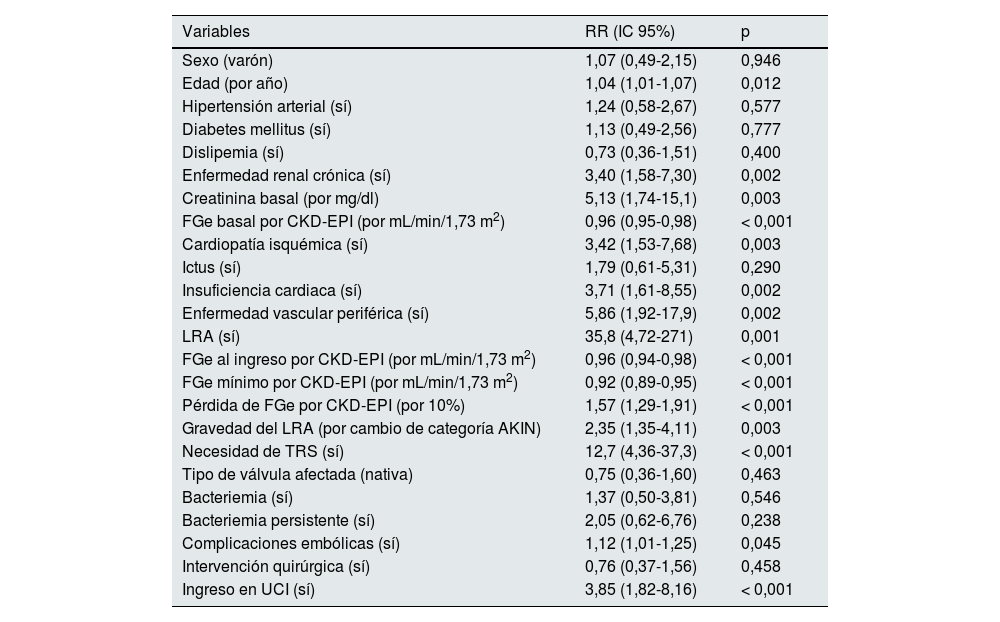
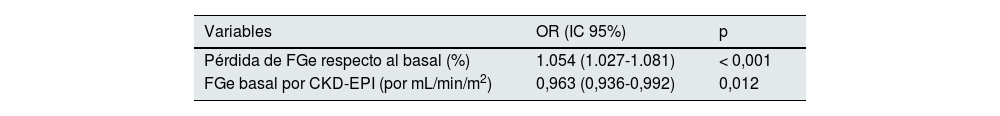
Factores asociados a mortalidadDurante la hospitalización fallecieron 46 (34%) pacientes. De los 46 pacientes, 45 (98%) habían desarrollado algún grado de LRA (p = 0,001). Los factores asociados a mortalidad fueron la edad (p = 0,012), la enfermedad renal crónica (p = 0,002), el FGe basal (p < 0,001), la creatinina basal (p = 0,003), el antecedente de cardiopatía isquémica (p = 0,003), de insuficiencia cardiaca (p = 0,002), la enfermedad vascular periférica (p = 0,002), el FGe al ingreso (p < 0,001), el FGe mínimo durante el episodio (p < 0,001), la pérdida de FGe (p < 0,001), la gravedad de la LRA (p = 0,003), la necesidad de terapia renal sustitutiva (TRS) (p < 0,001) y la necesidad de ingreso en UCI (p < 0,001) (tabla 4). Se construyeron diferentes modelos de regresión logística ajustados en los que se evidenció la capacidad predictora independiente de la LRA para mortalidad tras una endocarditis (tabla 5). La gravedad de la LRA se asoció a mortalidad, siendo esta mayor, cuanto mayor era el índice AKIN (fig. 2). Se realizó un análisis de sensibilidad en el que se determinó que, ajustado para edad, sexo y FGe en el momento del ingreso, la pérdida de FGe y el FGe basal se asociaron independientemente a una mayor mortalidad (tabla 6). En cualquier punto del seguimiento, encontramos diferencias en el FGe entre los pacientes que fallecieron y los que no (fig. 3).
Factores asociados a mortalidad por endocarditis infecciosa
| Variables | RR (IC 95%) | p |
|---|---|---|
| Sexo (varón) | 1,07 (0,49-2,15) | 0,946 |
| Edad (por año) | 1,04 (1,01-1,07) | 0,012 |
| Hipertensión arterial (sí) | 1,24 (0,58-2,67) | 0,577 |
| Diabetes mellitus (sí) | 1,13 (0,49-2,56) | 0,777 |
| Dislipemia (sí) | 0,73 (0,36-1,51) | 0,400 |
| Enfermedad renal crónica (sí) | 3,40 (1,58-7,30) | 0,002 |
| Creatinina basal (por mg/dl) | 5,13 (1,74-15,1) | 0,003 |
| FGe basal por CKD-EPI (por mL/min/1,73 m2) | 0,96 (0,95-0,98) | < 0,001 |
| Cardiopatía isquémica (sí) | 3,42 (1,53-7,68) | 0,003 |
| Ictus (sí) | 1,79 (0,61-5,31) | 0,290 |
| Insuficiencia cardiaca (sí) | 3,71 (1,61-8,55) | 0,002 |
| Enfermedad vascular periférica (sí) | 5,86 (1,92-17,9) | 0,002 |
| LRA (sí) | 35,8 (4,72-271) | 0,001 |
| FGe al ingreso por CKD-EPI (por mL/min/1,73 m2) | 0,96 (0,94-0,98) | < 0,001 |
| FGe mínimo por CKD-EPI (por mL/min/1,73 m2) | 0,92 (0,89-0,95) | < 0,001 |
| Pérdida de FGe por CKD-EPI (por 10%) | 1,57 (1,29-1,91) | < 0,001 |
| Gravedad del LRA (por cambio de categoría AKIN) | 2,35 (1,35-4,11) | 0,003 |
| Necesidad de TRS (sí) | 12,7 (4,36-37,3) | < 0,001 |
| Tipo de válvula afectada (nativa) | 0,75 (0,36-1,60) | 0,463 |
| Bacteriemia (sí) | 1,37 (0,50-3,81) | 0,546 |
| Bacteriemia persistente (sí) | 2,05 (0,62-6,76) | 0,238 |
| Complicaciones embólicas (sí) | 1,12 (1,01-1,25) | 0,045 |
| Intervención quirúrgica (sí) | 0,76 (0,37-1,56) | 0,458 |
| Ingreso en UCI (sí) | 3,85 (1,82-8,16) | < 0,001 |
RR (IC 95%): riesgo relativo (intervalo de confianza al 95%); LRA: lesión renal agudo; AKIN: acute kidney injury network; FGe: filtrado glomerular estimado; CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; TRS: terapia renal sustitutiva.
Modelos de regresión logística ajustada para determinar la capacidad predictora independiente de la lesión renal aguda (LRA) en mortalidad por endocarditis infecciosa
| Variables | OR (IC 95%) | p |
|---|---|---|
| Modelo 1 (ajustado para edad y sexo) | ||
| LRA (sí) | 32 (4-245) | 0,001 |
| Modelo 2 (ajustado para edad, sexo y FGe de base) | ||
| LRA (sí) | 23 (3-181) | 0,003 |
| Modelo 3 (ajustado para edad, sexo y comorbilidades*) | ||
| LRA (sí) | 28 (4-228) | 0,002 |
| Modelo 4 (ajustado para edad, sexo y complicaciones de la endocarditisa) | ||
| LRA (sí) | 34 (4-273) | 0,001 |
| Modelo 5 (ajustado para edad, sexo e ingreso en UCI) | ||
| LRA (sí) | 20 (3-161) | 0,004 |
LRA: lesión renal aguda; OR (IC 95%): odds ratio (intervalo de confianza al 95%); FGe: filtrado glomerular estimado; UCI: Unidad de Cuidados Intensivos.
Asociación entre gravedad de la LRA evaluada por la escala AKIN y mortalidad tras un episodio de endocarditis.
FGe: filtrado glomerular estimado; CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; OR: odds ratio; IC 95%: intervalo de confianza al 95%; AKIN: acute kidney injury network.
Regresión logística ajustada a edad, sexo y FGe por CKD-EPI en el momento del ingreso para mortalidad por endocarditis infecciosa
| Variables | OR (IC 95%) | p |
|---|---|---|
| Pérdida de FGe respecto al basal (%) | 1.054 (1.027-1.081) | < 0,001 |
| FGe basal por CKD-EPI (por mL/min/m2) | 0,963 (0,936-0,992) | 0,012 |
FGe: filtrado glomerular estimado; CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; OR (IC 95%): odds ratio (intervalo de confianza al 95%).
Nuestro estudio evalúa el impacto pronóstico de la LRA en el pronóstico de la endocarditis infecciosa, presentando dos conclusiones relevantes. En primer lugar, la elevada incidencia de LRA en el seno de una hospitalización por endocarditis infecciosa (hasta 70%), lo que concuerda con las series publicadas más pesimistas4. En segundo lugar, la elevada mortalidad que acarrea el desarrollo de una LRA y cómo la gravedad de la misma (graduada con la escala AKIN y por la pérdida de FGe) se correlaciona con un peor pronóstico. De hecho, la necesidad de TRS se asoció a una probabilidad de fallecer 12 veces superior frente a aquellos que no la precisaron. Esta situación no es de extrañar puesto que a la inmunodeficiencia inherente de la LRA se añaden las propias complicaciones de la TRS tales como el uso de vías centrales, la necesidad anticoagulación o las alteraciones hemodinámicas16.
El desarrollo de una endocarditis infecciosa es una situación potencialmente letal y, que tal y como se observa en nuestro estudio, se acompaña de importantes complicaciones como el desarrollo de bacteriemia en 84% de los pacientes y de embolismos sistémicos en 44%, lo que condiciona una elevada tasa de LRA, ingreso en UCI y de mortalidad. De todas las consecuencias, el desarrollo e impacto de la LRA en el pronóstico de la endocarditis ha sido poco estudiado hasta la fecha. En ese contexto, el estudio más potente realizado hasta la fecha es un registro que analiza a más de 7.000 pacientes con diagnóstico de endocarditis. De ellos, 5,7% precisan de TRS durante el ingreso lo que incidió significativamente en la mortalidad17. Más allá de los pacientes que precisan TRS, nuestros datos demuestran que incluso una LRA AKIN-1 se asocia a una elevada mortalidad de hasta 18 veces superior, lo que obliga a monitorizar estrechamente a todos los pacientes que presenten cualquier grado de disfunción renal con una detección lo más precoz posible18. Si bien es cierto que el marcador universalmente utilizado para el manejo de la LRA es la creatinina, sabemos de sus extensas limitaciones, incluyendo el retraso en el diagnóstico y, consecuentemente, el impacto pronóstico. Hasta la fecha muy pocos trabajos han incluido marcadores diferentes a la creatinina (por ejemplo, cistatina C o neutrophil gelatinase-associated lipocalin [NGAL]), estudiando su asociación con el pronóstico de la endocarditis, pero sin profundizar en un diagnóstico precoz de la LRA19,20. Quizá la utilización seleccionada de estos biomarcadores podría potenciar un diagnóstico precoz de la LRA que eventualmente mejorara el pronóstico. Algunas medidas incluirían la utilización de antibióticos no nefrotóxicos, el ajuste de la medicación a la función renal, la realización de pruebas encaminadas a un diagnóstico etiológico preciso (estudios de inmunidad, biopsia renal) o la optimización del volumen6,21. De hecho, en nuestra serie a sólo un paciente se le realizó una biopsia renal durante el episodio. Esta situación, aunque concuerda con datos de la literatura y se contextualiza en la situación clínica del paciente, debe hacernos reflexionar sobre la necesidad de realizar un diagnóstico correcto a través de un procedimiento con un bajo índice riesgo/beneficio22.
Dentro de los factores asociados a presentar una LRA, nuestro estudio demuestra que las comorbilidades cardiovasculares y renales son las más relevantes. En esa línea, el único predictor independiente de presentar una LRA fue el FGe basal, lo que en la práctica habitual es sencillo de determinar universalmente y podría ser incluido como un parámetro de gravedad facilitando la detección de pacientes de alto riesgo de complicaciones. Actualmente se ha profundizado muy poco en la predicción pronóstica de los pacientes con endocarditis, existiendo apenas un estudio que evalúa el Sepsis related Organ Failure Assessment score (SOFA) (que incluye la diuresis y la creatinina) como puntuación, pero sin modificaciones específicas de los mismos para la endocarditis23.
En cuanto al pronóstico vital durante la hospitalización, las endocarditis presentan una mortalidad que alcanza hasta 25%2. Los factores clásicamente asociados con el desarrollo y gravedad de las endocarditis infecciosas incluyen la edad, el desarrollo de insuficiencia cardiaca y las comorbilidades basales2,24. Nuestros datos muestran como más allá de las comorbilidades, el desarrollo de una LRA predice de manera independiente la mortalidad. De hecho, los propios factores relacionados con la infección (presencia de bacteriemia, válvula afectada, necesidad de intervención quirúrgica) apenas muestran una relación con el pronóstico vital y tan solo la necesidad de ingreso en UCI presenta una asociación llamativa con la mortalidad, lo que debe entenderse como un marcador de gravedad de la infección y de una peor situación basal. Por lo tanto, la situación basal de los pacientes (incluyendo la función renal previa al episodio), pero también la evolución de la misma puede ayudar a establecer el riesgo de mortalidad tras el desarrollo de una endocarditis. A este respecto, algunos autores han mostrado como en la individualización es muy relevante a la hora de seleccionar a los pacientes candidatos a cirugía valvular. Con la reciente disponibilidad de técnicas percutáneas, numerosos pacientes frágiles o con elevados índices de comorbilidad que antes eran excluidos de las cirugías, ahora pueden ser sometidos a reparaciones o recambios valvulares25,26. Nuestros resultados invitan a utilizar la función renal como marcador pronóstico, y, por tanto, como dato a incluir en las escalas de riesgo.
Nuestro estudio no está exento de limitaciones. En primer lugar, su diseño retrospectivo que limita la disponibilidad de algunos datos de los pacientes incluidos entre los que se incluyen los parámetros urinarios que no fueron solicitados en muchos casos. Esta limitación se explica sobre todo por el amplio porcentaje de pacientes (80%) que no desarrollaron LRA o presentaron un AKIN-1 y que probablemente no fueron valorados por un nefrólogo y en los que no se dio trascendencia al deterioro de función renal. Segundo, el tamaño muestral no es excesivamente extenso debido al carácter unicéntrico del estudio. Esta limitación se ha visto parcialmente compensada por el cumplimiento de los objetivos del estudio, que pretendía demostrar el impacto de la LRA en la mortalidad por endocarditis infecciosa. Tercero, disponemos de pocos datos histopatológicos renales, probablemente porque sistemáticamente la LRA en una endocarditis se achaca a una etiología funcional, tóxica o isquémica. Aunque esto no debe ser interpretado como una limitación general del estudio, sí es de importancia en los casos dudosos en los que se pueda aplicar algún tratamiento concreto. Finalmente, 50% de los pacientes presentan una LRA AKIN-1, lo que probablemente ha condicionado que no se consulte a un nefrólogo. La posibilidad de que se consulte a nefrología cuando se produce una LRA, aunque esta sea leve, es complicado desde el punto de vista logístico, pero debe ser entendido como una limitación de los sistemas sanitarios. De hecho, los sistemas de alertas electrónicas de detección de LRA han demostrado su efectividad en el pronóstico de los pacientes hospitalizados por cualquier razón, lo que invita a pensar en el beneficio de un manejo precoz por un especialista27.
En conclusión, el desarrollo de una LRA en el seno de una endocarditis infecciosa impacta en la mortalidad, siendo esta mayor cuanto mayor gravedad presente el deterioro de función renal. En el manejo de la endocarditis, la monitorización de función renal puede ayudar a detectar precozmente a los pacientes que presenten una peor evolución.
ÉticaEl presente estudio ha sido aprobado por el Comité de Ética de la Investigación con medicamentos (CEim) del Hospital Universitario de la Princesa (24-03-22, acta CEIm 06/22).
FinanciaciónEl estudio no ha sido financiado.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.