Las vesículas extracelulares (VEs) reflejan el estado fisiopatológico de sus células de origen y constituyen un reservorio de información renal accesible en la orina. Cuando la biopsia no es una opción, las VEs se presentan como un centinela de funcionalidad y daño, constituyendo una aproximación no invasiva. Sin embargo, el análisis de las VEs de la orina requiere de un aislamiento previo que ralentiza y dificulta su traslación a la práctica clínica. El objetivo de este trabajo es mostrar la aplicabilidad de la tecnología «sensor de imágenes de reflectancia interferométrica de una sola partícula» (SP-IRIS) mediante la plataforma ExoView® para el análisis directo de las VEs de la orina y de proteínas implicadas en funcionalidad renal.
Materiales y métodosLa tecnología ExoView® permite la cuantificación y el fenotipado de las VEs presentes en la orina y la cuantificación de sus proteínas, de membrana e internas. En este trabajo se aplica esta tecnología a la cuantificación de las VEs de la orina y de sus proteínas con expresión renal tubular, amnionless (AMN) y secreted frizzled-related protein 1 (SFRP1), empleando únicamente 5μl de orina. La expresión tubular se confirmó por inmunohistoquímica.
ResultadosEl tamaño medio de las VEs analizadas fue de 59±16nm para las capturadas por la tetraspanina CD63, 61±16nm para las capturadas por la tetraspanina CD81 y 59±10 nm para la tetraspanina CD9, siendo CD63 la subpoblación de VEs mayoritaria en la orina (48,92%). La distribución de AMN y SFRP1 en las 3 tetraspaninas de captura resultó ser similar para ambas proteínas, expresándose mayoritariamente en CD63 (48,23% para AMN y 52,1% para SFRP1).
ConclusionesEste trabajo evidencia la aplicabilidad y las ventajas de la técnica ExoView® para el análisis directo de las VEs de la orina, y su cargo proteico en relación con el túbulo renal. El empleo de volúmenes mínimos, 5μl, y el tiempo total de análisis no superior a 3h facilita la traslación a la práctica clínica diaria de las VEs como fuente de información diagnóstica.
Extracellular vesicles (EVs) reflect the pathophysiological state of their cells of origin and are a reservoir of renal information accessible in urine. When biopsy is not an option, EVs present themselves as sentinels of function and damage, providing a non-invasive approach. However, the analysis of EVs in urine requires prior isolation, which slows down and hinders translation to clinical practice. The aim of this study is to show the applicability of the “single particle interferometric reflectance imaging sensor” (SP-IRIS) technology through the ExoView® platform for the direct analysis of urine EVs and proteins involved in renal function.
Materials and methodsThe ExoView® technology enables the quantification and phenotyping of EVs present in urine and the quantification of their membrane and internal proteins. We have applied this technology to the quantification of urinary EVs and their proteins with renal tubular expression, amnionless (AMN) and secreted frizzled-related protein 1 (SFRP1), using only 5μl of urine. Tubular expression was confirmed by immunohistochemistry.
ResultsThe mean size of the EVs analysed was 59±16nm for those captured by tetraspanin CD63, 61±16nm for those captured by tetraspanin CD81, and 59±10 nm for tetraspanin CD9, with CD63 being the majority EVs subpopulation in urine (48.92%). The distribution of AMN and SFRP1 in the three capture tetraspanins turned out to be similar for both proteins, being expressed mainly in CD63 (48.23% for AMN and 52.1% for SFRP1).
ConclusionsThis work demonstrates the applicability and advantages of the ExoView® technique for the direct analysis of urine EVs and their protein content in relation to the renal tubule. The use of minimum volumes, 5μl, and the total analysis time not exceeding three hours facilitate the translation of EVs to daily clinical practice as source of diagnostic information.
Las vesículas extracelulares (VEs) son un reflejo del contenido y del estado fisiopatológico de las células donde se originan y constituyen, por tanto, un nicho de estudio de gran potencial en la práctica clínica. Contienen ácidos nucleicos, proteínas, metabolitos y lípidos que son capaces de transferir a otras células desde la célula de origen, mediando así la comunicación celular1. Inicialmente consideradas como un producto de desecho celular, el interés de las VEs ha ido en aumento en los últimos años. Particularmente, cuando el tejido (biopsia) es inaccesible en procedimientos clínicos rutinarios, las VEs se convierten en un centinela de funcionalidad y daño, siendo también un reservorio muy valioso de biomarcadores de obtención no invasiva2–4. Su interés radica, además, en que no solo son comunicadores intercelulares de mayor o menor proximidad, sino que migrando a través de la sangre son también mediadores entre órganos y sistemas del organismo. Además, dada su capacidad de ser internalizadas por células diana, más recientemente se han propuesto como vehículos de acción terapéutica para activar o inhibir mecanismos de interés una vez funcionalizado su cargo5,6.
En el contexto nefrológico, las VEs presentes en la orina reflejan el estado fisio(pato)lógico del riñón, y son intercomunicadores dentro del glomérulo, del túbulo, entre ambas estructuras funcionales y en el espacio túbulo intersticial7,8. En 2004, se evidenció por primera vez la presencia de proteínas del sistema renal en las VEs de la orina por espectrometría de masas9. Estudios posteriores mediante aproximaciones ómicas han confirmado esta presencia y la correlación existente entre los niveles de proteína detectados en las VEs y en el riñón10. Diversos estudios centrados en fracaso renal agudo, enfermedad renal poliquística, enfermedad glomerular y tubulopatías han demostrado su potencial como fuente no invasiva de biomarcadores, evidenciando cómo su excreción y/o contenido están condicionados por la masa nefronal11. Por tanto, es claro que el análisis de las VEs de la orina permite acceder a alteraciones moleculares que están ocurriendo en el riñón, sin necesidad de realizar una biopsia12. Dichas alteraciones podrían incluso reflejar un daño orgánico subclínico y, por tanto, no detectable en análisis rutinarios de seguimiento o diagnóstico. Aparte de su interés biológico, a nivel metodológico el estudio de las VEs de orina cuenta con una gran ventaja respecto a un análisis directo de la orina, ya que pacientes con altos niveles de proteinuria verán enmascaradas proteínas de interés por estar en niveles bajos de abundancia respecto a las mayoritarias (como es en ese caso la albúmina). Sin embargo, las proteínas presentes en las VEs (citosólicas y de membrana) purificadas adecuadamente, al representar a sus células de origen, verán dicha interferencia eliminada aumentando así las posibilidades de cuantificar proteínas en bajos niveles de abundancia y de acceder a nuevos biomarcadores13.
El principal inconveniente para implementar su aplicación diagnóstica en la práctica clínica en un futuro próximo es que su análisis implica un paso previo de aislamiento, que habitualmente se realiza por ultracentrifugación o cromatografía de exclusión por tamaño, y que supone potenciales alteraciones de la muestra y largos tiempos de análisis, imposibilitando así la traslación directa. De reciente aparición, la tecnología SP-IRIS establecida en el equipo ExoView® (Unchained labs, EE. UU.) permite la cuantificación y el fenotipado directo de las VEs presentes en cualquier fluido diagnóstico, a la par que la cuantificación de biomarcadores proteicos localizados tanto en su membrana como en el interior14,15. Su principal ventaja radica, por tanto, en realizar el análisis de las VEs directamente en el fluido biológico de interés sin aislamiento previo. Además, lo hará empleando volúmenes de muestra mínimos y en un corto periodo de tiempo.
En este artículo mostramos el potencial de la tecnología ExoView® en el análisis directo, dirigido y simultáneo de 2 proteínas renales en las VEs de la orina.
MétodosSe seleccionaron 2 proteínas de interés con expresión tubular en función de los conocimientos previos del laboratorio y a la base de datos Human Protein Atlas: amnionless (AMN), localizada en la membrana de las VEs, y secreted frizzled-related protein 1 (SFRP1), parte del cargo interno. Su localización tubular se analizó por inmunohistoquímica en tejido renal humano obtenido del Biobanco de la Fundación Jiménez Díaz, empleando cortes de 5μm y los anticuerpos anti-AMN (HPA000817, Merck Millipore) y, anti-SFRP1 (PA5-95634, Invitrogen™).
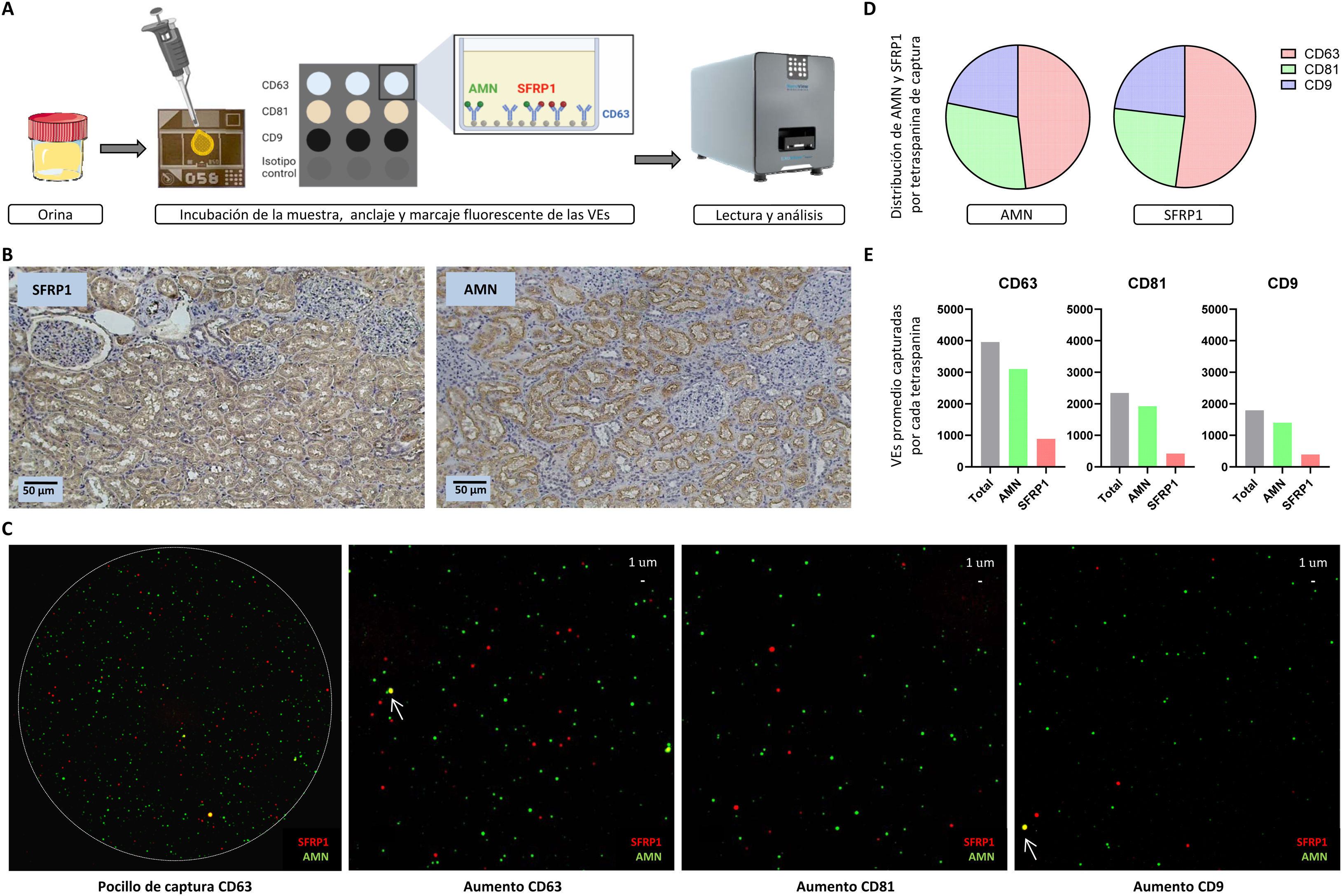
Las VEs de la orina se analizaron por la tecnología ExoView® empleando un kit comercial estándar de captura por las tetraspaninas CD63, CD81 y CD9 (EV-TETRA-C, Unchained labs) a través de anticuerpos para muestras humanas (anti-AMN; anti-SFRP1). El análisis de estas VEs en la orina se realizó siguiendo las instrucciones del fabricante. Primeramente, se realizó un pre-escaneado del soporte de captura (chip) a modo de control de calidad y blanco en el análisis de los datos. Después, se optimizó la concentración de orina a usar en el análisis. Sin aislar previamente las VEs, se cargaron directamente 50μl de orina diluida en disolución de incubación y se incubó en el chip en oscuridad a temperatura ambiente durante la noche. Alternativamente, esta incubación se puede llevar a cabo en 1-2h sin perjudicar los resultados en caso de ser necesario reducir significativamente el tiempo de análisis. Para la detección de proteínas intracelulares como SFRP1, se incluyó un paso de permeabilización de las muestras que no sería necesario para un análisis de proteínas de membrana de las VEs. Las VEs presentes en la orina ancladas al chip a través de sus tetraspaninas se incubaron en agitación y oscuridad durante 1h con anticuerpos marcados con anti-AMN (CF 594A) y anti-SFRP1 (Dylight 755) mediante Alexa Fluor Conjugation Kits Fast (Abcam). Finalmente, el chip se leyó en ExoView® Analyzer (Unchained labs) para detectar, localizar y cuantificar las proteínas de interés en cada una de las VEs. Cada chip tiene 3 pocillos de captura por tetraspanina. De este modo se pueden obtener tanto valores totales (suma de los 3 pocillos de cada tetraspanina) como valores promedio, en lo que refiere a VEs capturadas y a proteínas analizadas. La figura 1A resume el flujo de trabajo.
A) Flujo de trabajo de ExoView®. La orina, sin aislar previamente las VEs, se añade sobre la parte central del chip, que contiene los pocillos donde se capturan las VEs por las diferentes tetraspaninas (CD63, CD81 y CD9). Estas VEs se marcan por fluorescencia en verde en caso de expresar AMN o en rojo si expresan SFRP1. Los chips se leen y analizan en el ExoView® R200. B) Análisis de AMN y SFRP1 en tejido renal humano por inmunohistoquímica. Se aprecian tanto los glomérulos como los túbulos (aumento ×10), tiñéndose únicamente estos últimos, al ser las estructuras funcionales relacionadas con nuestras proteínas de interés. C) Visualización de la captura de las proteínas de interés (AMN, SFRP1). Se muestra una imagen de uno de los pocillos de la tetraspanina de captura CD63, en la que se aprecia la unión específica y delimitada de las VEs. A la derecha, se incluye un aumento de un pocillo por cada tetraspanina de captura (CD63, CD81 y CD9, respectivamente), siendo cada punto de color una vesícula expresando AMN (proteína de membrana, en verde) o SFRP1 (proteína intracelular, en rojo). Además, se señala mediante flechas la co-localización de ambas proteínas (amarillo) en una misma VE. D) Distribución (%) de las proteínas AMN y SFRP1 por tetraspanina de captura (CD63 en rojo, CD81 en verde y CD9 en azul). E) Cuantificación de las VEs capturadas que contienen alguna de las dos proteínas de estudio (AMN en verde y SFRP1 en rojo), para cada una de las tetraspaninas (CD63, CD81 y CD9). Se muestran valores promedio de los 3 pocillos por cada tetraspanina de captura.
El análisis inmunohistoquímico muestra la localización tubular de las 2 proteínas analizadas, SFRP1 y AMN (fig. 1B). La dilución adecuada para el análisis de las muestras de orina por ExoView® se estableció en 1:10, por lo que únicamente fueron necesarios 5μl de orina para el análisis. Se capturaron un total de 24.297 VEs, de las cuales 48,92% fueron capturadas por CD63, 28,93% por CD81 y 22,15% por CD9, siendo, por lo tanto, CD63 la subpoblación de VEs mayoritaria en la orina. Esto está en consonancia con la participación de esta subpoblación de VEs en funcionalidad tubular, ya que la expresión de esta tetraspanina se ha relacionado con la funcionalidad del túbulo proximal16. El tamaño medio de las VEs analizadas fue de 59±16nm para las capturadas por CD63, de 61±16nm para las capturadas por CD81 y de 59±10 nm para CD9; correspondiendo en los 3 casos a VEs de pequeño tamaño.
La figura 1C muestra una representación visual de las VEs analizadas resaltando la detección de AMN (verde) y SFRP1 (rojo) por las diferentes tetraspaninas de captura (CD63, CD81 y CD9). Teniendo en cuenta solo las VEs que expresan cada una de las proteínas de interés analizadas, se calculó la distribución de AMN y SFRP1 en las diferentes subpoblaciones de tetraspaninas. El 48,23% de AMN se detecta en el total de VEs capturadas por CD63, el 29,92% en VEs capturadas por CD81 y el 21,85% en las capturadas por CD9. La distribución de SFRP1 es similar: 52,10%, 24,77% y 23,13%, respectivamente (fig. 1D). Para cuantificar las proteínas de interés se evaluó la detección de cada proteína en las VEs capturadas por cada tetraspanina (valores promedio). Encontramos que de las 3.962 VEs promedio capturadas por CD63, un 78,29% fueron positivas para AMN y un 22,46% para SFRP1. En el caso de CD81, de las 2.343 VEs promedio capturadas, un 82,07% fueron positivas para AMN y un 18,05% para SFRP1. Por último, en CD9 encontramos un promedio de 1.793 VEs capturadas, expresando AMN un 78,30% y SFRP1 un 22,03% (fig. 1E). El total de los porcentajes no tiene por qué ser igual al 100%, ya que algunas de las VEs pueden contener ambas proteínas. Estos análisis muestran cómo para estas 2 proteínas hay una mayor concentración de VEs que contienen AMN que SFRP1 y, sin embargo, la distribución de las proteínas en las diferentes subpoblaciones de VEs es similar.
Se cree que existen distintas poblaciones de VEs especializadas en diferentes rutas y funciones biológicas17. Hasta ahora esto era difícil de demostrar ya que precisa de estudios mediante tecnologías de evaluación individual de cada VE y que, sin embargo, ExoView® permite realizar. En el estudio de una posible función biológica de subpoblaciones específicas de tetraspaninas, ExoView® permite además analizar la co-localización (co-expresión) de las proteínas de interés que, en caso de estar mayormente presente en una subpoblación, podría relacionarse con su participación en una estructura funcional determinada. Analizando la co-localización de AMN y SFRP1 en las VEs capturadas por las diferentes subpoblaciones de tetraspaninas, encontramos baja co-expresión de ambas proteínas en la misma vesícula; un 0,73% en el caso de las vesículas capturadas por CD63, un 0,13% para VEs capturadas por CD81 y un 0,33% en CD9.
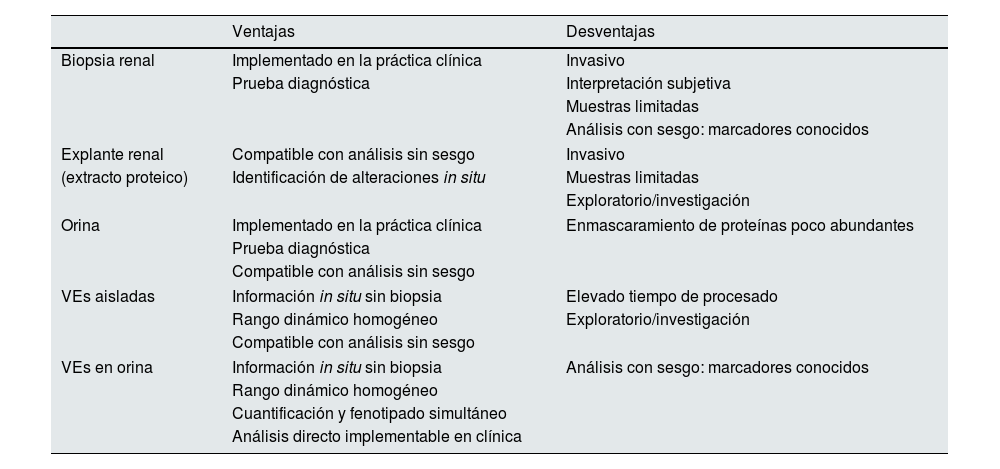
Este trabajo analiza 2 proteínas de expresión tubular en VEs de orina evidenciando las ventajas del análisis por ExoView® para la caracterización y la cuantificación directa de las VEs siendo su aplicabilidad extrapolable a otros fluidos biológicos de interés clínico y a otras proteínas. En la tabla 1, se muestra una comparativa de los distintos tipos de muestras biológicas valorables para el estudio de enfermedades renales, con sus ventajas e inconvenientes en cuanto a la información que proporcionan, su disponibilidad y su posibilidad de implementación en los sistemas de salud. En ExoView®, el empleo de volúmenes tan pequeños como son 5μl y el tiempo total de análisis no superior a 3h facilita la traslación a la práctica clínica diaria de las VEs como fuentes de información diagnóstica. En el contexto de las enfermedades renales, las VEs posibilitan la monitorización diagnóstica de marcadores de funcionalidad renal, de eficacia terapéutica o estimación de riesgo cardio-renal18,19. En esta línea, la técnica debe validarse en cohortes amplias y multicéntricas para poder confirmar su potencial en el diagnóstico clínico y su aplicación a los análisis clínicos de rutina.
Tipos de muestras biológicas valorables para el estudio de las enfermedades renales
| Ventajas | Desventajas | |
|---|---|---|
| Biopsia renal | Implementado en la práctica clínica | Invasivo |
| Prueba diagnóstica | Interpretación subjetiva | |
| Muestras limitadas | ||
| Análisis con sesgo: marcadores conocidos | ||
| Explante renal | Compatible con análisis sin sesgo | Invasivo |
| (extracto proteico) | Identificación de alteraciones in situ | Muestras limitadas |
| Exploratorio/investigación | ||
| Orina | Implementado en la práctica clínica | Enmascaramiento de proteínas poco abundantes |
| Prueba diagnóstica | ||
| Compatible con análisis sin sesgo | ||
| VEs aisladas | Información in situ sin biopsia | Elevado tiempo de procesado |
| Rango dinámico homogéneo | Exploratorio/investigación | |
| Compatible con análisis sin sesgo | ||
| VEs en orina | Información in situ sin biopsia | Análisis con sesgo: marcadores conocidos |
| Rango dinámico homogéneo | ||
| Cuantificación y fenotipado simultáneo | ||
| Análisis directo implementable en clínica | ||
VEs: vesículas extracelulares.
La actividad investigadora de los autores está financiada por el ISCIII co-financiado por fondos FEDER y la Unión Europea (PI20/01103, CP22/00100, IF08/3667-1, RD16/0009, RD21/0005/0001) y la Comunidad de Madrid (PEJ-2020-AI/BMD-17899, PEJD-2019-PRE/BMD-16992, 2018-T2/BMD-11561). Este estudio ha sido financiado fundamentalmente por la Fundación SENEFRO y parcialmente por la Fundación Mutua Madrileña y la Sociedad Española de Proteómica.
Conflicto de interesesLos autores no tienen conflictos de intereses.