Clásicamente, asociamos la acción de la aldosterona con la estabilidad del volumen circulante eficaz y el control de la presión arterial y la acción de la parathormona con el control del metabolismo óseo mineral y la normalidad de la calcemia y la fosforemia. Sin embargo, la relación entre estos dos ejes hormonales trasciende estos ámbitos y podemos definir una interrelación bidireccional entre ambos, que determina la patogenia de las alteraciones en el metabolismo calcio-fósforo y el control de la presión arterial, lo que implica consecuencias en la evolución y el tratamiento de los pacientes. La exposición de dos casos clínicos nos permite mostrar la fisiopatología de esta relación.
Classically, aldosterone actions are associated with the stability of the effective circulating volume and with blood pressure control, while parathormone actions are linked to bone mineral metabolism, calcium, and phosphate homeostasis. Nevertheless, the relationship between these two hormonal axes surpasses these areas. A bidirectional interrelation between calcium-phosphorus metabolism and blood pressure control can lead to alterations in both. This can have significant implications for the evolution and treatment of patients. To illustrate this relationship, we present two clinical cases that demonstrate the pathophysiology involved.
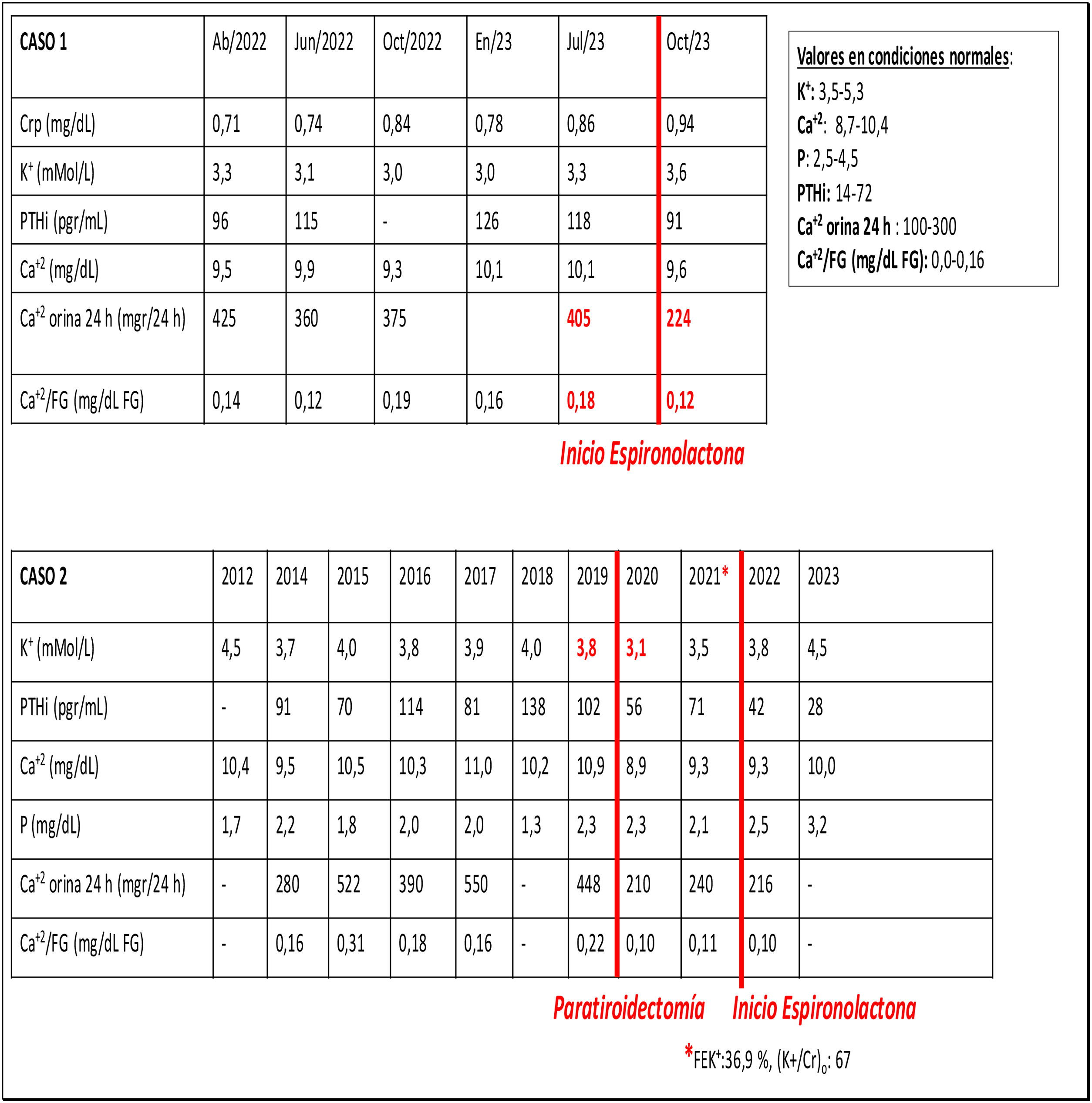
Varón de 44 años afecto de un síndrome de Whiteveen-Kolk (microdeleción 15q24) que acude a consultas por obesidad e hipertensión arterial (HTA) no estudiada. En la analítica destaca: función renal conservada, hipernatremia, hipopotasemia con excreción urinaria inadecuada de potasio, normocalcemia con hipercalciuria, hipofosforemia con hiperfosfaturia, elevación de la parathormona (PTH), niveles de renina (R) disminuidos con aldosterona (ALD) y cociente ALD/R elevados. Ecografía tiroidea, paratiroidea (PT) y gammagrafía de PT normales. TC de abdomen con hiperplasia suprarrenal (SPR) bilateral. Se trata con espironolactona y aportes de potasio. Se normaliza la kaliemia y cede la hipercalciuria (tabla 1).
Caso 2Varón de 72 años seguido en consultas por sospecha de hiperparatiroidismo (HPT) primario. Padecía HTA, sobrepeso y analíticamente hipercalcemia con hipercalciuria, hipofosforemia con hiperfosfaturia y elevación ocasional de PTH. Ni la ecografía de cuello ni la gammagrafía de paratiroides sestaMIBI con Tc 99m identifican con claridad adenoma PT. No nefrolitiasis, densitometría con osteopenia femoral y lumbar. Ante la persistencia de hipercalcemia e hipofosforemia compatibles con HPT, se repite la ecografía, que identifica nódulo intratiroideo, por lo que se realiza nodulectomía electiva diagnóstica de adenoma PT. Tras la cirugía, se normalizan la calcemia y las cifras de PTH de forma inmediata, pero se mantiene durante unos meses la hipofosforemia con hiperfosfaturia a pesar de niveles adecuados de vitaminaD. A partir de los 6meses se normaliza el metabolismo calcio/fósforo, pero desarrolla hipokaliemia de novo, hiperkaliuria con alcalosis metabólica, R en rango normal y ALD en límite elevado de normalidad. Una TC abdominal identifica imágenes de hiperplasia SPR bilateral. La presión arterial (PA) se normaliza y las alteraciones analíticas desaparecen tras iniciar tratamiento con espironolactona (tabla 1).
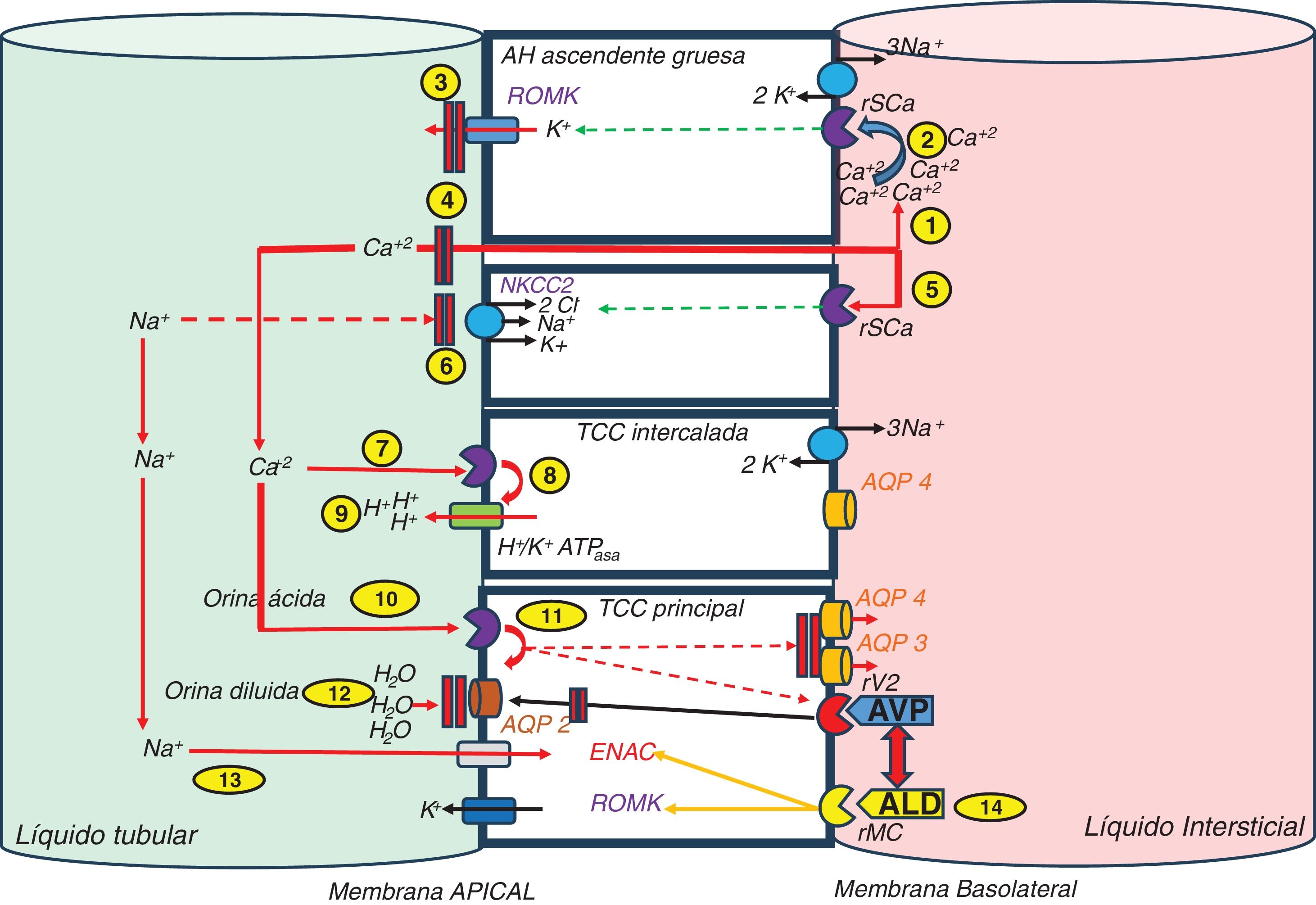
Lo que sabemos sobre aldosterona y PTHNo es difícil entender que los mecanismos de regulación del calcio se relacionen con los mecanismos encargados de mantener un volumen adecuado en el espacio extracelular. La forma más eficaz de disminuir el exceso de calcio extracelular, por ejemplo lo que sucede en el HPT primario, es aumentar su excreción urinaria. Para esta función se dispone del receptor sensible de calcio (rSCa), que se encarga de estimular la síntesis y la secreción de PTH en las células paratiroideas y que ejerce su acción en la vertiente basolateral de la membrana tubular de las células del asa de Henle ascendente gruesa, donde, si detecta un calcio elevado, inhibe el transportador de canales medulares renales externos de potasio (ROMK), disminuye la llegada de potasio a la luz, que queda con menos cargas positivas, y el calcio (de carga positiva) se mantiene en la luz tubular, no se reabsorbe y circula hacia los túbulos distal y colector. Para evitar que este exceso de calcio precipite en el túbulo, también se inhibe el transportador de Na+/K+/2Cl– (NKCC2), lo que supone un aumento del contenido de sodio en la luz tubular, su mayor excreción y llegada a nivel distal, tanto a las células intercaladas como a las principales del túbulo colector cortical (TCC), que también poseen CaSR. El aumento de calcio estimula el transporte de protones en las células intercaladas, lo que acidifica la orina y disminuye las acuaporinas en las células principales, lo que se traduce en orinas más diluidas. Por otra parte, la no reabsorción de sodio pone en marcha, por mecanismos dependientes de la hipovolemia, la síntesis de aldosterona, que, a través del receptor de mineralocorticoides (rMC) en las células principales e intercaladas del TC, estimula, a través de la fosforilación de la bomba Na+/K+ ATPasa, a los transportadores de los canales apicales de sodio (ENAC), ROMK, H+-ATPasa y H+/K+-ATPasa, con lo que se aumenta la excreción de protones a la luz1 (fig. 1). En definitiva, para poder excretar el exceso de calcio sin que se produzca precipitación de cristales se requiere una mayor cantidad de orina, más diluida y más ácida, a lo que contribuye el equilibrio del calcio y el del sodio y en el que la aldosterona, como efector último del eje hormonal que incluye a la renina y a la angiotensinaII (ANGII), juega un papel principal en el equilibrio del volumen circulante eficaz. Por ello, en situaciones de hiperaldosteronismo encontraremos HTA volumen-dependiente, hipokaliemia y alcalosis metabólica.
Relación clásica entre el transporte de calcio y sodio.
1)El calcio se transporta por vía paracelular en el asa de Henle gruesa ascendente, y de esta forma aumenta su concentración en el intersticio. 2)Cuando su concentración se eleva, estimula al receptor sensible de calcio, que inhibe al receptor ROMK. 3)La menor excreción de potasio establece una menor electropositividad del líquido tubular. 4)La menor electropositividad inhibe el transporte paracelular de calcio. 5)Paralelamente la alta concentración de calcio inhibe al transportador NKCC2. 6)Esta acción disminuye la reabsorción de sodio. El efecto global es un aumento de sodio y calcio a nivel tubular que llega a segmentos distales. 7)El calcio estimula al rSCa en las células intercaladas del TCC. 8)La bomba H+-ATPasa aumenta la excreción de protones a la luz tubular y 9)hace la orina más ácida, lo que dificulta la precipitación del calcio. 10)Así mismo estimula el rSCa en las células principales del TCC, 11)lo que provoca la inhibición de las aquaporinas (AQP) y de la arginina vasopresina (AVP). 12)El efecto global es la consecución de una orina más diluida. 13)La menor reabsorción de sodio induce el estímulo de la aldosterona por mecanismos dependientes de la hipovolemia, lo que pone en marcha su acción clásica sobre los receptores ENAC y ROMK. 14)La aldosterona interactúa en el estímulo de la AVP.
AQP: aquaporinas; Ca+2: calcio; H+: protones; K+: potasio; Na+: sodio; rMC: receptor mineralocorticoide; rSCa: receptor sensible de calcio.
Fuente: modificado de Ranieri1.
La secreción de PTH es estimulada por la hiperfosforemia, la hipocalcemia, el descenso de calcitriol y el aumento de FGF23. Situaciones de HPT provocan la disminución de receptores de vitaminaD (VDR), lo que condiciona una menor respuesta al calcitriol y, secundariamente, una mayor secreción de PTH. La PTH, mediante la estimulación del gen CyP27b1, aumenta la síntesis de calcitriol y, por tanto, la absorción intestinal de calcio y a nivel óseo, la osteoclastogénesis, lo que provoca la liberación ósea de calcio y fósforo. En los estadios iniciales de la enfermedad renal crónica su efecto global es el de aumentar la fosfatemia, la calcemia y la fosfaturia y disminuir la calciuria, pero conforme la enfermedad renal avanza y disminuye la eliminación renal de P, la fosfatemia aumentará progresivamente, estimulando directamente la secreción de PTH mediante un estímulo postranscripcional del gen de la PTH, la proliferación de células PT mediante la activación del factor de crecimiento epidérmico (EGFR) que provoca el aumento del TGF-α, inhibe la expresión de CaSR y aumenta la expresión de VDR en el intestino y la reduce a nivel renal.
A pesar de una amplia literatura al respecto, la relación entre hiperaldosteronismo (HA) e HPT no está completamente aclarada. Wermer2 y Sizemore et al.3, en 1963 y 1980, al definir los síndromes MEN tipo1 y2 ya hablaban de la relación entre el eje PT/SPR. En la década de 1980 se describen los primeros casos de asociación HA/HPT4-6, y desde entonces se multiplican los casos publicados7-11.
Lo que deberíamos saber sobre la íntima relación entre aldosterona y PTHLos niveles de ALD y PTH se encuentran relacionados directa y bidireccionalmente por medio de mecanismos que incumben al equilibrio iónico y ácido/base del medio interno.
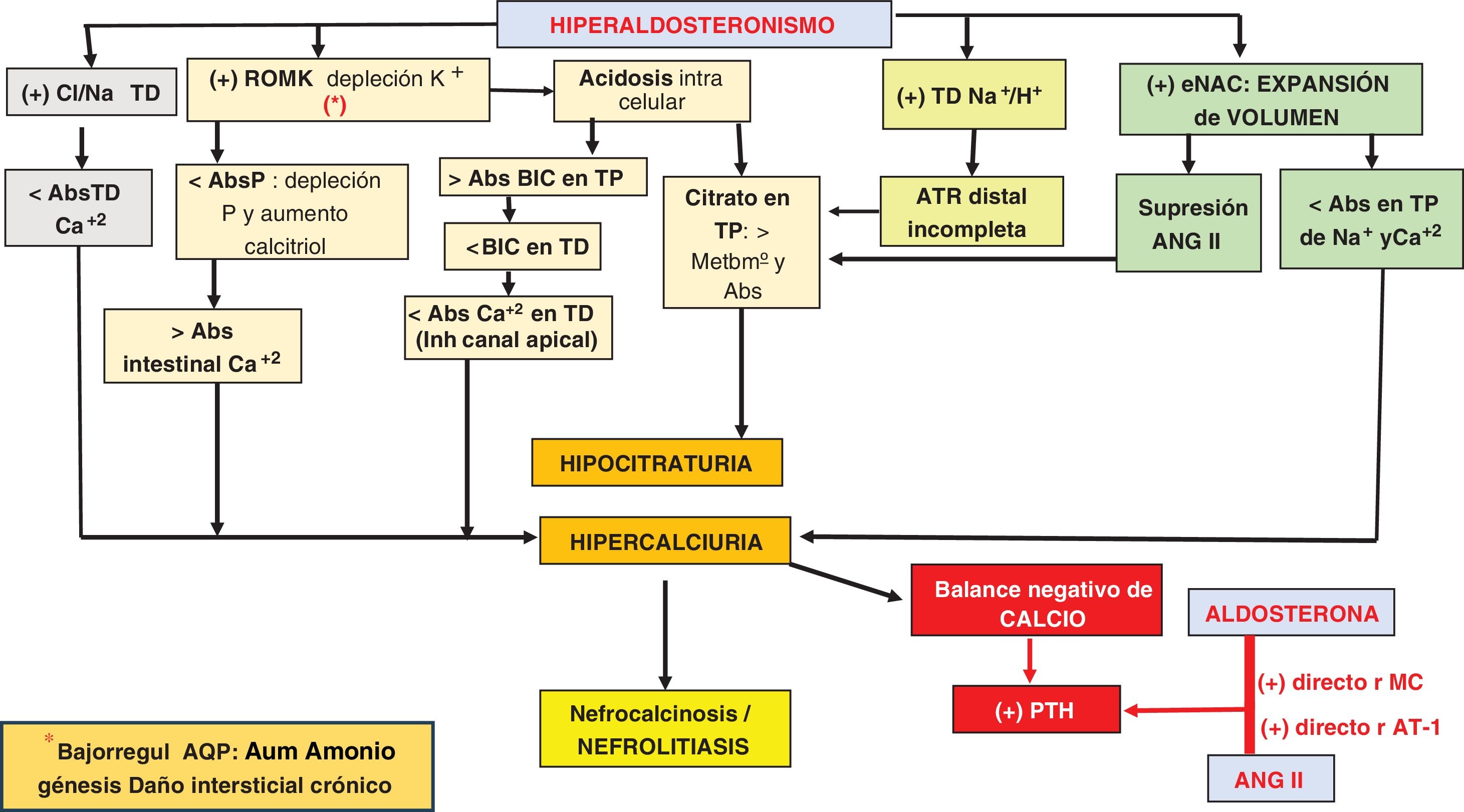
La ALD, por medio de sus acciones sobre distintos receptores tubulares, puede inducir hipercalciuria y crónicamente un balance negativo de calcio a nivel sistémico e hipocitraturia.
El primer mecanismo por el que el HA provoca hipercalciuria depende de la expansión del volumen circulante, que induce, mediante la estimulación de la retrofiltración túbulo-glomerular, una menor reabsorción de sodio y de calcio en el túbulo proximal (TP), ya que ambos transportes se encuentran acoplados12,13.
Pero además del balance negativo crónico de calcio, el mecanismo por el que el HA puede inducir HPT parece estar mediado por otros factores metabólicos.
La expansión del volumen circulante provoca la supresión de la ANGII y el aumento de expresión del canal ROMK, lo que determina hipopotasemia por una mayor excreción renal de potasio.
La hipopotasemia favorece la acidosis intracelular, que, cronificada, determina el aumento de absorción de bicarbonato a nivel proximal y su menor llegada a nivel distal.
Tenemos, por tanto, en el HA un mayor aporte de calcio y un menor aporte de bicarbonato a nivel distal. El calcio debería reabsorberse a través del canal apical de calcio, pero para su correcto funcionamiento este necesita ser estimulado por el bicarbonato, y su menor llegada lo inactiva, por lo que aumenta la hipercalciuria.
Paralelamente, la acidosis en el TP aumenta el metabolismo y el consumo de citrato que condicionará hipocitraturia.
Complementariamente, la hipopotasemia induce depleción de fosfato en el TP, con aumento compensador de calcitriol, que provoca una mayor absorción intestinal de calcio y la disminución en la expresión de las aquaporinas estimulando la amoniogénesis, lo que podría resultar en daño intersticial crónico.
Además, la ALD estimula el cotransportador Na+/Cl– en el túbulo distal, lo que disminuye la reabsorción de calcio en ese segmento y acentúa la hipercalciuria y la inhibición del transportador Na+/H+, induciendo acidosis tubulorrenal distal incompleta que magnifica la hipocitraturia.
La hipocitraturia, la hipercalciuria y el balance negativo de calcio que estimularía la secreción de PTH aumentarían la posibilidad de nefrolitiasis y de nefrocalcinosis medular14,15 (fig. 2).
Relación entre HA/HPT.
Abs: absorción; ANGII: angiotensinaII; AQP: aquaporinas; ATR: acidosis tubulorrenal; BIC: bicarbonato; Ca+2: calcio; H+: protones; Na+: sodio; P: fósforo; rMC: receptor mineralocorticoide; TD: túbulo distal; TP: túbulo proximal; rAT-1: receptor de angiotensinaI; +: estímulo; >: mayor; <: menor.
Se hipotetiza con una alteración del receptor sensible de calcio (rSCa), que haría que el umbral de calcio para sintetizar PTH por las células paratiroideas fuera más alto que en condiciones normales16.
Un elevado porcentaje de trabajos ponen de manifiesto que la calciuria disminuye tras tratar el HA, como hemos visto en nuestro caso1. La falta de unanimidad se explica por los diferentes estadios de evolución de la enfermedad en los casos comunicados.
Se ha comprobado que tras el tratamiento con inhibidores del eje R/ANG/ALD en el HA, los valores de PTH descienden solo cuando los niveles de ALD no se encuentran elevados, lo que parece demostrar un mecanismo efector de la ALD en el control de la síntesis de PTH independiente de la estimulación de renina y ANGII. La ANGII aumenta los niveles de PTH de forma aguda mediante su acción directa sobre la glándula PT y de forma crónica mediante la vía genómica del receptor mineralocorticoideo (rMC). Con la cronificación del estímulo, el HPT secundario se hace autónomo y se puede transformar en terciario, pudiendo coexistir un cuadro larvado de HA con otro clínicamente más evidente de hipercalcemia17.
Por otra parte, los genes que señalizan la síntesis de ALD se encuentran presentes en las vías metabólicas del metabolismo óseo y la hipercalcemia activa el rSCa.
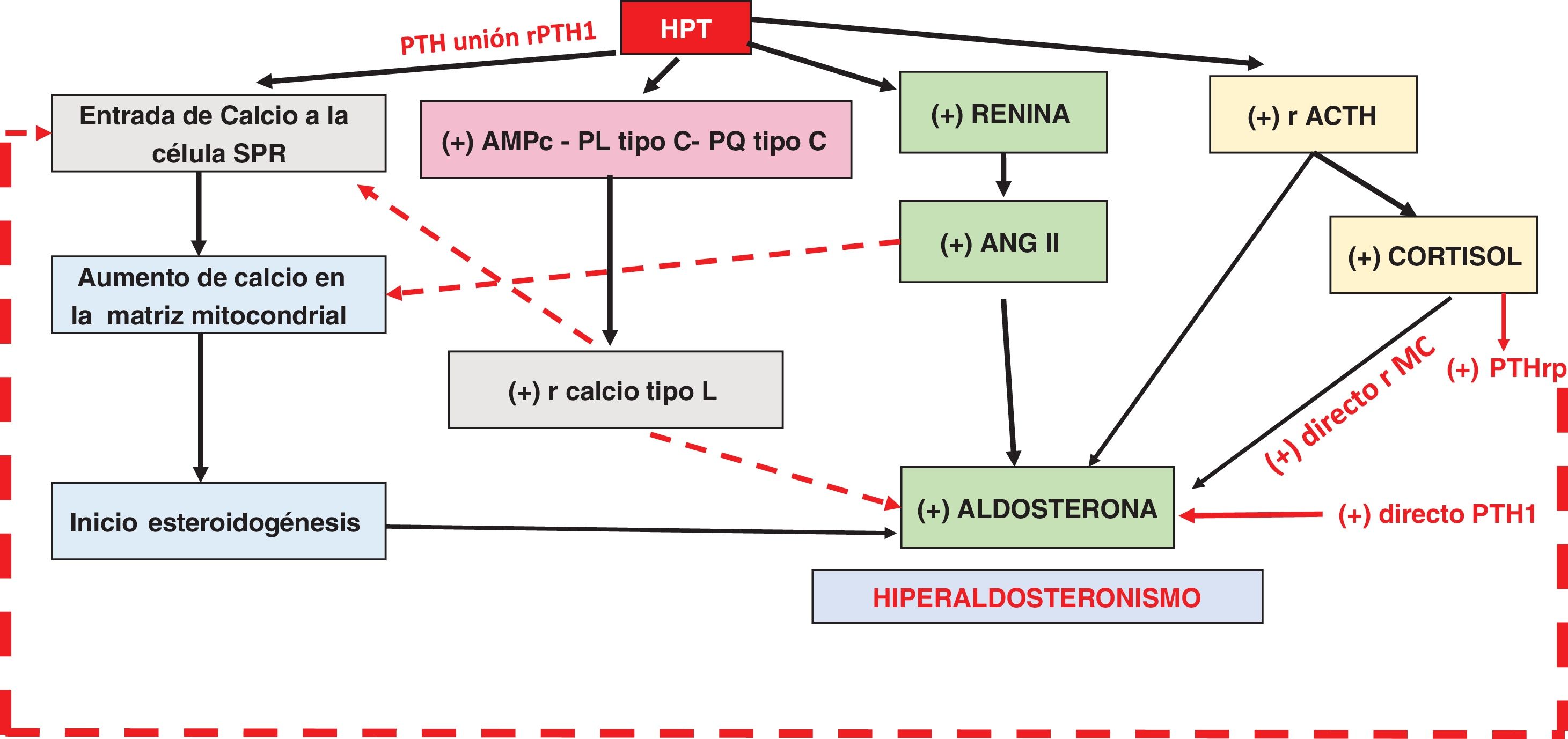
La PTH actúa sobre receptores de ACTH, sobre el sistema R/ANG/ALD y sobre el calcio. El paso de calcio al interior celular ejerce un efecto iniciador de la cascada de fosforilación que culmina en la activación de factores de transcripción (NURR1, NGF1B, CREB) que se unen a la región del promotor y regulan positivamente la secreción de aldosterona por medio del estímulo de las vías de la fosfolipasaC, la proteincinasaC y de la transcripción del CYP11B2 (fig. 3).
La acción de la PTH sobre la SPR, el calcio y R/ANG/ALD le permiten controlar la secreción de ALD a nivel de la SPR. Tanto PTH como PTHrp poseen capacidad secretagoga en la glándula SPR18,19.
El hecho de que las PT posean receptores del metabolismo SPR (rMC y rANGII) y las SPR receptores PT (rPTH1, VDR y rSCa), sobre todo en las células de la zona glomerulosa20,21, hablaría a favor de una vía reguladora bidireccional entre el metabolismo óseo y la esteroidogénesis SPR de ALD (citocromo p450 21 hidroxilasa).
Existen factores adyuvantes que pueden intervenir en el comportamiento del túbulo renal en el metabolismo óseo y que son independientes de esta vía, como la dieta rica en sal, que favorece la hipercalciuria por intercambio directo e induce secundariamente un estímulo para la secreción de PTH, independiente de los niveles de vitaminaD; y la propia vitaminaD, que induce la inhibición de ANGII y, al mejorar la calcemia, ejerce una acción inhibidora sobre la aldosterona por medio de sus acciones sobre el endotelio vascular, pero se ha comprobado en numerosos trabajos que la relación HA/HPT es independiente de estos factores17.
Lo que nos gustaría saberUna interesante cuestión no respondida es por qué el metabolismo del calcio y sodio, concretado en los receptores Na+/Ca+2 y Na+/Cl–, anatómicamente cercanos en el túbulo distal y la síntesis de las hormonas ALD y PTH se encuentran tan intrínseca e ineludiblemente unidos. Una posible explicación es la circunstancial. De igual forma que en el síndrome MEN1 y MEN2 se encuentran patologías endocrinas que afectan a distintas glándulas (PT, hipófisis, páncreas y SPR), cabe la posibilidad de que exista otro trastorno endocrino múltiple no descrito que aúne patología PT y SPR en la forma clínica descrita en estos casos.
Otra posible explicación entroncaría con una concepción integradora del equilibrio del medio interno, parcialmente explicada en el primer apartado de esta revisión. De igual forma que resulta esencial mantener la estabilidad entre volumen circulante eficaz y equilibrio hídrico, y esto se consigue mediante una respuesta coordinada que relaciona los niveles de hormona antidiurética y de aldosterona22, resulta estimulante pensar que la importancia que los niveles de calcio extra e intracelular poseen en el control de la vasorregulación y de los mecanismos de segundos mensajeros que el influjo iónico del calcio ejerce directamente justifican una vía de interrelación común entre ambos sistemas, con lo cual habría vías de interregulación entre el equilibrio de la aldosterona y la ADH y entre el equilibrio de la aldosterona y la PTH.
Estos dos casos, ejemplos de realidad especular, representan un HA primario por hiperplasia SPR bilateral que cursa con clínica de HPT primario que se resuelve al tratar el HA y un HPT primario que, al ser tratado, desenmascara un HA subclínico hasta ese momento no evidente. La realidad que este hecho representa puede tener importancia en la práctica clínica de pacientes afectos con ambas entidades y debería tenerse en cuenta a la hora de abordar el tratamiento de estos pacientes.
- -
La ALD controla el volumen circulante eficaz y la presión arterial. La PTH controla el metabolismo óseo mineral. Ambas hormonas disponen de vías comunes de interrelación.
- -
El HA induce hipercalciuria e hipocitraturia, lo que justifica una mayor tendencia a nefrolitiasis y nefrocalcinosis medular por 5 mecanismos interrelacionados:
- 1)
Menor absorción tubular distal de calcio.
- 2)
Hipopotasemia, hipofosforemia y aumento de la síntesis de calcitriol.
- 3)
Acidosis intracelular e hipocitraturia.
- 4)
Acidosis tubulorrenal distal incompleta.
- 5)
Estímulo del receptor ENAC con expansión de volumen y supresión de angiotensinaII.
- -
El HA provoca daño intersticial crónico a través de mecanismos dependientes de la amoniogénesis que incumben al funcionamiento de aquaporinas.
- -
La hipercalciuria y el balance negativo crónico de calcio en el HA son estímulos directos para la secreción de PTH.
- -
El HPT induce la esteroidogénesis suprarrenal por mecanismos dependientes de vías de segundos mensajeros del calcio, el estímulo directo de renina y ACTH.
Este artículo no tiene fuentes de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.