El índice neutrófilo/linfocito es un marcador inflamatorio de valor pronóstico en enfermedades cardiovasculares. El objetivo del presente trabajo es valorar la asociación entre el índice neutrófilo/linfocito y la alteración del cociente albúmina/creatinina urinario como marcador precoz de disfunción endotelial sistémica asociada a enfermedad microvascular y riesgo cardiovascular, en sujetos asintomáticos.
Materiales y métodosSe realizó un estudio transversal en 1.816 sujetos asintomáticos. Se excluyó del a estudio aquellos pacientes que presentaron antecedentes de enfermedad cardiovascular, los que recibían tratamiento con fármacos antiproteinúricos (inhibidores de la enzima conversora de angiotensina y antagonistas de los receptores de la angiotensina II) y aquellos que presentaron un cociente albúmina/creatinina superior a 300mg/dL. La variable desenlace del estudio fue la alteración del cociente albúmina/creatinina urinario.
ResultadosEl índice neutrófilo/linfocito resultó significativamente asociado a la alteración del cociente albúmina/creatinina urinario, tanto en el estudio univariante como en el multivariante, independientemente de otros cofactores como la edad, la hipertensión arterial, la diabetes, la dislipidemia o el filtrado glomerular patológico. El análisis de la sensibilidad y la especificidad de distintos niveles del índice neutrófilo/linfocito permitió generar 3 grupos de riesgo de alteración del cociente albúmina/creatina urinario: riesgo bajo con un cociente neutrófilo/linfocito < 1,5, riesgo intermedio con cociente neutrófilo/linfocito entre 1,5 y 3 y riesgo alto con un cociente neutrófilo/linfocito > 3. La proporción relativa de alteración del cociente albúmina/creatinina urinario, en los 3 grupos de riesgo, aumentaba en razón del valor del índice neutrófilo/linfocito de forma independiente al resto de cofactores.
ConclusionesEl índice neutrófilo/linfocito surge como un potencial marcador de disfunción endotelial sistémica económico, rápido, no invasivo e independiente de otros factores conocidos, en sujetos asintomáticos.
The neutrophil-to-lymphocyte ratio has demonstrated to be a prognostic inflammatory marker in cardiovascular disease. The objective of this study is to evaluate the association between neutrophil-to-lymphocyte ratio and pathologic urinary albumin/creatinine ratio as an early marker of cardiovascular risk and systemic endothelial dysfunction, associated with microvascular disease, in asymptomatic subjects.
Materials and methodsA unicenter cross-sectional study was conducted, including 1816 asymptomatic subjects. Patients with previous cardiovascular disease, those who were treated with ACE inhibitors and/or angiotensin II receptor blockers and patients with albumin/creatinine ratio over 300mg/g were excluded. The outcome of the study was the presence of a pathologic urinary albumin/creatinine ratio.
ResultsThe neutrophil-to-lymphocyte ratio was significantly associated with altered urinary albumin/creatinine ratio in the univariate analysis and after adjustment for other known endothelial and cardiovascular risk factors (age, hypertension, dyslipidaemia, diabetes or altered glomerular filtration rate). Based on the sensitivity and specificity of different neutrophil-to-lymphocyte ratio thresholds, 3 risk groups were created for altered urinary albumin/creatinine ratio: low risk in those with neutrophil-to-lymphocyte ratio < 1.5, intermediate risk in patients between 1.5 and 3, and high risk in those with neutrophil-to-lymphocyte ratio > 3. These groups were found to have a statistically significant and independent prognostic power for altered urinary albumin/creatinine ratio in asymptomatic patients.
ConclusionsThe neutrophil-to-lymphocyte ratio appears to be a cost-efficient, non-invasive and independent potential marker of systemic endothelial dysfunction in asymptomatic subjects.
Anualmente, las enfermedades cardiovasculares (ECV) causan unos 4 millones de fallecimientos en Europa y 1,9 millones en la Unión Europea, lo que supone un 47% de todas las muertes en Europa y el 40% de la Unión Europea. Las ECV son la causa más frecuente de muerte femenina en todos los países europeos y de muerte masculina en al menos 6 de ellos. El coste de las ECV en Europa es de 196.000 millones de euros anuales (54% en gastos sanitarios, 24% en pérdida de productividad y 22% en el cuidado de los pacientes con ECV)1.
La alta prevalencia de factores de riesgo cardiovascular, especialmente de tabaquismo, de obesidad y de diabetes, favorece el desarrollo de ECV, por lo que es muy importante su detección y control. La Organización Mundial de la Salud considera que el 75% de las muertes por ECV se podrían evitar con cambios adecuados en el estilo de vida y la modificación de los factores de riesgo2. La detección precoz de los pacientes con riesgo cardiovascular es, por tanto, un objetivo de gran importancia en este contexto. En este sentido, el cociente albúmina/creatinina urinario (CACU) alterado ha mostrado ser un marcador precoz de la morbimortalidad cardiovascular3.
Entre los mecanismos implicados entre el CACU alterado y la ECV, cabe destacar una disfunción endotelial tanto a nivel microvascular (disminución del óxido nítrico, aumento de factor von Willebrand, factor de crecimiento endotelial vascular, dimetilarginina asimétrica [ADMA]) como macrovascular (dilatación de los vasos)4. Este daño es debido en parte a la inflamación del endotelio de la microvasculatura, que a su vez favorece el acúmulo de lípidos y el desarrollo de aterosclerosis5.
La inflamación desempeña un papel protagonista en la fisiopatología de enfermedades consideradas no inflamatorias, como el cáncer o la aterosclerosis6-11. La determinación de leucocitos circulantes de sangre periférica es un método barato y sencillo, de disponibilidad generalizada, que permite evaluar la presencia de inflamación. Entre los diversos parámetros leucocitarios, el cociente entre el número absoluto de neutrófilos y el número absoluto de linfocitos (índice neutrófilo/linfocito [INL]) se asocia de forma significativa a los niveles de citocinas proinflamatorias y con el desarrollo y progresión de las ECV12-14. Este parámetro ha demostrado ser un marcador inflamatorio con alto poder predictivo de fallecimiento, infarto agudo de miocardio o severidad de enfermedad coronaria14-16. Además, diversos estudios han investigado la relación del INL con la diabetes mellitus, la resistencia a la insulina evaluada mediante el Homoeostasis Model Assessment of Insuline Resistence (HOMA-IR), la hipertensión arterial, la obesidad, la hiperlipidemia, el estilo de vida y la disfunción endotelial17-19.
Los estudios sobre la asociación entre el INL y las ECV se han realizado hasta el momento en pacientes con ECV sintomática. El objetivo del presente trabajo ha sido evaluar si dicha asociación se observa en sujetos asintomáticos y sin antecedentes de ECV, utilizando la alteración del CACU como marcador precoz de daño endotelial sistémico y de riesgo cardiovascular.
Material y métodosSe realizó un estudio transversal con sujetos procedentes de diversas regiones españolas, que acudieron a la Unidad de Chequeos de la Clínica Universidad de Navarra para reconocimiento médico y estimación del riesgo cardiovascular. Se valoró a 2.246 pacientes clínicamente asintomáticos desde mayo de 1999 hasta enero del 2011. Se realizó una historia clínica completa de cada paciente que incluía la recogida de antecedentes familiares de ECV, así como una analítica general con hemograma, bioquímica, fracciones de colesterol y la determinación de albúmina y de creatinina en orina de primera micción. Se excluyó a todos los pacientes que presentaban antecedentes personales de eventos cardiovasculares (infarto agudo de miocardio, ictus, arteriopatía periférica), los que tomaban fármacos antiproteinúricos (inhibidores de la enzima conversora de angiotensina y antagonistas de los receptores de la angiotensina II) o los que presentaban un CACU > 300mg/g. Los 1.816 sujetos restantes se incluyeron en la cohorte definitiva. El estudio fue diseñado de acuerdo con la Declaración de Helsinki y el protocolo fue aprobado por el Comité de Ética de la Clínica Universidad de Navarra.
Los factores de riesgo cardiovascular se definieron según las guías correspondientes a la Adult Treatment Panel (ATP)-III modificada20. Las determinaciones analíticas se efectuaron mediante técnicas estándar de laboratorio. Para calcular el INL, se obtuvo el cociente entre el valor absoluto de los neutrófilos y el valor absoluto de los linfocitos del hemograma. Para evaluar la resistencia a la insulina, se utilizó el HOMA-IR tanto como variable continua como con un punto de corte de 219. Para estimar el filtrado glomerular renal (FGRe), se empleó la fórmula Modification of Diet in Renal Disease, considerándose un aclaramiento patológico cuando presentaban un filtrado estimado inferior a 60ml/min/1,73 m2. Se utilizó como marcador de disfunción endotelial y riesgo cardiovascular la presencia de un cociente entre albúmina y creatinina en orina entre 30 y 300mg/g21.
Los resultados se expresaron como el valor de la media aritmética ± desviación estándar para variables cuantitativas continuas. Las variables cualitativas se presentaron en forma de proporciones. Para el análisis estadístico univariante se realizaron técnicas de contraste de hipótesis: chi al cuadrado para las variables cualitativas, t de Student para las comparaciones de variables cuantitativas con homogeneidad de varianzas en el test de Levene y la U de Mann-Whitney en el resto. El análisis multivariable se efectuó mediante modelos de regresión logística. Se realizó un análisis de sensibilidad para la búsqueda de los valores con mayor capacidad de discriminación. En los resultados de este análisis, se consideraron de utilidad clínica los parámetros con la sensibilidad y especificidad más alta22. Los cálculos estadísticos se realizaron utilizando el programa SPSS versión 20.0.
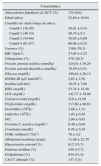
ResultadosLa tabla 1 muestra las características clínicas de la población estudiada. La media del INL fue de 2 ± 0,83. Un 7,5% de los pacientes presentaban un CACU alterado.
Características clínicas de la población (n=1.816)
| Característica | |
|---|---|
| Antecedentes familiares de ECV (%) | 174 (9,6) |
| Edad (años) | 52,89 ± 10,94 |
| Cuartiles de edad (rango de años) | |
| Cuartil 1 (18-45) | 38,91 ± 0,24 |
| Cuartil 2 (46-53) | 49,74 ± 0,1 |
| Cuartil 3 (54-60) | 56,95 ± 0,09 |
| Cuartil 4 (61-87) | 66,98 ± 0,24 |
| Varones (%) | 1386 (76,3) |
| IMC (kg/m2) | 27,94 ± 4,22 |
| Tabaquismo (%) | 478 (26,3) |
| Presión arterial sistólica (mmHg) | 124,01 ± 19,29 |
| Presión arterial diastólica (mmHg) | 79,59 ± 9,51 |
| Glucosa (mg/dL) | 100,44 ± 26,13 |
| HOMA-IR (μU·mmol/L2) | 2,63 ± 2,36 |
| Insulina (μU/mL) | 10,45 ± 7,66 |
| HDL (mg/dL) | 53,34 ± 15,40 |
| LDL (mg/dL) | 142,77 ± 38,08 |
| Colesterol total (mg/dL) | 219 ± 41,09 |
| Triglicéridos (mg/dL) | 117,69 ± 80,63 |
| Neutrófilos (109/L) | 3,66 ± 1,31 |
| Linfocitos (109/L) | 1,93 ± 0,56 |
| INL | 2,00 ± 0,83 |
| Proteína C reactiva (mg/dL)a | 0,49 ± 0,04 |
| Creatinina (mg/dL) | 0,95 ± 0,19 |
| FGRe (ml/min/1,73m2) | 76 ± 4,2 |
| Albúmina/creatinina (mg/g) | 11,46 ± 22,79 |
| Hipertensión arterial (%) | 612 (33,7) |
| Diabetes mellitus (%) | 249 (13,7) |
| Dislipidemia (%) | 934 (51,4) |
| CACU alterado (%) | 137 (7,5) |
CACU: cociente albúmina/creatinina urinario; ECV: enfermedades cardiovasculares; FGRe: filtrado glomerular renal estimado; HDL: high density lipoprotein; HOMA-IR: Homeostatic Model Assesment of Insulin Resistance; IMC: índice de masa corporal; INL: índice neutrófilo linfocito; LDL: low density lipoprotein.
Como muestra la tabla 2, la alteración del CACU se asoció significativamente a la edad, la obesidad, la hipertensión arterial, la diabetes, la resistencia a la insulina (HOMA-IR > 2), la dislipidemia y el filtrado glomerular patológico. En la misma tabla se observa el aumento significativo del INL en pacientes con un CACU alterado. Para evaluar la capacidad de predicción de alteración del CACU de otros marcadores de inflamación, se utilizó la proteína C reactiva (PCR). Este análisis se realizó en un subgrupo de la muestra en que se disponía dicha determinación (n = 439). En este subgrupo la prevalencia del CACU alterado fue del 8%, similar a la de la población general (p > 0,5). No se encontraron diferencias estadísticamente significativas en la PCR entre los pacientes con un CACU alterado y los que tenían un CACU dentro de la normalidad (p < 0,45). Sin embargo, en este subgrupo de 439 pacientes, el INL permanecía significativamente asociado al CACU alterado (p < 0,05).
Análisis univariante de la asociación de diferentes factores de riesgo cardiovascular con el CACU alterado
| CACU normal (n = 1.679) | CACU alterado (n = 137) | p | |
|---|---|---|---|
| Antecedentes familiares de ECV (%) | 158 (9,4) | 18 (13,1) | NS |
| Edad (años) | 52,46 ± 10,82 | 58,12 ± 11,15 | < 0,01 |
| Varones (%) | 1275 (75,94) | 111 (81,02) | NS |
| Obesidad (%) | 437 (26,03) | 55 (40,15) | < 0,01 |
| Tabaquismo (%) | 435 (25,95) | 43 (31,42) | NS |
| Hipertensión arterial (%) | 520 (31,06) | 92 (67,21) | < 0,01 |
| Diabetes mellitus tipo 2 (%) | 197 (11,72) | 52 (38,03) | < 0,01 |
| HOMA-IR > 2 (%) | 689 (50,6) | 79 (73,8) | < 0,01 |
| Dislipidemia (%) | 842 (52,07) | 92 (72,46) | < 0,01 |
| FGRe patológico (%) | 72 (4,3) | 18 (13,1) | < 0,01 |
| INL | 1,97 ± 0,80 | 2,30 ± 1,16 | < 0,01 |
| Proteína C-reactiva (mg/dL)a | 0,56 ± 0,50 | 0,49 ± 0,90 | NS |
CACU: cociente albúmina/creatinina urinario; ECV: enfermedades cardiovasculares; FGRe: filtrado glomerular renal estimado; HOMA-IR: Homeostatic Model Assesment of Insulin Resistance; INL: índice neutrófilo linfocito.
Tras el análisis univariante, se realizó un modelo de regresión logística incluyendo todas las variables anteriormente significativas. Como muestra la tabla 3, todos los factores de riesgo vascular, a excepción de la obesidad, se mantuvieron significativa e independientemente asociados a la presencia del CACU alterado. El valor del INL persistió como marcador independiente de alteración del CACU (OR: 1,45, p < 0,01). En un modelo alternativo, se incluyó el HOMA-IR en vez de la presencia de diabetes para evitar la colinealidad. El HOMA-IR fue significativo en la identificación del CACU alterado (OR: 1,11; p < 0,01), persistiendo la capacidad de predicción del INL. Este modelo se presenta en la tabla 1 complementaria. En el subgrupo de 439 pacientes en los que se disponía de niveles de PCR se realizaron 2 modelos multivariantes con las mismas variables de ajuste. En el primero se utilizó el INL como estimador de inflamación, resultando significativamente asociado con la alteración del CACU (OR: 1,6; p < 0,01; tabla 2 complementaria). Sin embargo, en el segundo modelo, se utilizó la PCR como marcador inflamatorio que no resultó significativamente asociado al CACU alterado (OR: 0,94; p > 0,05; tabla 3 complementaria).
Análisis multivariante de la asociación de diferentes factores de riesgo cardiovascular con el CACU alterado
| Variable | OR (IC del 95%) | p |
|---|---|---|
| Edad | 1,03 (1,01-1,05) | 0,01 |
| Obesidad | 1,30 (0,86-1,97) | NS |
| Hipertensión arterial | 3,28 (2,12-5,04) | < 0,01 |
| Diabetes mellitus | 3,40 (2,17-5,32) | < 0,01 |
| Dislipidemia | 2,22 (1,44-3,43) | < 0,01 |
| FGRe patológico | 2,87 (1,52-5,41) | < 0,01 |
| INL (por unidad) | 1,45 (1,20-1,74) | < 0,01 |
FGRe: filtrado glomerular renal estimado; INL: índice neutrófilo linfocito; OR: odds ratio.
Posteriormente, se estudió la relación entre el INL y los diferentes factores de riesgo cardiovascular. En nuestro estudio la presencia de hipertensión, diabetes, tabaquismo u obesidad no se asociaba a cambios significativos en el INL. Por otro lado el efecto antiinflamatorio de las estatinas sobre el endotelio podría afectar a la relación entre el INL y la aparición del CACU alterado23,24. En nuestra serie, los 196 pacientes que se encontraban bajo tratamiento con estatinas presentaron valores menores, aunque no estadísticamente significativos del INL (1,89 ± 0,85 para el grupo con estatinas vs. 2,01 ± 0,83 para el grupo sin estatinas, p > 0,05). Sin embargo, si se observaron diferencias estadísticamente significativas entre el INL de los pacientes que presentaban HOMA-IR > 2, respecto a los no insulinorresistentes (1,94 ± 0,78 vs. 2,05 ± 0,89 p < 0,05).
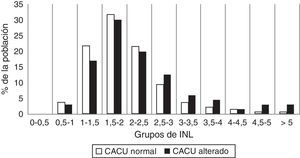
A continuación, se analizó la distribución del INL en nuestra muestra. Para ello se dividió a la población en 2 grupos según presentaran o no alteración del CACU. Posteriormente, los pacientes de ambos subgrupos se categorizaron en 11 estratos del INL de 0,5 unidades de amplitud, desde un INL 0-0,5 hasta un INL > 5. Como muestra la figura 1, el 87,1% de la población presentaba unos niveles del INL entre 1 y 3. Por otro lado, a partir de un valor del INL > 2,5 la proporción relativa de pacientes con alteración del CACU estaba claramente aumentada.
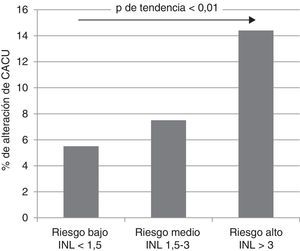
Tras estos resultados, se procedió a la búsqueda del punto de corte del INL con mayor capacidad de discriminación de alteración del CACU mediante la realización de un análisis de sensibilidad. Para ello, se calcularon la sensibilidad, la especificidad y los valores predictivos positivos y negativos de los valores del INL entre 1,5 y 3 con los resultados que se muestran en la tabla 4. En ella, se observa que los valores del INL más bajos tenían mayor sensibilidad para detectar alteraciones del CACU, mientras que aquellos más altos tenían mayor especificidad. Los resultados de este análisis permitieron definir los valores de 1,5 y 3 como p untos de corte de los subgrupos de riesgo, debido a la mayor sensibilidad del primero y a la mayor especificidad del segundo. Se dividió a la población en 3 grupos de riesgo de alteración del CACU según el INL: los pacientes con riesgo bajo (INL < 1,5), intermedio (INL entre 1,5 y 3) y alto (INL > 3). En la figura 2, se muestra la distribución de la alteración del CACU en los 3 grupos, destacando un aumento progresivo y significativo de la proporción relativa de alteración del CACU a medida que los valores del INL aumentaban.
Análisis de sensibilidad del INL en la predicción del CACU alterado
| INL > 1,5 | INL > 2 | INL > 2,5 | INL > 3 | |
|---|---|---|---|---|
| Sensibilidad | 0,80 | 0,5 | 0,3 | 0,18 |
| Especificidad | 0,29 | 0,6 | 0,82 | 0,91 |
| VPP | 0,08 | 0,09 | 0,12 | 0,14 |
| VPN | 0,95 | 0,94 | 0,93 | 0,93 |
INL: índice neutrófilo linfocito; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
Finalmente, los puntos de corte de los subgrupos de riesgo fueron incluidos en un modelo multivariante que se muestra en la tabla 5. Los pacientes con INL entre 1,5 y 3, mostraron una OR de 1,68 en comparación con aquellos con un INL < 1,5. Los pacientes con un INL > 3 vieron aumentado su riesgo hasta una OR de 3,14 en la misma comparación. Se procedió posteriormente al análisis de este nuevo modelo, que presentó un índice de mejoría de la discriminación significativo (p < 0,01), con un índice de mejoría de la reclasificación del 4,05%. Este resultado implicaría la reclasificación de 74 pacientes de la muestra.
Análisis multivariante de factores de riesgo vascular y diferentes puntos de corte del INL en relación con la presencia del CACU alterado
| Variable | OR (IC del 95%) | p |
|---|---|---|
| Edad | 1,03 (1,01-1,05) | 0,01 |
| Obesidad | 1,29 (0,85-1,95) | NS |
| Hipertensión arterial | 3,32 (2,16-5,11) | < 0,01 |
| Diabetes mellitus | 3,51 (2,25-5,49) | < 0,01 |
| Dislipidemia | 2,18 (1,42-3,35) | < 0,01 |
| FGRe patológico | 2,86 (1,51-5,41) | < 0,01 |
| Índice neutrófilo-linfocito | ||
| INL 1,5-3 | Comparador | 0,01 |
| INL 1,5-3 | 1,68 (1,03-2,76) | 0,03 |
| INL > 3 | 3,14 (1,63-6,04) | 0,01 |
FGRe: filtrado glomerular renal estimado; INL: índice neutrófilo linfocito; OR: odds ratio.
La inflamación desempeña un papel fundamental en la fisiopatología de las ECV6. Entre los diversos marcadores inflamatorios, el INL ha sido valorado previamente como predictor de mortalidad en pacientes con síndrome coronario agudo25, insuficiencia cardíaca congestiva26, diabetes mellitus27 y en aquellos sometidos a coronariografía diagnóstica28. Además, recientemente ha sido evaluado como factor de riesgo en el estudio de pacientes asintomáticos de la cohorte del estudio de Framingham, donde se confirma como potente predictor de mortalidad cardiovascular. En este estudio se cita el INL como parámetro con una capacidad potencial de reclasificación del riesgo cardiovascular mayor que otros marcadores como son la PCR ultrasensible, el fragmento N-terminal del péptido natriurético tipo B, la hemoglobina glucosilada, la cistatina y la homocisteína29.
Publicaciones previas han descrito una asociación entre los valores del INL y la excreción urinaria de albúmina, tanto en pacientes diabéticos30 como en sujetos con enfermedad renal crónica sintomática31. La importancia de la detección de los mecanismos de daño endotelial para la prevención de ECV justifica el uso de la alteración del CACU como marcador precoz tanto de riesgo cardiovascular, como de disfunción endotelial sistémica5,32-35. En la cohorte del presente estudio, una población de sujetos clínicamente asintomáticos, el INL también se correlacionó de forma significativa con la alteración del CACU. Esta asociación es independiente de otros factores de riesgo asociados al CACU alterado.
Distintos estudios han relacionado la inflamación con una mayor insulinorresistencia36. Recientemente, Lou et al.19 presentaron una correlación significativa entre un aumento del INL y el HOMA-IR (OR: 7,23 p < 0,01). La asociación entre la insulinorresistencia y el INL se ve confirmada en nuestra muestra. El efecto antiinflamatorio de los inhibidores de la HMG-CoA reductasa también podría tener influencia sobre el INL23,24. Sin embargo, el artículo de Gungoren et al.37 no demostró diferencias estadísticamente significativas del INL entre sujetos tratados con estatinas y no tratados. En nuestro análisis, los pacientes en tratamiento con estatinas presentaron un INL menor sin que las diferencias entre grupos llegaran a la significación estadística. Nuestros resultados podrían justificar el estudio de esta asociación en cohortes con un mayor tamaño muestral. Por último, nuestros resultados muestran que el INL presenta una mayor capacidad de detección del CACU alterado en comparación con la PCR, que no resultó estadísticamente significativa en este contexto.
Para que un marcador de riesgo resulte útil se requiere conocer los valores del mismo con significado clínico. La correcta selección de estos valores se puede realizar mediante el análisis de la sensibilidad y la especificidad de distintos puntos de corte del marcador en estudio. Esta metodología ha sido extensamente estudiada y utilizada en la selección de puntos de corte en otras situaciones clínicas22. En nuestro análisis, cabe destacar la limitada sensibilidad que ofrecen todos los valores, a excepción del punto de corte en 1,5, que presenta una sensibilidad de 0,80. La sensibilidad es el resultado del cociente entre los verdaderos positivos de un test y los pacientes enfermos de la población. Una sensibilidad deficiente está en relación con un aumento de los falsos negativos del test. Como los factores de riesgo clásicos de la alteración del CACU no se encuentran asociados al INL en nuestra muestra, muchos pacientes serían falsos negativos al considerar solo el INL. Sin embargo, la presencia de diferencias estadísticamente significativas entre los grupos del INL en el análisis multivariado valida la utilidad de los puntos de corte seleccionados por este método.
La principal limitación de nuestro estudio es su diseño transversal, que impide establecer una relación causal entre la presencia del INL y la aparición del CACU alterado. Por otra parte, aunque la población reclutada de un solo centro limita la extrapolación de los resultados, la procedencia de los pacientes de distintas regiones de España y el tamaño muestral aumentan la validez externa del estudio. En cualquier caso, la asociación entre el INL y la alteración del CACU merece ser estudiada en mayor profundidad para determinar su papel no solo como marcador económico, rápido y no invasivo de riesgo cardiovascular sino como potencial diana terapéutica.
El presente estudio demuestra una correlación significativa entre unos valores con significado clínico del INL y el riesgo cardiovascular y de disfunción endotelial sistémica asociada a enfermedad microvascular en una cohorte de pacientes asintomáticos. Las limitaciones previamente consignadas hacen que sean necesarios estudios de intervención, multicéntricos y con un mayor número de desenlaces para valorar otras posibles implicaciones clínicas de este hallazgo.
ConclusiónEl INL puede constituir una nueva herramienta en la valoración del riesgo cardiovascular y de la disfunción endotelial sistémica asociada a enfermedad microvascular en pacientes asintomáticos.
FinanciaciónEl estudio no ha requerido financiación externa.
Conflicto de interesesNo existen conflictos de interés.