Introducción: Los resultados de los trasplantes efectuados con donantes con criterios expandidos (DCE) son inferiores a los obtenidos con donantes con criterios estándar (DCS). Para optimizar su evolución, se podría reducir su tiempo de isquemia fría (TIF) reduciendo su daño de preservación. Comparamos los resultados obtenidos al aplicar TIF <15 horas tanto a DCE como a DCS. Material y métodos: Realizamos un estudio unicéntrico, de cohortes, prospectivo, de casos incidentes de trasplante renal de cadáver entre junio de 2003 y diciembre de 2007. El tiempo mínimo de seguimiento fue de 12 meses. Comparamos los datos de los donantes, de los receptores y de la evolución de los trasplantes efectuados con DCE frente a los de los DCS. Resultados: El TIF para los DCE (N = 24) y para los DCS (N = 50) fue, respectivamente, de 9,3 ± 2,5 y 8,3 ± 3,3 horas (p = 0,18). No encontramos diferencias significativas entre los receptores de DCE y DCS en cuanto a: no función primaria del injerto 4,2 vs. 4%, retardo en la función del injerto 16,7 vs. 10%, complicaciones quirúrgicas 25 vs. 16% y rechazos agudos 8,3 vs. 2%. El filtrado glomerular estimado al año para los DCS fue de 65,8 ± 14,9 ml/min y para los DCE de 49,4 ± 12,5 ml/min (p <0,0001). La supervivencia renal al año fue del 95,8% para los receptores de DCE y del 94% para los DCS (p = 0,75). Conclusiones: La aplicación de TIF cortos a los DCE permite conseguir una evolución similar a la de los DCS, aunque su función renal sea en todo momento inferior.
INTRODUCCIÓN
Se ha definido al DCE como aquel que proporciona un riñón cuyo riesgo relativo de fracaso excede en 1,7 al de un riñón procedente de un dónate ideal1. Los injertos de DCE tienen una supervivencia estimada a los tres meses, al año y a los tres años del 92,3, 84,5 y 68%, respectivamente, frente a los trasplantes efectuados con riñones de DCS, que tienen en los mismos períodos supervivencias del 94,6, 90,6 y 79,4%2.
A pesar de este peor pronóstico, el uso de los riñones de DCE está plenamente justificado desde que se demostró que la supervivencia del receptor de uno de estos injertos era mayor que si permanecía en lista de espera3. Los DCE son cada vez más habituales, y su uso se hace casi obligado si queremos mantener las actuales tasas de trasplante y así satisfacer la continua y creciente demanda de injertos.
En este contexto, deberíamos adoptar las medidas necesarias para tratar de optimizar los resultados de los trasplantes efectuados con DCE4. Para ello, se ha propuesto una correcta selección de los receptores e intentar reducir el daño en la preservación de los injertos.
En cuanto a la selección de los receptores, no se aconseja emplear estos injertos para retrasplantes ni para pacientes menores de 40 años5, pero sí para receptores con baja demanda metabólica (ancianos y pacientes con índice de masa corporal bajo) y para pacientes con escaso riesgo inmunológico (PRA bajo)6. Incluso se ha llegado a proponer emparejar a los donantes y los receptores según perfiles de supervivencia estimada7.
En cuanto a la reducción del daño de preservación, se intenta conseguir a través de dos estrategias: preservar los injertos con máquinas de perfusión8 o reducir los tiempos de isquemia fría (TIF)9.
El TIF prolongado favorece el retardo en la función del injerto, y ambos condicionan un aumento en la incidencia de rechazos y del tiempo de hospitalización, una peor función renal y una disminución de la supervivencia renal a largo plazo. Incluso en los donantes menores de 50 años (DCS), se ha descrito que el TIF actúa como un factor de riesgo independiente de la supervivencia del injerto10. Por lo tanto, parece razonable intentar optimizar los resultados de los DCE utilizando TIF cortos.
En el presente trabajo, comparamos la evolución de los trasplantes efectuados con DCE y con DCS en un programa de trasplante que utiliza TIF cortos, con el objetivo de reducir tanto el retraso en la función del injerto como la incidencia de rechazos agudos y mejorar así su supervivencia y su función renal.
MATERIAL Y MÉTODOS
Se realizó un estudio de cohortes prospectivo de casos incidentes de trasplante renal realizados a pacientes de un único centro desde junio de 2003 hasta diciembre de 2007. Todos se realizaron con receptores y donantes adultos, y ninguno procedía de donante vivo. Se excluyeron para el estudio los trasplantes realizados con TIF >15 horas. Todos los receptores han sido seguidos durante al menos un año tras el trasplante o hasta la pérdida del injerto o hasta su fallecimiento, finalizando la recogida de datos en diciembre de 2008.
El protocolo inmunosupresor empleado fue el siguiente: hasta junio de 2005, triple terapia inmunosupresora con corticoides a dosis decrecientes, micofenolato mofetil (MFM) y tacrolimus (TAC), con niveles objetivo en el primer mes entre 10 y 15 ng/ml. Desde junio de 2005 añadimos terapia de inducción con basiliximab en los enfermos con bajo riesgo inmunológico (PARA 50%). Al introducir la terapia de inducción, se redujeron los niveles objetivo de TAC en el primer mes postrasplante a 5-10 ng/ml. Cuando apareció intolerancia digestiva al MMF, éste fue sustituido por ácido micofenólico con cobertura entérica (EC-MPS). No se ha modificado la inmunosupresión según el tipo de donante (DCE o DCS). Ante la sospecha de rechazo agudo, se realiza biopsia renal y se inicia tratamiento empírico con bolos de 6 metilprednisolona; si no se confirma el diagnóstico histológicamente, se suspenden los corticoides. Si el rechazo es corticorresistente, se trata con timoglobulina. El rechazo humoral se trata con plasmaféresis e inmunoglobulinas. Las biopsias se clasifican según los criterios de Banff-97.
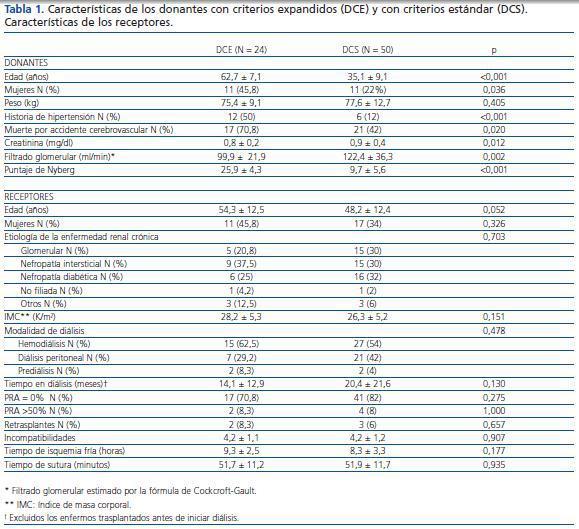
Se define al DCE como todo donante con más de 60 años o que tiene entre 50 y 59 años con al menos dos de las siguientes condiciones: historia de hipertensión, muerte por accidente cerebrovascular y creatinina previa a la extracción superior a 1,5 mg/dl1. De acuerdo con esta definición, se clasificó a los receptores en dos grupos según el tipo de donante que proporcionó el injerto: aquellos que recibían un injerto procedente de un donante con criterios estándar y aquéllos cuyo donante era un donante con criterios expandidos.
Las variables de estudio se recogieron de forma prospectiva, recopilando tanto los datos correspondientes a los donantes como a los receptores y la evolución de los trasplantes.
Con respecto a los donantes, se recogieron: edad, sexo, peso, antecedentes de hipertensión, causa de la muerte, creatinina previa a la extracción renal y filtrado glomerular estimado (FGe) por la fórmula de Cockcroft-Gault11. Además, se calculó la puntuación pronóstica del trasplante según el score de Nyberg12.
Con respecto a los receptores, se recogió: la edad, el sexo, la causa de la enfermedad renal crónica, el índice de masa corporal, el tipo de diálisis y su duración, el número de trasplante que recibían, el número de incompatibilidades entre donante y receptor, el PRA en el momento del trasplante y el pico máximo en los sueros históricos, considerando como hiperinmunizados a aquéllos con PARA >50%. El TIF se ha contabilizado desde el momento del clampaje en el donante hasta el momento de desclampaje en el receptor.
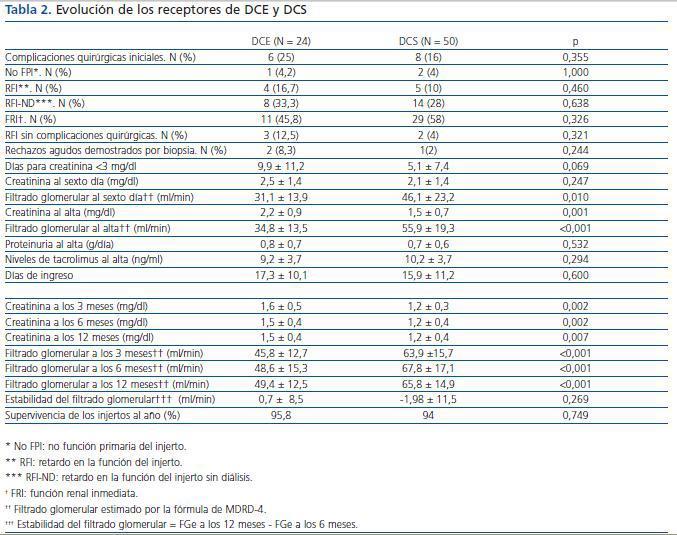
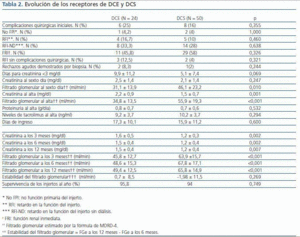
La evolución inicial de los trasplantes incluyó el registro de las complicaciones quirúrgicas: trombosis arterial o venosa, hemorragia que requiera reintervención, fístulas urológicas, estenosis del uréter que condicione deterioro de la función renal y linfoceles que produzcan complicaciones secundarias por su tamaño o localización. La evolución de la función renal en el posoperatorio inmediato se clasificó en cuatro grupos: no función primaria (NFP), retardo en la función del injerto (RFI), retardo en la función del injerto sin precisar diálisis (RFI-ND) y función renal inmediata (FRI). La NFP implicó la falta de funcionamiento en todo momento, fuese por la causa que fuese. EL RFI incluyó a todos los enfermos que se dializaron durante la primera semana postrasplante. EL RFI-ND y la FRI se han definido según la tasa de reducción de creatinina13,14. Si ésta es mayor del 30%, incluimos al paciente en el grupo de FRI; y si es menor, en el de RFI-ND. Además, se recogió el número de días necesarios para que la creatinina fuese menor de 3 mg/dl y la creatinina y el FGe por la fórmula de MDRD-415 al sexto día postrasplante.
Al alta se registraron los días de ingreso, la proteinuria, la creatinina, el FGe por la fórmula MDRD-4 y los niveles de tacrolimus.
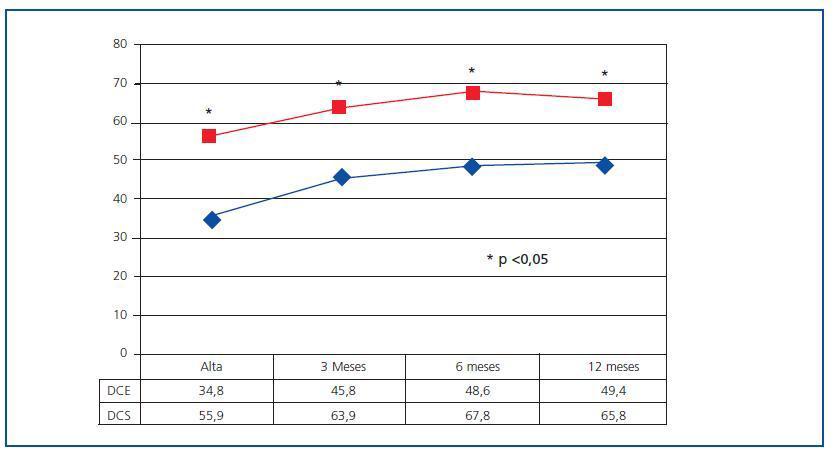
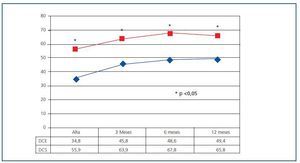
En el seguimiento, se han recogido prospectivamente los datos analíticos de todos los pacientes a los 3, 6 y 12 meses, y posteriormente con periodicidad anual. Se ha calculado la estabilidad de la función del injerto en el primer año (FGe a los 12 meses-FGe a los 6 meses) y todos los episodios de rechazo agudo. Además, se registraron las pérdidas renales y exitus durante toda la evolución.
Análisis estadístico
Inicialmente, se realizó un análisis descriptivo de las variables de estudio comparando la normalidad de la distribución de las variables cuantitativas a través del test de Kolmogorov-Smirnov. Posteriormente, se realizó un análisis comparativo bivariante utilizando test paramétricos (T de Student y Chi cuadrado con prueba exacta de Fisher) o no paramétricos (U de Mann-Whitney), según el caso. Además, se empleó el test de log-rank para la comparación de curvas de supervivencia. La significación estadística se estableció para valores de p 15 horas debido al escaso número de pacientes de este tipo que tenemos. Sin embargo, creemos que nuestros resultados indican que se debe de hacer un esfuerzo por reducir los TIF para mejorar los resultados de los trasplantes, y que este esfuerzo debe ser máximo en el caso de los DCE, ya que de esta forma podremos optimizar los resultados de este tipo de injertos y así ofrecer a los receptores las mejores expectativas tanto en su evolución inicial como en la supervivencia de sus injertos y en su función renal.
En conclusión, el uso de tiempos de isquemia fría cortos permite realizar trasplantes renales con injertos de donantes con criterios expandidos con baja incidencia de retardo en la función del injerto y de rechazos agudos, consiguiendo además una buena supervivencia y una buena función renal a medio plazo. También permite conseguir una función renal muy estable, lo que puede condicionar una excelente supervivencia a largo plazo.
Tabla 1.
Tabla 2.
Figura 1.