El objetivo del presente estudio fue evaluar las concentraciones valle (Cpvalle) y la pauta posológica de tacrolimus tras la conversión de Prograf o Advagraf a Envarsus (nueva forma farmacéutica con tecnología Meltdose que mejora la absorción de fármacos liposolubles) en pacientes con trasplante renal estable, y su función renal.
Se seleccionaron los pacientes trasplantados renales estables que fueron convertidos a Envarsus. Se definieron dos periodos: basal y conversión (Envarsus), y se estratificaron en función de la forma farmacéutica utilizada en el periodo basal. Se incluyeron 61 pacientes (24 con Advagraf y 37 con Prograf), con una edad media de 52años. El tiempo medio postrasplante en el momento de la conversión a Envarsus fue de 76,3meses y el seguimiento medio en el periodo basal y conversión fue de 10,1 y 11,6meses, respectivamente.
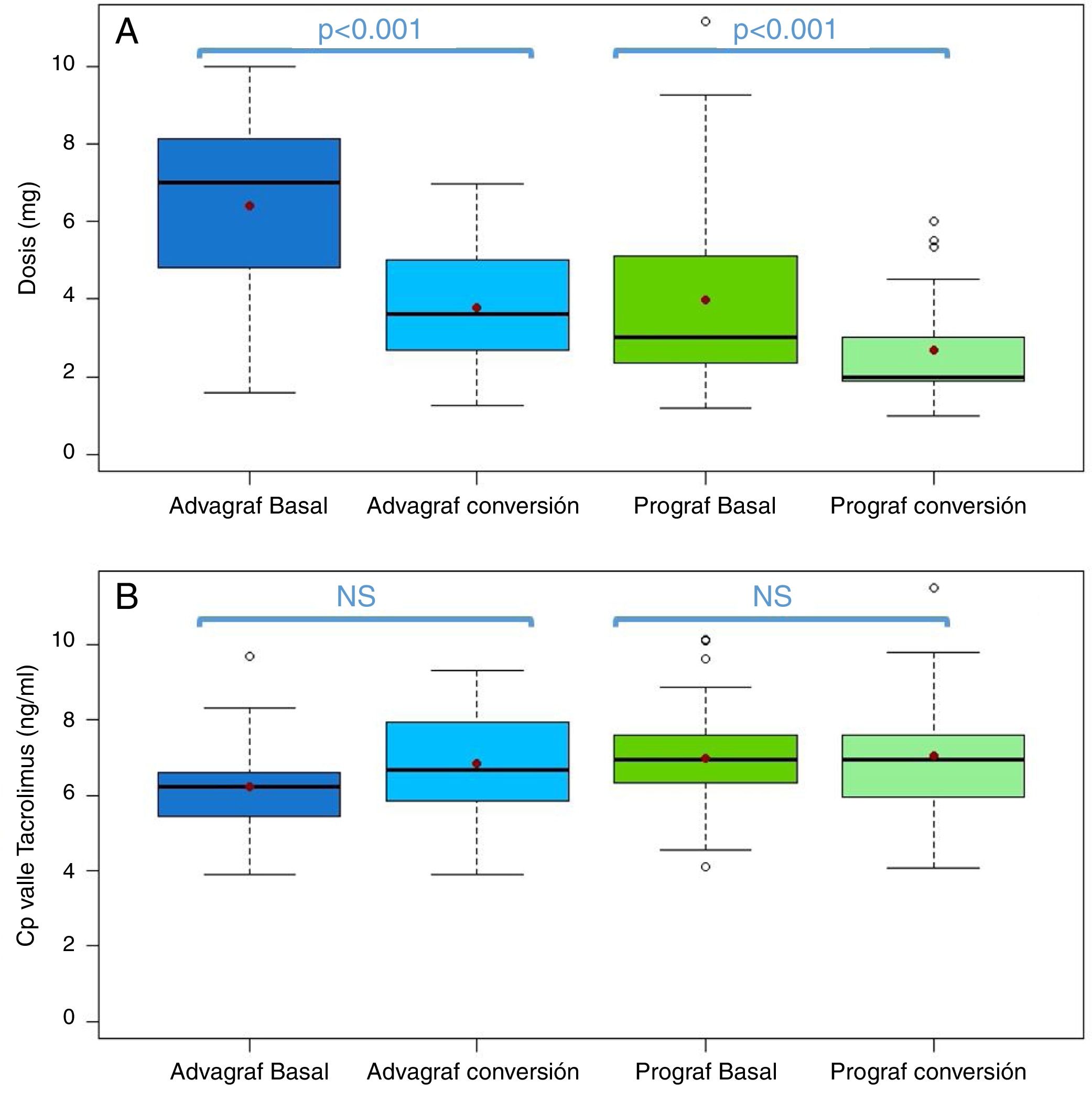
En el grupo Prograf y Envarsus las medianas Cpvalle fueron 6,6 vs 6,4ng/ml (p=0,636), con una dosis diaria media que disminuyó significativamente de 3 a 2mg (p<0,001), respectivamente, manteniendo el filtrado renal.
Las medianas Cpvalle en los grupos Advagraf y Envarsus fueron 5,7 y 6,3ng/ml (p=0,07), con una mediana de dosis diaria de 7 y 4mg (p<0,001), respectivamente, e igual función renal.
En pacientes trasplantados renales estables la conversión de Advagraf a Envarsus ha permitido reducir la dosis de tacrolimus un 42,9% y la de Prograf un 33,3% para mantener unas Cpvalle similares, sin que se altere la función renal.
The aim of this study was to evaluate the trough concentrations (Cptrough) and the tacrolimus dosage regimen after the conversion of Prograf or Advagraf to Envarsus (new pharmaceutical form with MeltDose technology that improves the absorption of fat-soluble drugs) in patients with stable renal transplantation, and their renal function.
We selected stable renal transplant patients who were converted to Envarsus. Two periods were defined: Baseline and Conversion (Envarsus) and they were stratified according to the pharmaceutical form used in the Baseline period. Sixty-one patients were included (24 with Advagraf and 37 with Prograf), with an average age of 52years. The mean post-transplant time at the time of conversion to Envarsus was 76.3months and the mean follow-up in the Baseline and Conversion period was 10.1months and 11.6months, respectively.
In the Prograf and Envarsus group, the Cptrough medians were 6.6 vs 6.4 ng/mL (P=.636), with a mean daily dose that decreased significantly from 3mg to 2mg (P<.001), respectively, maintaining the filtration rate.
The median Cptrough values in the Advagraf and Envarsus groups were 5.7ng/mL and 6.3ng/mL (P=.07), with a median daily dose of 7mg and 4mg (P<.001), respectively, and the same renal function.
In stable renal transplant patients, the conversion from Advagraf to Envarsus has allowed the dose of tacrolimus to be reduced by 42.9% and, in the case of Prograf, by 33.3%, maintaining similar Cptrough values, without renal function being altered.
En el momento actual la mayor parte de los regímenes de terapia inmunosupresora que se utilizan en trasplante renal incluyen tacrolimus1. La eficacia de la formulación de dos dosis al día de tacrolimus (Prograf) ha sido probada en múltiples estudios2. La conversión de la forma farmacéutica de liberación inmediata a una formulación de liberación prolongada (Advagraf) ha sido también estudiada en profundidad, y así Guirado et al.3, en el estudio español de conversión entre ambas formulaciones, probaron su eficacia y seguridad en el 96% de los pacientes, con una base de conversión de 1 a 1mg. La eficacia y la seguridad de estas dos formulaciones son similares y han sido constatadas en numerosos estudios de no inferioridad4.
Tacrolimus se caracteriza por un estrecho margen terapéutico y una gran variabilidad farmacocinética inter e intraindividual que obliga a una estrecha monitorización farmacocinética. La fuerte correlación entre el área bajo la curva y el nivel valle permite la individualización de la dosis únicamente mediante la monitorización de la concentración valle5-7.
Como resultado de la combinación de mala hidrosolubilidad, metabolización de tacrolimus en el tracto intestinal y la actividad de la bomba glicoproteína-P de los enterocitos del intestino se ha evidenciado que Prograf tiene una baja biodisponibilidad de tacrolimus, alrededor del 17% en receptores de trasplante renal8.
Por otro lado, la falta de adherencia es una causa común de pérdida del injerto9, y la constancia de que esta disminuye significativamente al cambiar de dos a una administración diaria del medicamento es un refuerzo más para el uso de formulaciones de una dosis única diaria10-12. Además de la mejor adherencia, el estudio español mostró que después de la conversión los pacientes claramente expresaban su preferencia por el tacrolimus de liberación prolongada, que permite una dosis diaria3.
Recientemente se ha comercializado una nueva forma farmacéutica de tacrolimus de liberación prolongada, Envarsus, que podría aunar un aumento de adherencia y de biodisponibilidad, ya que se administra una vez al día, al igual que ocurre con Advagraf, y su formulación se basa en el sistema de liberación Meltdose13, diseñado para aumentar la biodisponibilidad de los fármacos de baja hidrosolubilidad.
Se han llevado a cabo estudios de conversión de Prograf o Advagraf a Envarsus en los que se refleja que la biodisponibilidad de Envarsus es superior. Además, en la ficha técnica de Envarsus se indica que «Los pacientes que sean receptores de un alotrasplante, mantenidos con dos dosis diarias de Prograf (liberación inmediata) o Advagraf (una vez al día) y que requieran la conversión a una dosis diaria de Envarsus deben pasar a una dosis total diaria con una relación 1:0,7 (mg:mg) y, por consiguiente, la dosis de mantenimiento de Envarsus debe ser un 30% menor que la dosis de Prograf o Advagraf»14. Sin embargo, hasta el momento no se ha llevado a cabo ningún estudio utilizando los datos obtenidos a partir de la práctica diaria en el que se analice la conversión de las distintas formulaciones de tacrolimus a Envarsus.
El objetivo del presente estudio fue evaluar las concentraciones valle y la pauta posológica de tacrolimus tras la conversión de Prograf o Advagraf a Envarsus en pacientes con trasplante renal estable, así como evaluar su impacto en la función renal.
Material y métodosSe diseñó un estudio observacional retrospectivo. Se seleccionaron los pacientes trasplantados renales en el Hospital General Universitario de Alicante que fueron convertidos de Prograf o Advagraf a Envarsus entre enero de 2015 y abril de 2017. Se definieron dos periodos: basal (hasta el día antes del cambio a Envarsus) y conversión (a partir del cambio a Envarsus), y se estratificó en función de la forma farmacéutica utilizada durante el periodo basal: inmediata (Prograf) o prolongada (Advagraf). Se limitó el tiempo máximo de seguimiento en ambos periodos a un año. El esquema inmunosupresor general en el momento del trasplante renal consistió en tacrolimus (dosis inicial: Prograf 0,1mg/kg/12h vía oral [v.o.] o Advagraf 0,2mg/kg/díav.o.; las dosis siguientes se ajustaron para mantener una concentración valle de tacrolimus entre 8-10ng/ml durante el primer mes y posteriormente entre 6-8ng/ml), micofenolato de mofetilo 1g/12hv.o. o ácido micofenólico 360mg/12hv.o., basiliximab o timoglobulina en pacientes de alto riesgo y corticoides en pauta descendente.
Los criterios de inclusión fueron: pacientes adultos receptores de un injerto renal de donante cadáver que fueron convertidos a Envarsus para mejorar la adherencia al tratamiento (en el caso de Prograf) o por sospecha de toxicidad o baja biodisponibilidad, con más de 6meses de evolución postrasplante, con función renal estable, y de los que se disponía al menos de tres concentraciones valle de tacrolimus en estado estacionario en ambos periodos de estudio.
Las muestras sanguíneas se extrajeron en valle (previa a la dosis de la mañana). La concentración de tacrolimus se determinó en sangre total mediante enzimoinmunoanálisis (TAC-DRI Thermo) (rango de ensayo: 1,2-30ng/ml).
Las variables se recogieron retrospectivamente a partir de los informes farmacocinéticos de la Unidad de Farmacocinética Clínica del Servicio de Farmacia. El tiempo máximo de seguimiento en ambos periodos fue de un año. Para cada paciente se calculó la concentración valle media de tacrolimus, la dosis media, la concentración media normalizada por la dosis (cociente entre la concentración valle de tacrolimus y la dosis) y la función renal media, evaluada mediante el filtrado glomerular calculado con la fórmula CKD-EPI. Además, se cuantificó la variabilidad intraindividual a partir del coeficiente de variación de las concentraciones valle de tacrolimus para los dos periodos y las dos formulaciones.
Las variables cuantitativas se describieron mediante media e intervalo de confianza del 95% (IC95%) o mediana (percentil 25-percentil 75 (p25-p75)) y la comparación de las variables cuantitativas se analizó mediante un ANOVA de una vía o la prueba U de Mann-Whitney en función del tipo de distribución de las variables. Se estableció el nivel de significación estadística en un alfa<0,05. El análisis estadístico y gráfico se realizó con el paquete estadístico informático R (http://www.R-project.org).
ResultadosSe incluyeron 61 pacientes, 37 de ellos varones y 24 mujeres, todos de raza blanca y trasplantados en el Hospital General Universitario de Alicante por residir en la zona de influencia, con una edad media de 52,6años (IC95%: 48,7-54,5) y un peso medio de 69,9kg (IC95%: 66,8-72,9). El tiempo medio postrasplante en el momento de la conversión a Envarsus fue de 76,3meses (IC95%: 21,8-104,2). El número de concentraciones valle de tacrolimus incluidas en el periodo basal y conversión fue de 217 y 298, respectivamente. El seguimiento medio en el periodo basal y conversión fue de 10,1meses (IC95%: 9,0-11,1) y 11,6meses (IC95%: 10,8-12,4), respectivamente.
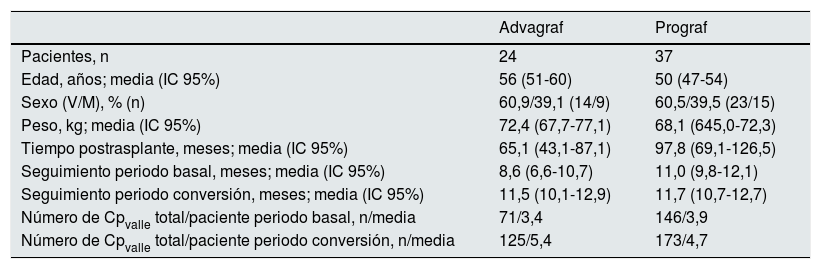
De los 61 pacientes incluidos, 24 estaban en tratamiento con Advagraf y 37 estaban con Prograf. Los datos demográficos estratificados por forma farmacéutica (Prograf/Advagraf) se detallan en la tabla 1.
Datos demográficos basales de los pacientes convertidos a Envarsus estratificados en función de la forma farmacéutica utilizada durante el periodo basal (Prograf o Advagraf)
| Advagraf | Prograf | |
|---|---|---|
| Pacientes, n | 24 | 37 |
| Edad, años; media (IC 95%) | 56 (51-60) | 50 (47-54) |
| Sexo (V/M), % (n) | 60,9/39,1 (14/9) | 60,5/39,5 (23/15) |
| Peso, kg; media (IC 95%) | 72,4 (67,7-77,1) | 68,1 (645,0-72,3) |
| Tiempo postrasplante, meses; media (IC 95%) | 65,1 (43,1-87,1) | 97,8 (69,1-126,5) |
| Seguimiento periodo basal, meses; media (IC 95%) | 8,6 (6,6-10,7) | 11,0 (9,8-12,1) |
| Seguimiento periodo conversión, meses; media (IC 95%) | 11,5 (10,1-12,9) | 11,7 (10,7-12,7) |
| Número de Cpvalle total/paciente periodo basal, n/media | 71/3,4 | 146/3,9 |
| Número de Cpvalle total/paciente periodo conversión, n/media | 125/5,4 | 173/4,7 |
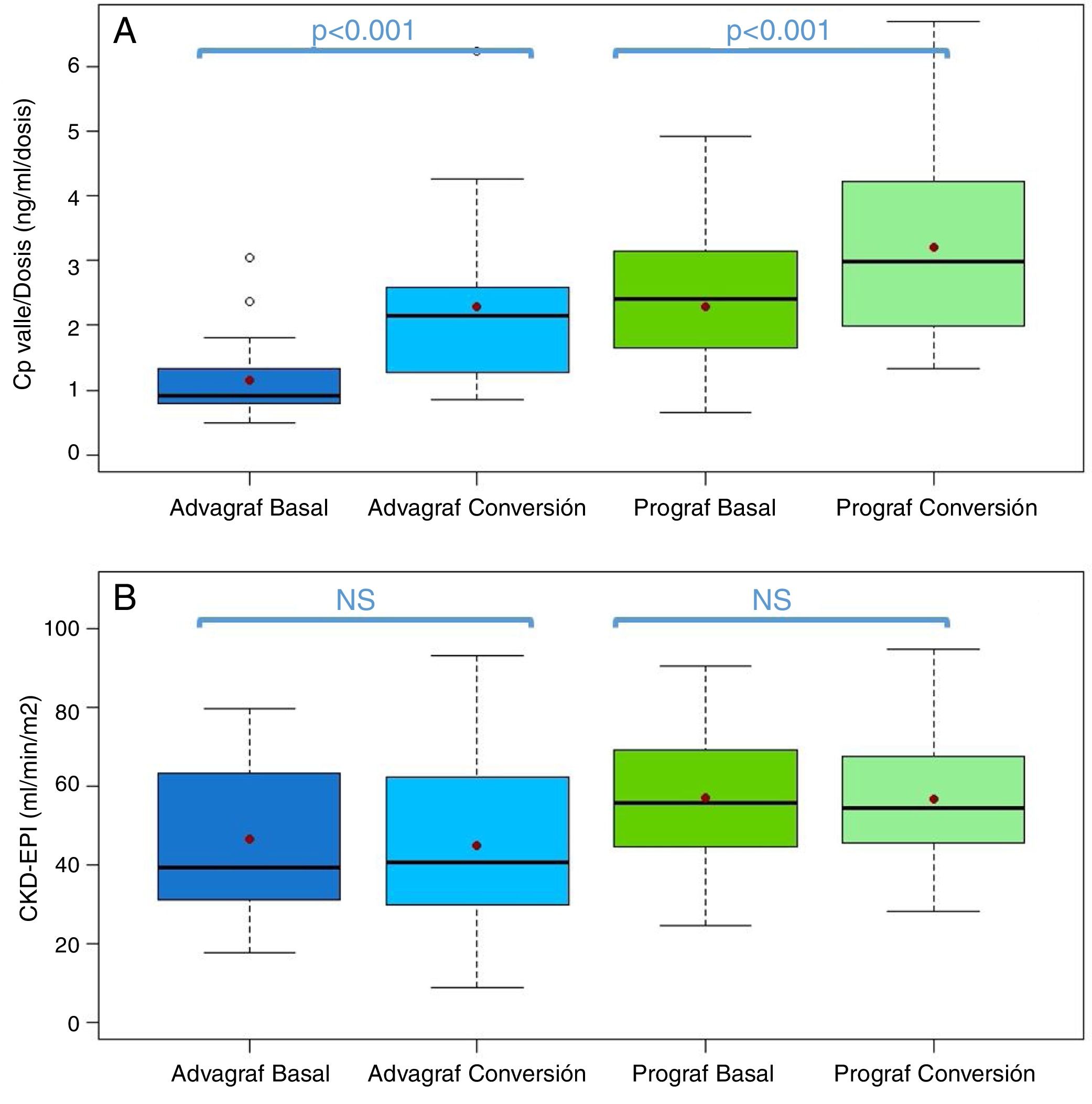
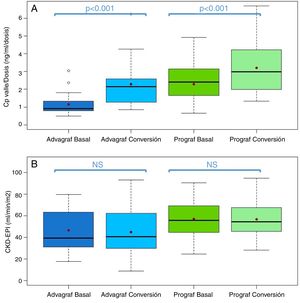
En el grupo Prograf y Envarsus las medianas de las concentraciones valle de tacrolimus fueron similares: 6,6ng/ml (p25-p75: 5,2-7,7) vs 6,4ng/ml (p25-p75: 4,7-8,2) (p=0,636), con una dosis diaria que disminuyó significativamente de 3mg (p25-p75: 2-4,5) a 2mg (p25-p75: 1,75-3,0) (p<0,001), mientras que el filtrador glomerular se mantuvo estable con valores de 53,7ml/min/m2 (p25-p75: 38,7-66,2) y 50,0ml/min/m2 (p25-p75: 34,4-62,2) (p=0,06), respectivamente. La mediana de la concentración valle de tacrolimus normalizada por la dosis fue un 35% superior en el periodo conversión (basal: 2,3 ng/ml/mg [p25-p75: 1,4-3,1] vs. conversión: 3,1 ng/ml/mg [p25-p75: 1,9-4,6]) (p<0,001) (figs. 1 y 2). La variabilidad intraindividual observada fue del 21,4% en el periodo basal y del 15,1% durante el periodo conversión.
Boxplot de: A)cociente concentración valle de tacrolimus −dosis diaria, y B)filtrado glomerular (expresado como CKD-EPI) del periodo basal y conversión estratificado en función de la forma farmacéutica utilizada durante el periodo basal (Prograf o Advagraf). El punto rojo corresponde con la media.
NS: no significativo.
En el mismo sentido, concentraciones valle de tacrolimus en los grupos Advagraf y Envarsus fueron comparables (mediana: 5,7ng/ml [p25-p75: 4,8-7,0] vs 6,3ng/ml [p25-p75: 5,1-7,7]) (p=0,07), con una mediana de dosis diaria de 7mg (p25-p75: 4-8) y 4mg (p25-p75: 2,75-5) (p<0,001) y un filtrador glomerular que se mantuvo estable en los dos periodos con valores de 36,4ml/min/m2 (p25-p75: 28,8-33,65) y 33,7ml/min/m2 (p25-p75: 25,9-59,5) (p=0,248), respectivamente. En el periodo conversión la mediana de la concentración valle de tacrolimus normalizada por la dosis fue un 83,3% superior a la del periodo basal: 0,9 ng/ml/mg (p25-p75: 0,74-1,43) vs 1,65 ng/ml/mg (p25-p75: 1,28-2,85), respectivamente (p<0,001) (figs. 1 y 2). Al igual que ocurre con Prograf, la variabilidad intraindividual en el periodo basal fue superior a la observada en el periodo conversión (25,7% vs. 17,4%, respectivamente).
El cambio de forma farmacéutica de tacrolimus supuso una reducción de la dosis de tacrolimus al cambiar de Advagraf a Envarsus de un 42,9% y en el caso de Prograf del 33,3% para mantener unas concentraciones valle de tacrolimus similares.
DiscusiónEn la población analizada, para mantener concentraciones valle de tacrolimus estables fue necesario realizar una reducción de dosis de tacrolimus al cambiar de Advagraf a Envarsus del 42,9%, y en el caso de Prograf a Envarsus, del 33,3%. Envarsus es una nueva forma farmacéutica recientemente comercializada con tecnología Meltdose desarrollada por Veloxis Pharmaceuticals que permite incrementar la biodisponibilidad de medicamentos liposolubles y el control en la liberación de estos en las formas farmacéuticas de liberación retardada13. De esta forma, actualmente disponemos de dos formas farmacéuticas de liberación retardada de tacrolimus, Advagraf y Envarsus, que se administran una vez al día. Distintos estudios han analizado el cambio de Prograf o Advagraf a Envarsus7,15-18. Sin embargo, a nuestro entender este es el primer estudio clínico de conversión de pacientes tratados con tacrolimus de liberación inmediata o prolongada a Envarsus. Nuestros resultados son similares a los obtenidos por otros autores. En un estudio de conversión de una forma de liberación inmediata (Prograf) a Envarsus en receptores de trasplante renal estables, Gaber et al.7 demostraron que con una disminución del 30% de la dosis de Prograf se obtenía con Envarsus un área bajo la curva y concentraciones valle similares pero con un pico, un porcentaje de fluctuación (cambio de las concentraciones de pico a valle respecto a la concentración media) y un vaivén o swing (que es el cambio de concentración de pico a valle respecto a la concentración mínima) significativamente menores. El incremento de la concentración valle de tacrolimus normalizada por la dosis o cociente concentración valle/dosis también es un indicador de aumento de biodisponibilidad; al igual que en nuestra serie, en que se incrementa en un 35% de Prograf a Envarsus y en un 83,3% de Advagraf a Envarsus, Rostaing et al.15 evidenciaron un incremento del mencionado cociente a los dos años del trasplante.
Resultados parecidos se han obtenido en la conversión entre las dos formas de liberación retardada (Advagraf a Envarsus). En el estudio farmacocinético ASTCOFF de conversión con dos secuencias (Prograf-Envarsus-Advagraf y Prograf-Advagraf-Envarsus) Tremblay et al.16 concluyeron que para alcanzar el mismo grado de exposición era necesario un 8% más de la dosis de Advagraf que de Prograf y que se precisaba una reducción del 36 y del 30%, respectivamente, en caso de pasar de estas formulaciones a Envarsus. De nuevo, resultados muy similares a los obtenidos en nuestro estudio.
En un estudio de cohortes, Niioka et al.17 también concluyen que para mantener la misma área bajo la curva es necesaria una mayor dosis de Advagraf que de Prograf, ya que tanto el área bajo la curva como la concentración valle fueron aproximadamente el 25% más bajas, lo que demostraría que Advagraf tendría una peor biodisponibilidad. En nuestro estudio también confirmamos que la biodisponibilidad de Advagraf es también ligeramente inferior a la de Prograf, ya que la reducción necesaria para mantener los mismos niveles fue un 9,6% mayor.
Esta reducción de dosis sería no solo necesaria en la conversión, sino también en la inducción, como ha puesto de manifiesto el estudio de Budde et al.19, que compara receptores con Envarsus frente a Prograf desde el momento del trasplante hasta el año de seguimiento. El grupo de Envarsus alcanzó los niveles objetivos más rápidamente que el de Prograf, aunque hay que destacar que recibían una dosis inicial mayor (0,17mg/kg frente a 0,1mg/kg), y a las 3semanas la dosis necesaria para alcanzar los mismos niveles era inferior. Estos datos refuerzan la idea de una mayor absorción inicial de Envarsus que la alcanzada por Advagraf, cuya inferioridad para alcanzar niveles en el postoperatorio inmediato respecto a Prograf había quedado ya demostrada18,20. Así, Wlodarczyk et al.18 muestran que usando la misma dosis de inicio, 0,2mg/kg/24h, el área bajo la curva de tacrolimus el día1 fue el 30% más baja para Advagraf que para Prograf (232 y 361ngh/ml, respectivamente), y que fue comparable el día14, pero utilizando dosis más altas de Advagraf. Las normas KDIGO concluyen específicamente que cuanto antes se alcancen los niveles terapéuticos de los inhibidores de la calcineurina más eficaz serán estos fármacos en la prevención del rechazo agudo21; de ahí la importancia de elegir la presentación farmacéutica del fármaco que antes alcance el nivel terapéutico en el posoperatorio inmediato.
La mejor biodisponibilidad y/o disminución del aclaramiento aparente varía con el tiempo, ya que los receptores del estudio de Budde et al.19 recibieron una dosis un 14% inferior de tacrolimus al año. En la extensión de este estudio, Rostaing et al.15 evidencian que la dosis de Envarsus era el 24% inferior que la de Prograf a los 24meses, datos similares a los obtenidos en nuestro estudio. Bunnapradist et al.22 aleatorizaron un grupo de receptores con trasplante renal estable a Prograf o Envarsus y objetivaron una reducción progresiva de la dosis administrada de Envarsus hasta el 25%, sin diferencias en los niveles valle.
Es de destacar que los estudios mencionados incluyen un número no desdeñable de receptores afroamericanos7,15,17,22, grupo de población que ha demostrado necesitar hasta el doble de dosis15 que la población caucásica para alcanzar los mismos niveles valle23. Nuestra población a estudio es homogénea al incluir solo pacientes caucásicos y proceder de un territorio geográfico muy limitado, lo que eliminaría posibles factores de confusión.
El hecho de que la falta de adherencia sea una causa común de pérdida del injerto9 y que disminuya significativamente al cambiar de dos tomas diarias de un fármaco a una única administración diaria10 haría inexcusable el uso de una formulación de tacrolimus de una dosis diaria, más cuando la absorción vespertina de Prograf es inferior a la matutina24,25. Además, la utilización de Advagraf reduce el coeficiente de variabilidad intraindividual a un 40% respecto a Prograf, lo que refuerza la idea del uso de una forma farmacéutica de administración una vez al día frente a dos administraciones26-28. En nuestro estudio la variabilidad intraindividual también disminuyó al convertir los pacientes de Prograf o Advagraf a Envarsus (CV: 21,4% vs 15,1% y 25,7% vs 17,4%, respectivamente).
Debido al estrecho margen terapéutico de tacrolimus y el diferente comportamiento farmacocinético, Prograf, Advagraf y Envarsus no son bioequivalentes y por lo tanto intercambiables, por lo que cambios en las formulaciones podrían condicionar importantes efectos adversos. Es por ello recomendable una estrecha monitorización farmacocinética en caso de realizar cambios en las formulaciones29, y de ahí el elevado número de determinaciones de concentración valle efectuadas en nuestro estudio tras la conversión a Envarsus (periodo basal: 217 vs periodo conversión: 298).
Una de las limitaciones más importante de nuestro estudio es su carácter observacional retrospectivo, y el hecho de que las determinaciones de tacrolimus en valle se han realizado ajustadas a la práctica clínica diaria en un medio ambulatorio, por lo que los seguimientos en ambos periodos no son exactamente los mismos y el tiempo desde el trasplante a la conversión para ambas formulaciones tiene una gran variabilidad (tabla 1). Sin embargo, tal y como hemos comentado, nuestros resultados son extrapolables a los estudios previos, si bien el porcentaje de reducción de dosis en el grupo Advagraf es mayor al descrito en otros estudios.
En conclusión, nuestro estudio muestra que Envarsus es una forma farmacéutica de tacrolimus que actualmente puede aportar beneficios a la inmunosupresión en el trasplante renal, ya que además de ser una formulación de tacrolimus de una dosis diaria, su mejor biodisponibilidad posibilita una reducción significativa de la dosis de tacrolimus para alcanzar una concentración valle similar, sin que se produzcan variaciones en la función renal.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.