El aumento de la rigidez arterial central (RAC) participa en la morbimortalidad cardiovascular de los enfermos con factores de riesgo vascular. El descenso del filtrado glomerular (FG) y el aumento de la excreción urinaria de albúmina (uALB) se relacionan con eventos cardiovasculares. Los mecanismos fisiopatológicos de esta asociación no están completamente definidos.
El objetivo de este estudio fue analizar la RAC, comparando varios marcadores, en sujetos con hipertensión arterial (HTA), diabetes mellitus (DM), enfermedad renal crónica (ERC) y su combinación, y estudiar la posible asociación de la RAC con la disfunción renal.
Material y métodosSe incluyeron 286 sujetos distribuidos en varios grupos: control; HTA; DM sin ERC; ERC sin DM; ERC con DM. Para la determinación de la RAC se usaron varios índices obtenidos por tonometría de aplanamiento: velocidad de pulso carótida-femoral (VPc-f) y gradiente de rigidez arterial periférica-aórtica (GRAp-a), entre otros. De la onda del pulso aórtico se obtuvo el índice de viabilidad subendocárdica (iBuckberg).
Para el estudio de la asociación entre los marcadores de rigidez arterial y la función renal se usaron la regresión múltiple, la regresión logística binaria y la multinomial, todas con ajuste multivariante.
ResultadosLos valores ajustados de la VPc-f (mediana [rango intercuartílico] [m/seg]) fueron significativamente mayores en los sujetos con DM (9 [1,2]); ERC (9,4 [0,7]) y DM+ERC (10,9 [0,7]) que en el grupo control (8,2 [1,3]) y grupo con HTA (8,3 [0,9]), p = 0,001. Los enfermos con DM+ERC tenían valores de VPc-f superiores a todos los demás grupos (p = 0,001). El GRAp-a de los enfermos fue significativamente inferior al de los controles, y el grupo con DM+ERC tenía valores significativamente inferiores a los de los otros grupos.
La VPc-f era el único marcador de rigidez aórtica que se asociaba de forma independiente e inversa con la magnitud del FG (β = –4, p = 0,001) y predecía la presencia de disminución del FG (OR [IC 95%]: 1,50 [1,17-1,92]; p = 0,001). La VPc-f era el único índice asociado de forma directa con la cuantía de la uALB (β = 0,15; p = 0,02) y predecía la existencia de una uALB anormal (OR: 1,66 [1,25-2,20], p = 0,001). La VPc-f también se asociaba con el iBuckberg (β = -2,73; p = 0,01).
En la regresión multinomial se confirmó que la VPc-f es un determinante significativo del FG y de la uALB. Por otra parte, el aumento de la VPc-f y la presencia de DM contribuían de forma significativa a la magnitud de la uALB.
ConclusionesLa rigidez aórtica aumenta en presencia de factores de riesgo vascular y es mayor cuando coexisten DM y ERC. El aumento de la rigidez aórtica se asocia de forma inversa con el FG y directamente con la magnitud de la albuminuria, y tiene capacidad predictiva de una disminución del FG y de una albuminuria anormal. La VPc-f es el parámetro de rigidez aórtica que se asocia de forma más consistente con la disfunción renal. El aumento de la rigidez aórtica podría ser uno de los patomecanismos que vinculan la disfunción renal con los eventos cardiovasculares.
Increased aortic or central arterial stiffness (CAS) is a major factor in cardiovascular morbidity and mortality in patients with vascular risk factors. Decreased glomerular filtration rate (GFR) and increased urinary albumin excretion (uALB) are associated with lethal and non-lethal cardiovascular events. The pathophysiological mechanisms of this association are not fully defined.
The aim of this study was: 1.- To analyze the CAS, comparing several markers, in subjects with arterial hypertension (HTN), diabetes mellitus (DM), chronic kidney disease (CKD) and their combination. 2.- To study the possible association of CAS with renal dysfunction (decrease in GFR and increase in uALB).
Material and methodsA total of 286 subjects were included, divided into several groups: Control (n: 38); HTN (n:51); DM without CKD (n:26); CKD without DM (n:77); CKD with DM (n:94). Several indices obtained by applanation tonometry were used to determine the CAS: carotid-femoral pulse velocity (VPc-f); central pulse pressure (cPP); augmentation index standardized to a cardiac frequency of 75 l/min (IA75); peripheral / aortic arterial stiffness gradient (ASGp-a). As a marker of peripheral arterial stiffness, the carotid-radial pulse velocity (PVc-r) was determined. The ASGp-a was calculated from the PVc-r /PVc-f ratio. The subendocardial viability index (iBuckberg) was obtained from the aortic pulse wave.
Multiple regression, binary logistic regression, and multinomial regression were used to study the association between arterial stiffness markers and renal function.
ResultsThe adjusted values of the PVc-f [(median (interquartile range) (m/sec)] were significantly higher in subjects with DM [(9 (1.2)], CKD [(9.4 (0.7)] and DM with CKD [(10.9 (0.7)] than in the control group [(8.2 (1.3)] and group with HTN [(8.3 (0.9)], (p:0.001). Patients with DM with CKD had higher PVc-f values than all other groups (p: 0.001). The ASGp-a of the patients was significantly lower than that of the controls, and the group with DM with CKD had significantly lower values than the other groups. The cPP in the DM with CKD group was significantly higher than in the other groups. All patients had an AI75 higher than the control group.
When all aortic stiffness markers were introduced together in the regression, PV c-f was the only one that, after multivariate adjustment, was independently and inversely associated with GFR (β; –4, p:0.001) and predicted the presence of GFR decrease (< 60mL/min/1.73 m2), [(OR (95%CI): 1.50 (1.17-1.92; p:0.001]. The PVc-f was the only index directly associated with albuminuria (β: 0.15, p: 0.02) and predicted the existence of abnormal albuminuria (> 30mg/g), [(OR; 1.66 (1.25-2.20), p:0.001)]. The PVc-f was also associated with the iBuckberg (β: -2.73, p: 0.01).
Multinomial regression confirmed that PVc-f is a significant determinant of GFR and uALB. On the other hand, the increase in PVc-f and the presence of DM contribute significantly to the magnitude of albuminuria.
ConclusionsAortic stiffness increases in the presence of vascular risk factors such as hypertension, DM and CKD. This increase is greater when DM and CKD coexist. Increased aortic stiffness is inversely associated with GFR and directly with uALB, and is predictive of decreased GFR and abnormal uALB. The VPc-f is the parameter of aortic stiffness that is most consistently associated with renal dysfunction. Increased aortic stiffness could be one of the pathomechanisms linking renal dysfunction to cardiovascular events.
En la hipertensión arterial (HTA), en la diabetes mellitus (DM) y en la enfermedad renal crónica (ERC) hay un aumento de la rigidez aórtica que participa en la patogénesis de las lesiones de órganos diana y en la morbimortalidad cardiovascular1,2. En el incremento de la rigidez aórtica intervienen múltiples factores (hemodinámicos, metabólicos, inflamatorios, disfunción endotelial y calcificación vascular, entre otros)3–5. En estas situaciones se produce un envejecimiento vascular precoz (EVA) caracterizado por la pérdida de la elasticidad de la pared vascular y un incremento de la rigidez arterial.
Preservar la elasticidad vascular es crucial, ya que la distensión y recuperación del calibre de las arterias en la sístole y diástole, respectivamente, actúa como un amortiguador del flujo sanguíneo, permitiendo la perfusión continua de los órganos diana. En individuos jóvenes, la elasticidad de la pared vascular disminuye de manera secuencial desde la aorta hasta las arterias musculares periféricas. De manera fisiológica, existe un gradiente entre la rigidez periférica y la aórtica (gradiente de rigidez arterial periférica-aórtica [GRAp-a]). Este gradiente facilita una onda refleja que retorna de manera retardada a la aorta ascendente durante la diástole, lo que sostiene la presión arterial diastólica y mitiga la presión pulsátil en la microcirculación.
Con la senescencia vascular disminuye la elasticidad de la pared vascular y aumenta la rigidez aórtica. El aumento de la rigidez aórtica promueve un retorno acelerado de la onda refleja durante la sístole, lo que condiciona un incremento de la presión arterial sistólica central (PASc) y la presión del pulso central (PPc). Además, puede producirse una atenuación o inversión del GRAp-a, lo que facilita la conversión de un flujo sanguíneo continuo fisiológico en la microcirculación a un flujo pulsátil. Este último en microcirculación induce daño en órganos de baja resistencia como el riñón y el cerebro4.
Existe una íntima relación entre la rigidez aórtica y la velocidad de pulso carótida-femoral (VPc-f), considerada como el estándar de oro para determinar la rigidez aórtica. La velocidad de pulso carótida-radial (VPc-r) refleja la rigidez de las arterias musculares (rigidez periférica) y la relación VPc-r/VPc-f se ha utilizado como índice del GRAp-a6. Otros parámetros derivados de la morfología de la onda de pulso central como la PPc y el índice de aumento (IA), que expresa qué parte de la PPc corresponde a la onda refleja, han sido propuestos como marcadores subrogados de la rigidez aórtica7.
Hay estudios que han evaluado de forma aislada en sujetos con HTA, DM o ERC la asociación de alguno de los parámetros de rigidez arterial con la función renal8–11. Los resultados de la asociación entre la rigidez aórtica y el filtrado glomerular (FG) no son consistentes. Mientras que algunos estudios objetivan una asociación significativa9,10, en otros la relación entre la rigidez aórtica y FG desaparece tras el ajuste multivariable11. El mecanismo por el que un aumento de la rigidez aórtica produce disfunción renal no está completamente aclarado.
En nuestro conocimiento, no existen investigaciones que analicen de forma conjunta y usando los distintos marcadores de rigidez arterial aórtica, la posible asociación entre rigidez aórtica y función renal en pacientes con diferentes factores de riesgo vascular (HTA, DM, ERC y su asociación). Dado que los diversos índices de rigidez arterial central (RAC) están influenciados por variables diferentes, pero hemodinámicamente relacionadas7,12, el análisis de su posible asociación con la función renal podría contribuir a clarificar los mecanismos fisiopatológicos de dicha relación.
Nuestro objetivo fue doble. Por una parte, describir el comportamiento de la RAC en sujetos con diferentes factores de riesgo vascular y, por otra parte, analizar el impacto de la rigidez aórtica sobre la función renal valorada por el FG y la albuminuria.
Material y métodosPacientesSe estudiaron 286 sujetos evaluados y revisados en la consulta externa de nefrología de un hospital universitario. Se incluyeron enfermos previamente diagnosticados de HTA, DM, ERC o una combinación de ellas. Para ser incluidos en el estudio, se requirió que los enfermos no hubiesen tenido ningún evento cardiovascular en los últimos seis meses, que la función renal estuviese estable en los últimos tres meses y que en este tiempo no hubiese modificaciones en la terapia antidiabética, antihipertensiva o hipolipemiante. Se excluyeron sujetos con enfermedades inmunológicas que requiriesen terapia inmunosupresora, aquellos diagnosticados de procesos malignos, de HTA de origen endocrino o aneurisma aórtico, y los que presentaban fibrilación auricular que dificultase la captación de la onda de pulso por tonometría.
Se recogieron en la historia clínica datos de enfermedad cardiovascular (ECV) que requiriese ingreso hospitalario y de arteriopatía periférica diagnosticada por síntomas y/o un índice tobillo-brazo inferior a 0,9. Se investigó el hábito tabáquico considerando como fumadores tanto los activos como los que lo habían abandonado frente a los que nunca habían fumado (no fumadores).
Se determinaron en sangre los parámetros hematológicos y bioquímicos que incluían hemograma, creatinina, lípidos, ácido úrico, glucemia, hemoglobina glicada (en DM), metabolismo fosfocálcico con parathormona (PTH) y vitamina D (en ERC). El filtrado glomerular estimado (FGe) se calculó por la fórmula chronic kidney disease, epidemiology (CKD-EPI). En todos los sujetos se determinó, en la primera orina de la mañana, el cociente albúmina-creatinina.
Como controles de los parámetros de función arterial se utilizaron 38 sujetos sanos, no fumadores, sin historia de ECV ni otras enfermedades y con función renal normal. En estos sujetos solo se determinaron parámetros analíticos de función renal.
Se consideró la presencia de ERC cuando existía un cociente albúmina/creatinina en orina superior a 30mg/g y/o un FGe inferior a 60mL/min/1,73 m2. Dado que puede haber mayor riesgo de morbimortalidad cardiovascular en sujetos con valores de albuminuria en rango normal, se añadió un subgrupo de albuminuria (normal-alta) que fue clasificada en las siguientes categorías: normal 0-10mg/g; normal-alta: 11-29mg/g; aumento moderado: 30-299mg/g; aumento severo: más de 300mg/g. Los sujetos fueron distribuidos en cinco grupos: control, HTA, DM, ERC y ERC más DM.
Todos los sujetos dieron su consentimiento tras ser informados y el estudio cumplió todos los requisitos éticos del centro donde se realizó.
Estudio de la rigidez arterial aórtica y periféricaTras permanecer en reposo durante 15 minutos, se tomó la presión arterial braquial (PAb), media de tres determinaciones, con un aparato oscilométrico Omron M3 (Omron electrónica Iberia, S.A.U., Madrid). El estudio de la presión arterial central (PAc) y de la VPc-f se hizo mediante tonometría de aplanamiento usando un dispositivo SphygmoCor (AtCor Medical, Sidney, Australia). De la onda de pulso obtenida por tonometría sobre la arteria radial y usando una función de transferencia generalizada, se obtuvo la onda de presión aórtica central y sus diferentes componentes (la PASc, la presión arterial diastólica central [PADc] y la presión de pulso central [PPc]). En la onda de la presión aórtica generada se identificó el punto de unión de la onda incidente anterógrada y la onda reflejada (punto de inflexión). La presión de aumento (PAu) fue la PASc máxima menos la presión en el punto de inflexión. El IA se definió como la PAu dividida entre la PPc y se expresa como porcentaje. Dada la influencia de la frecuencia cardiaca (FC) sobre el IA, el dispositivo SphygmoCor estandariza el IA a una FC de 75 L/min (IA75). Para la determinación de la velocidad de pulso carótida-femoral (representativa de la rigidez aórtica o central), la onda de pulso se obtuvo de forma secuencial sobre la arteria carótida común y la arteria femoral, calculándose el tiempo de recorrido entre los dos puntos a partir de la diferencia entre la onda R del registro electrocardiográfico simultáneo y el inicio de la onda de pulso en los respectivos sitios arteriales. Con la misma técnica, pero usando la arteria radial, se determinó la VPc-r, representativa de la rigidez arterial periférica. De la relación VPc-r/VPc-f se calculó el GRAp-a.
De la onda de pulso aórtica también se derivó el índice de viabilidad subendocárdica o índice de Buckberg (iBuckberg) que resulta de la integral tiempo-presión diastólica/ integral tiempo-presión sistólica, y que representa una medida en reposo del aporte y consumo de oxígeno del miocardio13. En el 44% de los enfermos con ERC y en 42% del grupo con ERC+DM se estudió el grado de calcificación de la aorta abdominal mediante una radiografía lateral de columna lumbar determinándose el índice de Kauppila (iKauppila)14.
Análisis estadísticoLas variables cualitativas se expresan como frecuencias relativas. Las variables continuas se expresan como media±desviación estándar (x±DE) cuando la distribución era normal y como mediana (rango intercuartílico [IQR]) en el caso de distribución no normal. Algunas de las variables con distribución muy sesgada como el cociente albúmina/creatinina en orina, fueron convertidas a sus logaritmos naturales. Para establecer la normalidad de la distribución de las variables se usaron las pruebas de Shapiro-Wilk y Kolmogorov-Smirnov dependiendo del tamaño de la muestra.
La comparación de las variables cualitativas entre los grupos se hizo usando el test χ2 y la de las variables cuantitativas mediante el análisis de la varianza (ANOVA) de un factor con ajuste a covariables (ANCOVA) que podrían incidir en los resultados. Se usó el ANOVA de dos factores para analizar el posible efecto de dos variables cualitativas y su posible interacción sobre la variable dependiente de interés. Para maximizar posibles diferencias en la función renal entre los grupos y cuando se cumplía el requisito de igualdad de matrices de covarianza, se usó el análisis multivariado de la varianza (MANOVA) introduciendo como variables dependientes el FGe y la albuminuria.
El estudio de la relación entre variables se hizo mediante el coeficiente de correlación de Pearson o de Spearman dependiendo de su distribución. La relación independiente entre variables se investigó mediante la regresión lineal múltiple seleccionando las covariables potenciales que demostraban correlación significativa. Para valorar los efectos independientes y el valor predictivo de los parámetros de rigidez arterial sobre la función renal (FGe y albuminuria) se usó la regresión logística binaria. Para una mayor precisión de la capacidad predictiva de los marcadores de rigidez arterial sobre la función renal y su posible interacción con la DM, se usó la regresión logística multinomial utilizando como variable dependiente categórica cuatro posibles clases de la función renal: normal (albuminuria y FGe normales); albuminuria (albúmina/creatinina en orina superior a 30mg/g); reducción del FGe (FGe inferior a 60mL/min/1,73 m2); reducción del FGe y albuminuria (FGe inferior a 60 L/min/1,73 m2 y albúmina/creatinina en orina superior a 30mg/g), y las cuatro categorías de albuminuria (normal, normal-alta, moderada y severa). En estos análisis, como categorías de referencia se usaron la función renal normal (FGe ≥ 60mL/min/1,73 m2 y albuminuria ≤ 30mg/g) y la albuminuria normal (≤ 10mg/g), respectivamente.
En los resultados estadísticos se consideraron significativos valores de p <0,05. Todos los análisis estadísticos se hicieron con el programa estadístico IBM SPSS (Statistical Package for the Social Sciences), versión 25 para Windows.
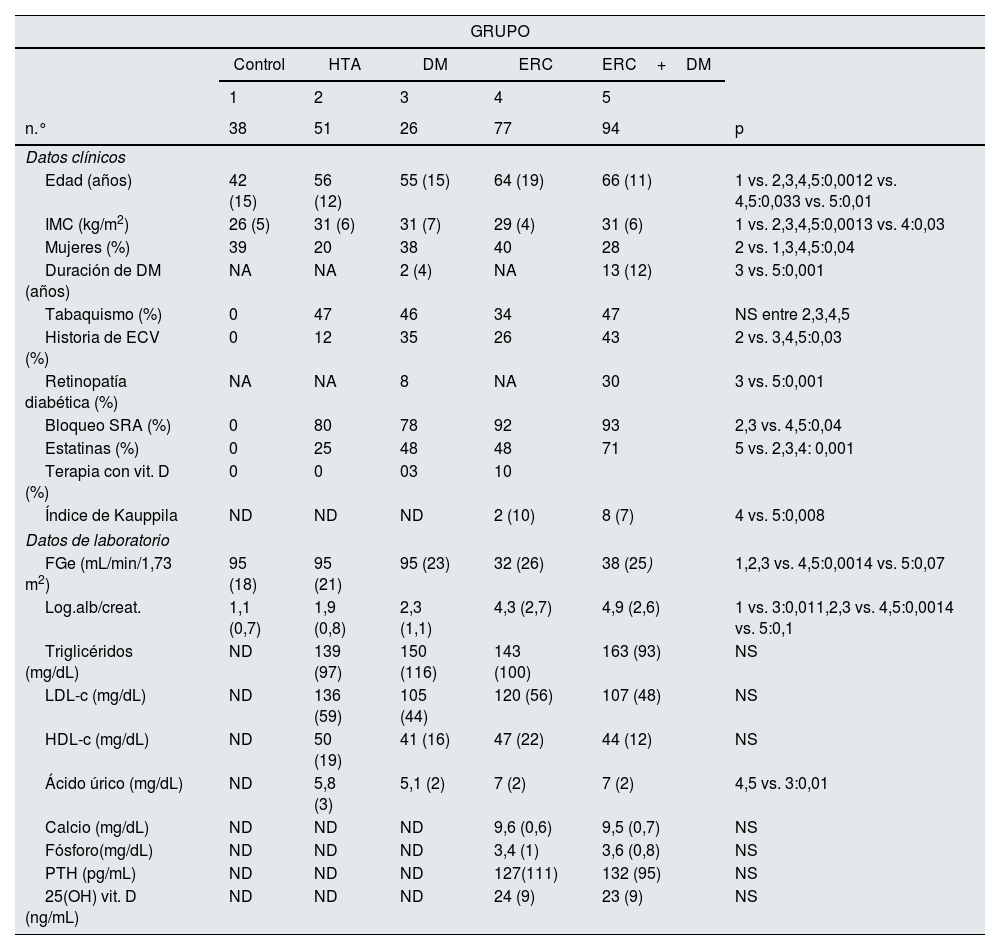
ResultadosEstudiamos 286 sujetos que se distribuyeron en cinco grupos: 1) grupo control, 2) pacientes con HTA esencial sin ERC, 3) pacientes con DM sin ERC, 4) pacientes con ERC sin DM y 5) pacientes con ERC más DM. En la tabla 1 se expresan las características clínicas y los datos de laboratorio de los grupos. Había diferencias significativas entre los grupos en la edad, índice de masa corporal (IMC), porcentaje de mujeres, antecedentes de ECV, terapia con bloqueadores del sistema renina-angiotensina (SRA) y con estatinas. La duración de la DM, la presencia de retinopatía y la terapia con insulina eran mayores y más frecuentes en los que además de DM tenían ERC. La nefropatía subyacente en el grupo con ERC era nefroangiosclerosis: 58,4%; glomerulonefritis crónica (GNC): 24,7%; otras (poliquistosis renal, pielonefritis crónica, no filiada): 16,9%. En el grupo con ERC+DM la nefropatía era nefroangiosclerosis: 42,6%; nefropatía diabética (ND): 56,4% y GNC:1%.
Datos clínicos y de laboratorio
| GRUPO | ||||||
|---|---|---|---|---|---|---|
| Control | HTA | DM | ERC | ERC+DM | ||
| 1 | 2 | 3 | 4 | 5 | ||
| n.° | 38 | 51 | 26 | 77 | 94 | p |
| Datos clínicos | ||||||
| Edad (años) | 42 (15) | 56 (12) | 55 (15) | 64 (19) | 66 (11) | 1 vs. 2,3,4,5:0,0012 vs. 4,5:0,033 vs. 5:0,01 |
| IMC (kg/m2) | 26 (5) | 31 (6) | 31 (7) | 29 (4) | 31 (6) | 1 vs. 2,3,4,5:0,0013 vs. 4:0,03 |
| Mujeres (%) | 39 | 20 | 38 | 40 | 28 | 2 vs. 1,3,4,5:0,04 |
| Duración de DM (años) | NA | NA | 2 (4) | NA | 13 (12) | 3 vs. 5:0,001 |
| Tabaquismo (%) | 0 | 47 | 46 | 34 | 47 | NS entre 2,3,4,5 |
| Historia de ECV (%) | 0 | 12 | 35 | 26 | 43 | 2 vs. 3,4,5:0,03 |
| Retinopatía diabética (%) | NA | NA | 8 | NA | 30 | 3 vs. 5:0,001 |
| Bloqueo SRA (%) | 0 | 80 | 78 | 92 | 93 | 2,3 vs. 4,5:0,04 |
| Estatinas (%) | 0 | 25 | 48 | 48 | 71 | 5 vs. 2,3,4: 0,001 |
| Terapia con vit. D (%) | 0 | 0 | 03 | 10 | ||
| Índice de Kauppila | ND | ND | ND | 2 (10) | 8 (7) | 4 vs. 5:0,008 |
| Datos de laboratorio | ||||||
| FGe (mL/min/1,73 m2) | 95 (18) | 95 (21) | 95 (23) | 32 (26) | 38 (25) | 1,2,3 vs. 4,5:0,0014 vs. 5:0,07 |
| Log.alb/creat. | 1,1 (0,7) | 1,9 (0,8) | 2,3 (1,1) | 4,3 (2,7) | 4,9 (2,6) | 1 vs. 3:0,011,2,3 vs. 4,5:0,0014 vs. 5:0,1 |
| Triglicéridos (mg/dL) | ND | 139 (97) | 150 (116) | 143 (100) | 163 (93) | NS |
| LDL-c (mg/dL) | ND | 136 (59) | 105 (44) | 120 (56) | 107 (48) | NS |
| HDL-c (mg/dL) | ND | 50 (19) | 41 (16) | 47 (22) | 44 (12) | NS |
| Ácido úrico (mg/dL) | ND | 5,8 (3) | 5,1 (2) | 7 (2) | 7 (2) | 4,5 vs. 3:0,01 |
| Calcio (mg/dL) | ND | ND | ND | 9,6 (0,6) | 9,5 (0,7) | NS |
| Fósforo(mg/dL) | ND | ND | ND | 3,4 (1) | 3,6 (0,8) | NS |
| PTH (pg/mL) | ND | ND | ND | 127(111) | 132 (95) | NS |
| 25(OH) vit. D (ng/mL) | ND | ND | ND | 24 (9) | 23 (9) | NS |
Datos expresados como mediana (rango intercuartílico) o porcentaje (%); DM: diabetes mellitus; ECV: enfermedad cardiovascular; ERC: enfermedad renal crónica; FGe: filtrado glomerular estimado; HDL-c: colesterol de lipoproteínas de alta densidad; HTA: hipertensión arterial; IMC: índice de masa corporal; LDL-c: colesterol de lipoproteínas de baja densidad; Log.alb/creat.: logaritmo del cociente albúmina/creatinina; NA: no aplicable; ND: no determinado; NS: no significativo; PTH: parathormona; SRA: sistema renina angiotensina.
El FGe era significativamente más bajo y la albuminuria más alta en los grupos con ERC (tabla 1). Aunque en el ANOVA se observaron diferencias cuantitativas, pero no estadísticamente significativas en el FGe y en la albuminuria entre los grupos con ERC y ERC+DM, el análisis multivariante de la varianza evidenció diferencias significativas del FGe y logaritmo del cociente albúmina/creatinina (log.alb./creat.) ([ERC: FGe: 39{2}; ERC+DM: FGe: 48{3} mL/min/1,73 m2, p = 0,015]; [ERC: log-alb/creat. 4,43{0,2}; ERC+DM: log.alb./creat. 5,05, p = 0,021]). Cuando se introducían en el MANOVA como covariables la VPc-f y el GRAp-a, persistía la diferencia en el FGe (36 vs. 50mL/min/1,73 m2, p = 0,001), pero desaparecía en el log.alb/creat. (4,6 vs. 4,9, p = 0,3).
El porcentaje y la intensidad de calcificaciones de aorta abdominal fueron significativamente mayores en el grupo con ERC+DM frente al grupo con ERC (87 vs. 65%, p = 0,02 y iKauppila 8 [7] vs. 2 [10], p = 0,008), respectivamente.
El porcentaje de enfermos con ERC estadio 1+2 y 3a+3b fue mayor en los sujetos con ERC+DM que en los que no tenían DM (24,5 y 58,1% vs. 14,3 y 41,6%, respectivamente, p = 0,04) mientras que en el grupo con ERC sin DM fue mayor el porcentaje con ERC estadio 4 (41,6 vs. 25,8%, p = 0,04). No hubo diferencias significativas en el porcentaje de sujetos con ERC estadio 5 (1 vs. 2,6%).
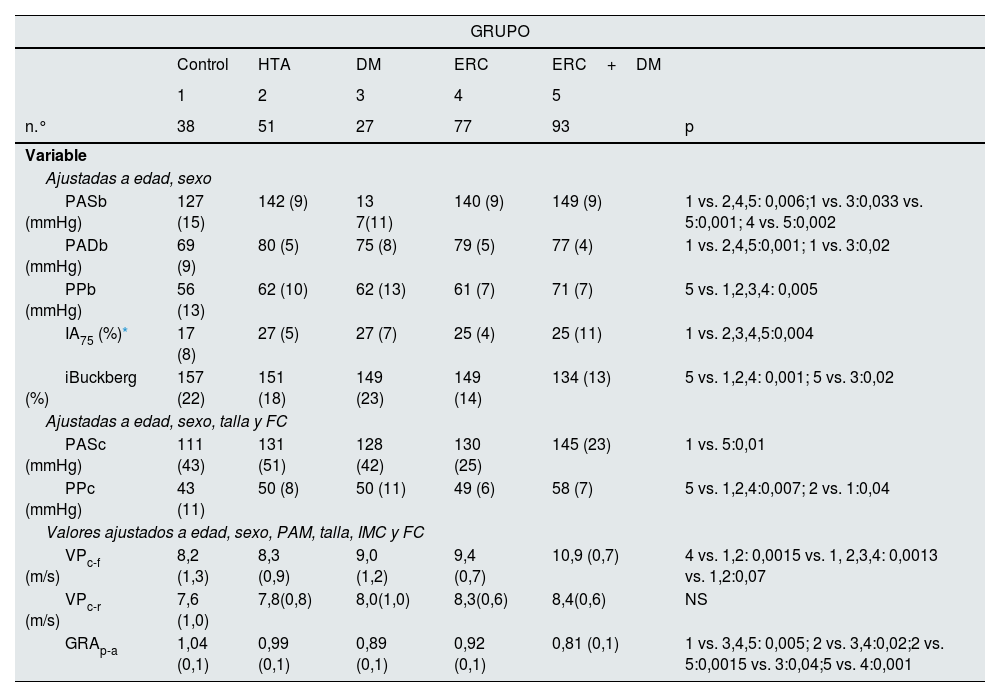
En la tabla 2 se expresan los valores de la PAb y PPc, y los parámetros de rigidez arterial y del índice de viabilidad subendocárdica tras el ajuste multivariante. Los valores de los marcadores de pulsatilidad eran significativamente más elevados en el grupo que combinaba ERC y DM. Los grupos con ERC con y sin DM tenían valores de VPc-f mayores. Los valores del GRAp-a eran significativamente inferiores en los grupos con ERC y DM. El iBuckberg de los pacientes con ERC+DM era significativamente inferior al de los otros grupos.
Parámetros hemodinámicos y de rigidez arterial
| GRUPO | ||||||
|---|---|---|---|---|---|---|
| Control | HTA | DM | ERC | ERC+DM | ||
| 1 | 2 | 3 | 4 | 5 | ||
| n.° | 38 | 51 | 27 | 77 | 93 | p |
| Variable | ||||||
| Ajustadas a edad, sexo | ||||||
| PASb (mmHg) | 127 (15) | 142 (9) | 13 7(11) | 140 (9) | 149 (9) | 1 vs. 2,4,5: 0,006;1 vs. 3:0,033 vs. 5:0,001; 4 vs. 5:0,002 |
| PADb (mmHg) | 69 (9) | 80 (5) | 75 (8) | 79 (5) | 77 (4) | 1 vs. 2,4,5:0,001; 1 vs. 3:0,02 |
| PPb (mmHg) | 56 (13) | 62 (10) | 62 (13) | 61 (7) | 71 (7) | 5 vs. 1,2,3,4: 0,005 |
| IA75 (%)* | 17 (8) | 27 (5) | 27 (7) | 25 (4) | 25 (11) | 1 vs. 2,3,4,5:0,004 |
| iBuckberg (%) | 157 (22) | 151 (18) | 149 (23) | 149 (14) | 134 (13) | 5 vs. 1,2,4: 0,001; 5 vs. 3:0,02 |
| Ajustadas a edad, sexo, talla y FC | ||||||
| PASc (mmHg) | 111 (43) | 131 (51) | 128 (42) | 130 (25) | 145 (23) | 1 vs. 5:0,01 |
| PPc (mmHg) | 43 (11) | 50 (8) | 50 (11) | 49 (6) | 58 (7) | 5 vs. 1,2,4:0,007; 2 vs. 1:0,04 |
| Valores ajustados a edad, sexo, PAM, talla, IMC y FC | ||||||
| VPc-f (m/s) | 8,2 (1,3) | 8,3 (0,9) | 9,0 (1,2) | 9,4 (0,7) | 10,9 (0,7) | 4 vs. 1,2: 0,0015 vs. 1, 2,3,4: 0,0013 vs. 1,2:0,07 |
| VPc-r (m/s) | 7,6 (1,0) | 7,8(0,8) | 8,0(1,0) | 8,3(0,6) | 8,4(0,6) | NS |
| GRAp-a | 1,04 (0,1) | 0,99 (0,1) | 0,89 (0,1) | 0,92 (0,1) | 0,81 (0,1) | 1 vs. 3,4,5: 0,005; 2 vs. 3,4:0,02;2 vs. 5:0,0015 vs. 3:0,04;5 vs. 4:0,001 |
DM: diabetes mellitus; ERC: enfermedad renal crónica; FC: frecuencia cardiaca; GRAp-a: gradiente de rigidez arterial periférica-aórtica; HTA: hipertensión arterial; IA75: índice de aumento a frecuencia cardiaca de 75 L/min; iBuckberg: índice de Buckberg; IMC: índice de masa corporal; NS: no significativo; PAM: presión arterial media; PASb: presión arterial sistólica; PASc: presión arterial sistólica central; PPb: presión de pulso braquial; PPc: presión de pulso central; VPc-f: velocidad de pulso carótida-femoral; VPc-r: velocidad de pulso carótida-radial.
La VPc-f ajustada a edad y presión arterial media (PAM) de los sujetos sin nefropatía (8,47±0,2) era significativamente inferior a la de los diagnosticados de nefroangiosclerosis (9,73±0,2), GNC (9,65±0,3) (p = 0,003) y ND (11,30±0,2) (p = 0,001), La VPc-f de estos últimos era significativamente mayor que la de los enfermos con nefroangiosclerosis y GNC (p = 0,001).
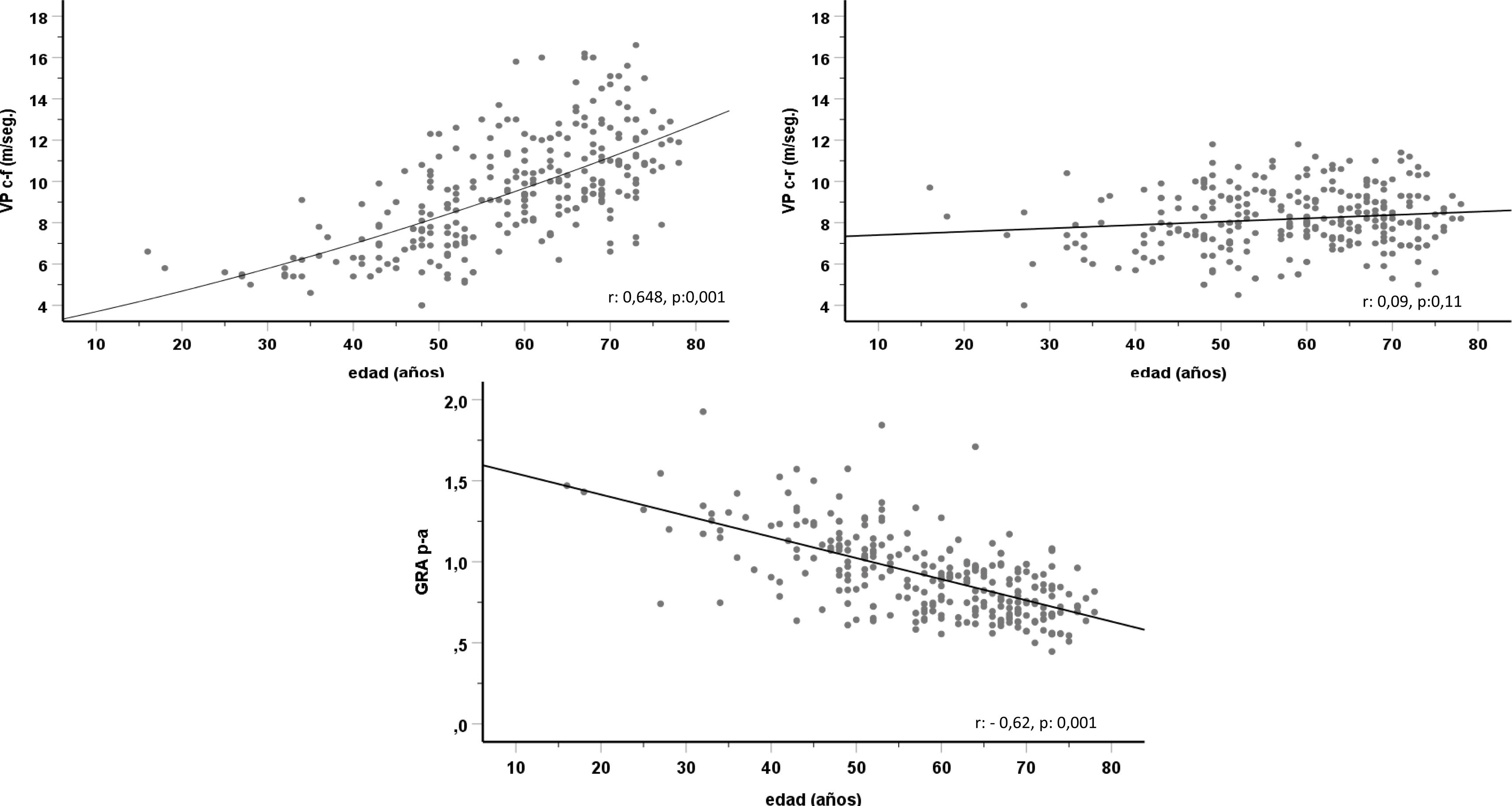
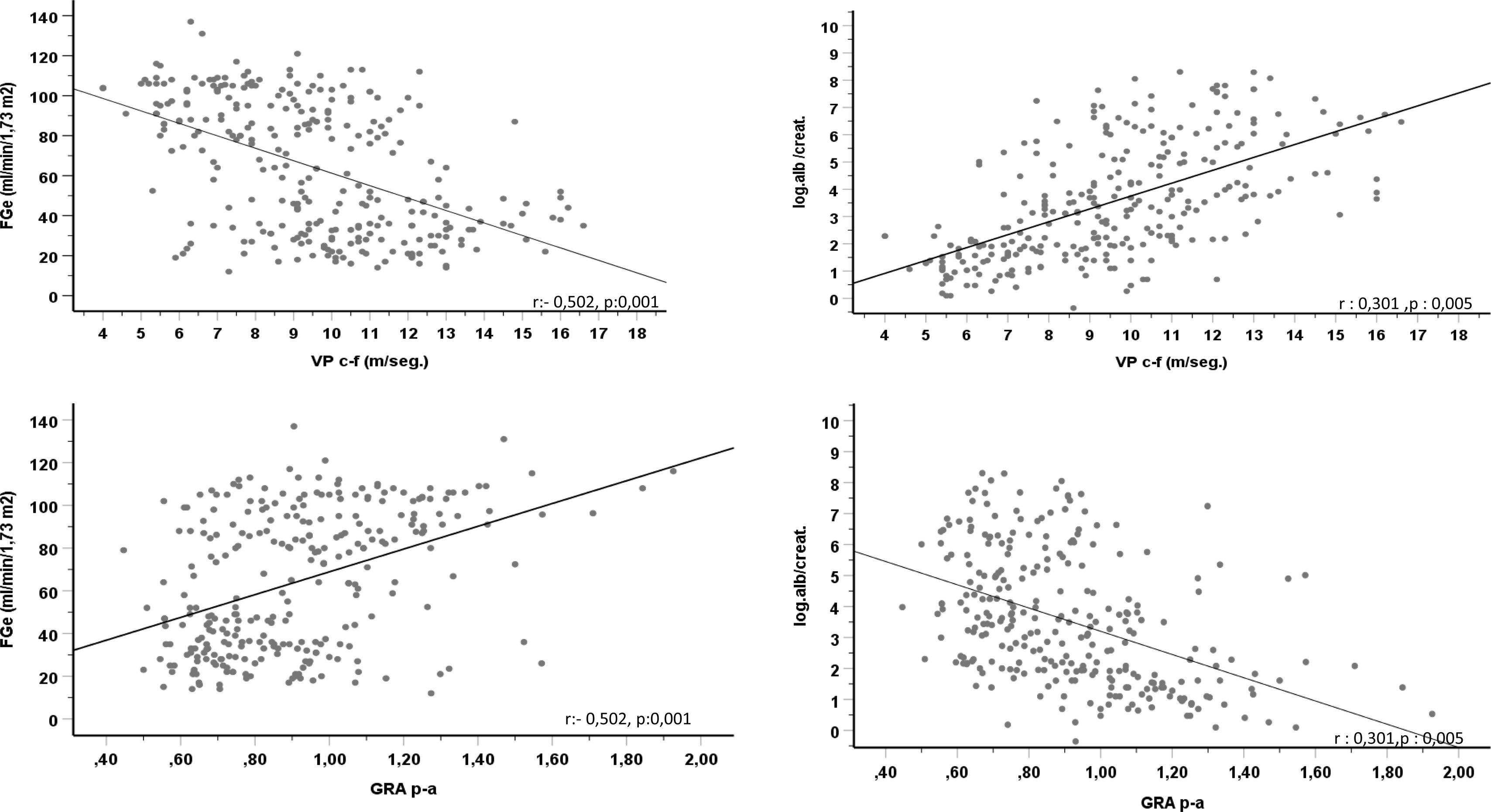
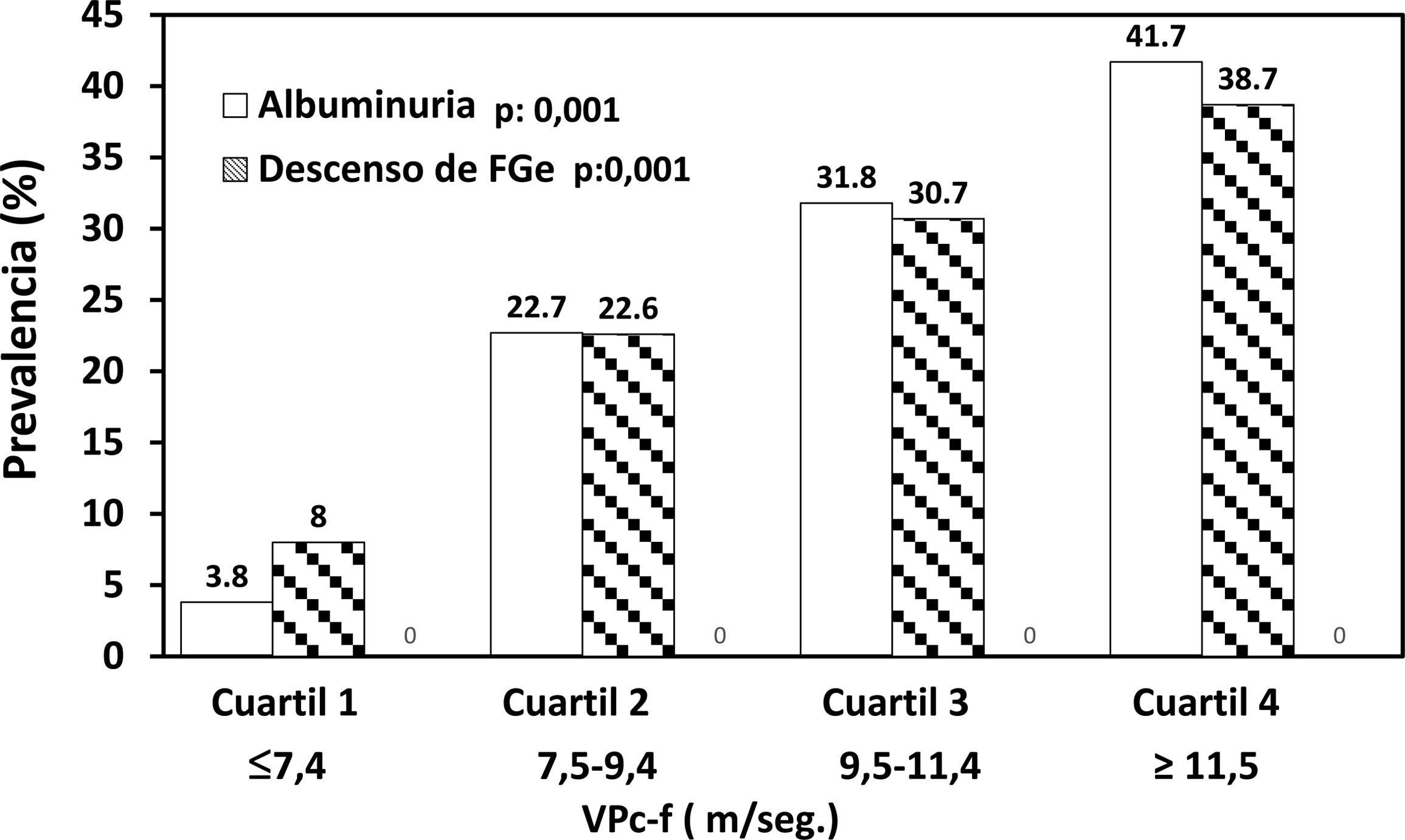
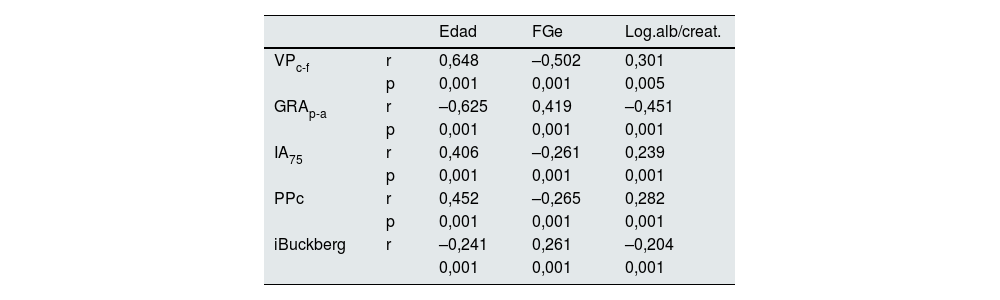
Considerando todos los sujetos, se observó una correlación directa significativa entre la VPc-f y la edad, correlación que fue inversa en el caso del GRAp-a (fig. 1). Se evidenció una correlación directa y significativa del FGe con el GRAp-a e iBuckberg, y significativa e inversa entre FGe y VPc-f, IA75 y PPc (tabla 3 y fig. 2). También fue significativa, pero de sentido contrario, la correlación entre esos parámetros y la albuminuria (tabla 3 y fig. 2). La prevalencia de una albuminuria anormal y un descenso del FGe fue progresivamente creciente con los cuartiles más altos de VPc-f (fig. 3).
Correlación entre parámetros de rigidez arterial, de función renal e índice de viabilidad subendocárdica (índice de Buckberg)
| Edad | FGe | Log.alb/creat. | ||
|---|---|---|---|---|
| VPc-f | r | 0,648 | –0,502 | 0,301 |
| p | 0,001 | 0,001 | 0,005 | |
| GRAp-a | r | –0,625 | 0,419 | –0,451 |
| p | 0,001 | 0,001 | 0,001 | |
| IA75 | r | 0,406 | –0,261 | 0,239 |
| p | 0,001 | 0,001 | 0,001 | |
| PPc | r | 0,452 | –0,265 | 0,282 |
| p | 0,001 | 0,001 | 0,001 | |
| iBuckberg | r | –0,241 | 0,261 | –0,204 |
| 0,001 | 0,001 | 0,001 | ||
| VPc-f | GRAp-a | PPc | IA75 | iBuckberg | ||
|---|---|---|---|---|---|---|
| VPc-f | r | 1 | –0,753 | 0,536 | 0,315 | –0,319 |
| p | 0,001 | 0,001 | 0,001 | 0,001 | ||
| GRAp-a | r | –0,753 | 1 | –0,434 | –0,284 | 0,302 |
| p | 0,001 | 0,001 | 0,003 | 0,001 | ||
| PPc | r | 0,452 | –0,434 | 1 | 0,328 | –0,281 |
| p | 0,001 | 0,001 | 0,001 | 0,001 | ||
| IA75 | r | 0,315 | –0,284 | 0,328 | 1 | –0,265 |
| p | 0,001 | 0,003 | 0,001 | 0,001 | ||
| iBuckberg | r | –0,319 | 0,302 | –0,281 | –0,265 | 1 |
| p | 0,001 | 0,001 | 0,001 | 0,001 | ||
FGe: filtrado glomerular estimado; GRAp-a: gradiente rigidez arterial periférico-aórtico; IA75: índice de aumento a frecuencia cardiaca de 75 L/min; iBuckberg; índice de Buckberg; log.alb/creat.: logaritmo albúmina/creatinina; PPc; presión de pulso central; VPc-f: velocidad de pulso carótida-radial.
Considerando los enfermos en los que se determinó PTH, se comprobó una correlación directa y significativa entre la PTH y la PPc (r = 0,232; p = 0,02).
Se observó una correlación inversa entre el iBuckberg, la edad y la albuminuria y directa con el FGe. Todos los índices de rigidez aórtica se correlacionaron significativamente con el iBuckberg, En la regresión múltiple, tras el ajuste multivariante, el único marcador de rigidez aórtica asociado independiente y negativamente con la magnitud del iBuckberg fue la VPc-f (β = -2,76; p = 0,014).
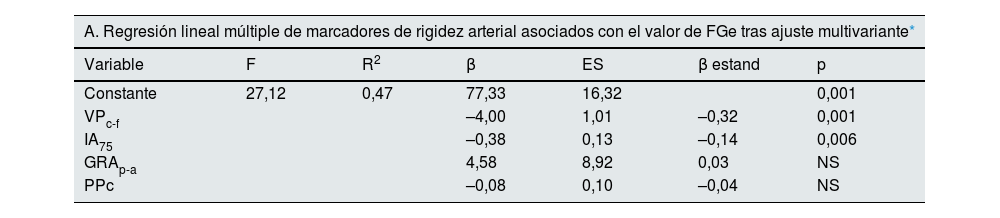
En el análisis de regresión múltiple con ajuste multivariante a antecedentes de ECV, tabaquismo, presencia de DM, PAM y log.alb./creat. en orina, los únicos parámetros de rigidez aórtica asociados de forma independiente e inversa con el valor del FGe fueron la VPc-f y el IA75 (tabla 4-A). Cuando en el modelo ajustado se introducían individualmente los marcadores de rigidez arterial, todos se asociaban de forma significativa, pero la relación más potente con el FGe (mayor R2 y mayor coeficiente β estandarizado) correspondía a la VPc-f.
| A. Regresión lineal múltiple de marcadores de rigidez arterial asociados con el valor de FGe tras ajuste multivariante* | ||||||
|---|---|---|---|---|---|---|
| Variable | F | R2 | β | ES | β estand | p |
| Constante | 27,12 | 0,47 | 77,33 | 16,32 | 0,001 | |
| VPc-f | –4,00 | 1,01 | –0,32 | 0,001 | ||
| IA75 | –0,38 | 0,13 | –0,14 | 0,006 | ||
| GRAp-a | 4,58 | 8,92 | 0,03 | NS | ||
| PPc | –0,08 | 0,10 | –0,04 | NS | ||
| B. Regresión logística binaria. OR de marcadores de rigidez arterial tras ajuste multivariante* predictores de disminución de FGe (< 60mL/min/1,73 m2) | |||||
|---|---|---|---|---|---|
| Variable | β | ES | OR (IC 95%) | p | R2 del modelo (Nagelkerke)0,37 |
| VPc-f | 0,41 | 0,02 | 1,50 (1,17-1,92) | 0,001 | |
| IA75 | 0,03 | 0,01 | 1,03 (0,99-1,06) | NS | |
| GRAp-a | –0,06 | 1,05 | 0,94 (0,12-7,40) | NS | |
| PPc | 0,06 | 0,01 | 1,00 (0,98-1,03) | NS | |
Ajuste a presión arterial media, log albúmina/creatinina, presencia de DM, tabaquismo, antecedentes de enfermedad cardiovascular. β estand: coeficiente β estandarizado; ES: error estándar; FGe: filtrado glomerular estimado; GRAp-a: gradiente de rigidez arterial periférica-aórtica; IA75: índice de aumento a 75 L/min; IC: intervalo de confianza; NS: no significativo; OR: odds ratio; PPc: presión de pulso central; VPc-f: velocidad de pulso carótida-femoral.
Un hecho similar se observó cuando se analizaron en la regresión logística binaria las variables que predecían el descenso del FGe (valores inferiores a 60mL/min/1,73 m2). La VPc-f era el único marcador con capacidad predictora significativa del descenso del FGe (tabla 4-B).
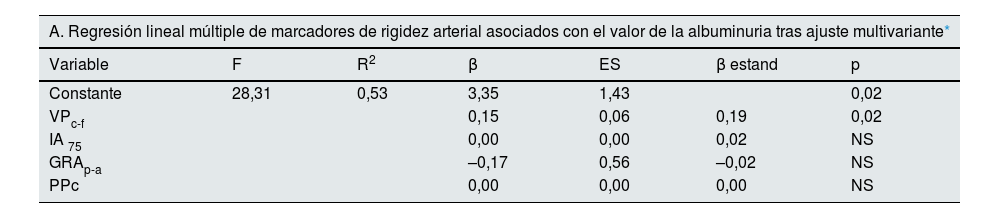
En la regresión múltiple, tras el ajuste multivariante, el único marcador de rigidez arterial con una asociación significativa y positiva con la magnitud de la albuminuria fue la VPc-f (tabla 5-A). La VPc-f también fue el único índice de rigidez aórtica con capacidad predictora de una albuminuria anormal (odds ratio [OR]: 1,66; intervalo de confianza [IC] 95%: 1,25-2,20) (tabla 5-B). Introducidos individualmente los marcadores de rigidez, solo la VPc-f mostraba una capacidad predictora significativa de una albuminuria anormal.
| A. Regresión lineal múltiple de marcadores de rigidez arterial asociados con el valor de la albuminuria tras ajuste multivariante* | ||||||
|---|---|---|---|---|---|---|
| Variable | F | R2 | β | ES | β estand | p |
| Constante | 28,31 | 0,53 | 3,35 | 1,43 | 0,02 | |
| VPc-f | 0,15 | 0,06 | 0,19 | 0,02 | ||
| IA 75 | 0,00 | 0,00 | 0,02 | NS | ||
| GRAp-a | –0,17 | 0,56 | –0,02 | NS | ||
| PPc | 0,00 | 0,00 | 0,00 | NS | ||
| B. Regresión logística binaria. OR de marcadores de rigidez arterial tras ajuste multivariante* predictores de aumento de albuminuria (albúmina/creatinina> 30mg/g) | |||||
|---|---|---|---|---|---|
| Variable | β | ES | OR (IC 95%) | p | R2 del modelo (Nagelkerke)0,54 |
| VPc-f | 0,51 | 0,14 | 1,66 (1,25-2,20) | 0,001 | |
| IA75 | 0,01 | 0,01 | 1,01 (0,97-1,04) | NS | |
| GRAp-a | 0,49 | 1,16 | 1,64 (0,16-15,9) | NS | |
| PPc | 0,00 | 0,02 | 1,00(0,98-1,02) | NS | |
Ajuste a presión arterial media, log albúmina/creatinina, presencia de DM, tabaquismo, antecedentes de enfermedad cardiovascular. β estand: coeficiente β estandarizado; ES: error estándar; FGe: filtrado glomerular estimado; GRAp-a: gradiente de rigidez arterial periférica-aórtica; IA75: índice de aumento a 75 L/min; IC: intervalo de confianza; NS: no significativo; OR: odds ratio; PPc: presión de pulso central; VPc-f: velocidad de pulso carótida-femoral.
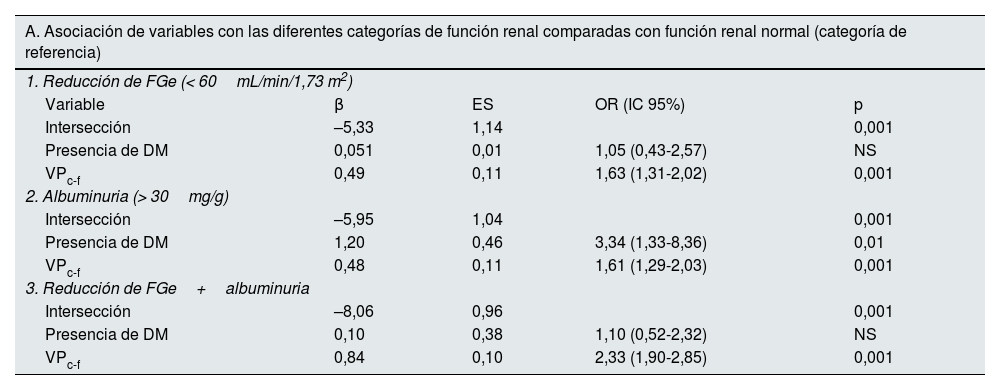
En la tabla 6 se observan las variables con valor predictivo de la función renal y las diversas categorías de albuminuria en la regresión multinomial. La VPc-f fue el único parámetro de rigidez arterial que se asoció de forma significativa con el descenso del FGe (OR [IC 95%]: 1,63 [1,31-2,02]; p = 0,001), el aumento de la albuminuria (OR: 1,61 [1,29-2,03]; p = 0,001) y su combinación (OR: 2,33 [1,90-2,85]; p = 0,001) (tabla 6-A). La presencia de DM se asoció de forma significativa con el aumento de la albuminuria (OR: 3,34 [1,33-8,36]; p = 0,01) (tabla 6-A). No se observó interacción entre la DM y los parámetros de rigidez arterial. Tanto la presencia de DM como la VPc-f se asociaron significativamente con todos los grados de albuminuria (tabla 6-B).
Regresión multinomial
| A. Asociación de variables con las diferentes categorías de función renal comparadas con función renal normal (categoría de referencia) | ||||
|---|---|---|---|---|
| 1. Reducción de FGe (< 60mL/min/1,73 m2) | ||||
| Variable | β | ES | OR (IC 95%) | p |
| Intersección | –5,33 | 1,14 | 0,001 | |
| Presencia de DM | 0,051 | 0,01 | 1,05 (0,43-2,57) | NS |
| VPc-f | 0,49 | 0,11 | 1,63 (1,31-2,02) | 0,001 |
| 2. Albuminuria (> 30mg/g) | ||||
| Intersección | –5,95 | 1,04 | 0,001 | |
| Presencia de DM | 1,20 | 0,46 | 3,34 (1,33-8,36) | 0,01 |
| VPc-f | 0,48 | 0,11 | 1,61 (1,29-2,03) | 0,001 |
| 3. Reducción de FGe+albuminuria | ||||
| Intersección | –8,06 | 0,96 | 0,001 | |
| Presencia de DM | 0,10 | 0,38 | 1,10 (0,52-2,32) | NS |
| VPc-f | 0,84 | 0,10 | 2,33 (1,90-2,85) | 0,001 |
| B. Asociación de variables con las diferentes categorías de albuminuria comparadas con la albuminuria normal (categoría de referencia) | ||||
| 1. Normal-alta | ||||
| Variable | β | ES | OR (IC 95%) | p |
| Intersección | –4,57 | 0,92 | 0,001 | |
| Presencia de DM | 1,46 | 0,43 | 4,30 (1,83-10,1) | 0,001 |
| VPc-f | 0,37 | 0,10 | 1,44 (1,17-1,78) | 0,001 |
| 2. Moderada | ||||
| Intersección | –6,58 | 0,91 | 0,001 | |
| Presencia de DM | 1,05 | 0,39 | 2,86 (1,32-6,19) | 0,001 |
| VPc-f | 0,65 | 0,10 | 1,92 (1,58-2,34) | 0,001 |
| 3. Severa | ||||
| Intersección | –9,24 | 1,12 | 0,001 | |
| Presencia de DM | 1,21 | 0,45 | 3,35 (1,38-8.11) | 0,008 |
| VPc-f | 0,85 | 0,11 | 2,35 (1,88-2,94) | 0,001 |
DM: diabetes mellitus; ES: error estándar; FGe: filtrado glomerular estimado; IC: intervalo de confianza;
NS: no significativo; OR: odds ratio; VPc-f: velocidad de pulso carótida-femoral.
Nuestros resultados demuestran que la ERC se asocia a un aumento de la RAC y a una disminución del GRAp-a, cambios que son más marcados cuando la ERC coexiste con la DM. Por otra parte, la VPc-f es el marcador de RAC más relacionado de forma independiente con la función renal y con mayor poder predictivo de un descenso del FGe y de un aumento de la albuminuria.
Indicadores de rigidez aórtica en presencia de factores de riesgo cardiovascular (hipertensión arterial, diabetes mellitus, enfermedad renal crónica)La rigidez arterial es la expresión del efecto que tiene sobre la pared arterial la interacción entre factores hemodinámicos y metabólicos. Consecuentemente, se producen alteraciones estructurales de la pared vascular con aumento de la relación entre colágeno y elastina, entre otras. Son muchos los mecanismos subyacentes del aumento de la rigidez arterial: las alteraciones moleculares inducidas por la mecanotransducción entre la matriz extracelular y las células musculares lisas vasculares, los cambios fenotípicos de estas células, la disfunción endotelial, el estrés oxidativo, la calcificación de la capa media vascular, las alteraciones metabólicas, los fenómenos inflamatorios, el tejido adiposo perivascular, las hormonas sexuales y los factores genéticos y epigenéticos15–17. Todos estos mecanismos participan en diferente grado en el aumento de la rigidez arterial que se observa en presencia de diferentes factores de riesgo vascular como la edad, HTA, DM y ERC18.
De formas similar al proceso de envejecimiento normal, en presencia de esos factores de riesgo vascular se produce un EVA que se traduce en un aumento de la rigidez arterial19.
Más del 90% de los enfermos de nuestro estudio eran hipertensos. La HTA se asocia a una mayor rigidez arterial y, a su vez, un incremento de esta promueve un aumento de la presión arterial20. Además de las modificaciones estructurales de la pared arterial producidas por la HTA que inducen a largo plazo un aumento de la rigidez arterial, cuando se eleva la presión arterial de forma aguda la carga soportada por la pared vascular es transferida desde las fibras elásticas a las de colágeno aumentando la rigidez arterial. Como se ha comprobado en nuestro estudio y en otros4, hay una correlación significativa (con morfología de función cuadrática) entre la edad y la VPc-f. Otros factores como el sexo y la obesidad pueden modificar la rigidez arterial20,21. Por todo ello, es necesario considerar estas variables cuando se analiza la VPc-f.
En nuestro estudio, los valores de VPc-f en todos los grupos de enfermos eran superiores a los de los controles. Sin embargo, tras el ajuste a la edad, presión arterial, sexo e IMC, desaparecía la diferencia significativa entre el grupo control y el grupo con HTA. Pese al ajuste, los sujetos con DM, ERC y ERC+DM presentaron valores de VPc-f superiores a los de los otros grupos. La mayor contribución a la varianza de la VPc-f era el grupo al que pertenecían (27,7%), la edad (22,9%) y la PAM (20,3%).
La causa de un valor similar marginal (tras ajuste) de la VPc-f en los grupos control y con HTA no está clara. Es posible que los criterios usados para clasificar los grupos, excluyendo del grupo 2 (HTA) los que tenían albuminuria y descenso del FGe, genere una selección de los enfermos con mejor salud vascular. Se ha comprobado que, pese a la presencia de factores de riesgo vascular, hay enfermos con una edad vascular (medida por la VPc-f) inferior a la edad cronológica (supernormal vascular aging [SUPERNOVA]), con menos eventos vasculares. En el estudio prospectivo que validó el significado clínico del concepto de edad vascular supernormal, en el grupo SUPERNOVA había un 59,7% con HTA22. En nuestro estudio, un 27,5% de los enfermos del grupo con HTA tenían valores de VPc-f inferiores al punto de corte del percentil 10 de los valores de referencia de la VPc-f de la Sociedad Europea de Cardiología23. En este subgrupo de nuestra investigación, el valor de la VPc-f, ajustado a edad, sexo y PAM, era 5,8 (1) m/s, y ninguno tenía antecedentes de ECV.
Otro hecho que podría contribuir a una menor VPc-f en todos los grupos de enfermos es el tratamiento con bloqueadores del SRA. Estos fármacos tienen capacidad para reducir la rigidez arterial más allá de sus efectos antihipertensivos24.
Como se ha descrito en otros estudios, la presencia de DM y ERC se asocia a alteraciones metabólicas, inflamatorias, estrés oxidativo y calcificaciones vasculares, entre otras, que inducen un aumento de la rigidez arterial medida por la VPc-f25. En nuestra investigación los grupos 3 (DM) y 4 (ERC) tenían valores de VPc-f más elevados que el grupo con HTA, aunque esta diferencia estaba en el límite de la significación estadística (p = 0,07) en el grupo que solo tenía DM. Es posible que el número más reducido de sujetos en este grupo limitase la significación. Por otra parte, la duración de la DM que en este grupo era solo de dos años, es un importante determinante de la rigidez aórtica en la DM. El papel de la DM en el daño vascular y en el aumento de la rigidez arterial determinada por la VPc-f se refuerza con el hecho de que la VPc-f fue superior en el grupo con ND frente a los que tenían nefropatía glomerular no diabética pese a un valor superior de albuminuria en estos últimos.
La mayor VPc-f observada en el grupo con ERC+DM en comparación con el grupo con ERC puede atribuirse al efecto aditivo de las alteraciones metabólicas, inflamatorias y estrés oxidativo que acontecen cuando concurren los dos procesos, y al mayor número e intensidad de calcificaciones de la aorta abdominal que objetivamos en el grupo con ERC+DM. Se ha demostrado que en sujetos con ERC y DM la calcificación de la aorta abdominal se asocia con valores elevados de la VPc-f26.
En nuestra investigación obtuvimos resultados similares en la rigidez arterial en los diferentes grupos usando otro parámetro de rigidez arterial como es el GRAp-a. Aplicando este índice de rigidez arterial, el grupo con DM tenía valores significativamente inferiores a los grupos control y con HTA. La diferencia en el valor de la VPc-f entre estos grupos estaba, sin embargo, en el límite de la significación. Durante el envejecimiento o en presencia de factores de riesgo vascular, aumenta la rigidez aórtica (medida por la VPc-f), sin embargo, la rigidez de las arterias periféricas musculares (medida por la VPc-r) apenas se modifica. Consecuentemente el GRAp-a disminuye progresivamente. En nuestro estudio observamos una correlación significativa entre la edad y VPc-f, correlación que no se vislumbró en el caso de la VPc-r. Una ventaja de usar el GRAp-a es su independencia del valor de la PAM6. De hecho, en nuestro estudio, el porcentaje de la varianza de la VPc-f dependiente de la PAM era del 20%. Este porcentaje se reducía al 1% en el caso del GRAp-a.
La PPc se considera un indicador indirecto de la RAC. La pérdida de la elasticidad arterial reduce su distensibilidad y aumenta la velocidad de la trasmisión de la onda de pulso produciéndose un retorno precoz de la onda refleja que se suma a la onda anterógrada generada por la sístole ventricular lo que se traduce en un aumento de la PASc y, consecuentemente, de la PPc. En nuestro trabajo comprobamos que todos los enfermos tenían, tras un ajuste multivariante, una PPc mayor que el grupo control siendo esta diferencia significativa cuando concurrían ERC y DM. Pese a esto, el porcentaje de sujetos con una PPc superior a 50mmHg, valor que ha demostrado ser predictivo de eventos cardiovasculares27, fue significativamente mayor en todos los grupos de enfermos. Otros estudios han demostrado que, en sujetos con HTA y en pacientes con DM, el aumento de la PPc se asociaba a una mayor impedancia de la aorta proximal y a una mayor rigidez aórtica12,28, y, en sujetos con ERC29, una correlación directa entre la PPc y los valores de PTH como también observamos en nuestra investigación.
Cuando aumenta la rigidez arterial, la onda refleja se propaga con más velocidad uniéndose a la onda anterógrada en la sístole con el consiguiente aumento del IA que se ha considerado marcador de la onda refleja y, por tanto, de la rigidez arterial30. En nuestra investigación, el IA75 fue significativamente mayor en todos los enfermos que en los controles. A diferencia de los otros marcadores de rigidez aórtica no existieron diferencias del IA75 entre los grupos con HTA, DM y ERC pese a que la VPc-f fue mayor en los grupos con ERC, hecho observado también en otros estudios10. Otras investigaciones comprobaron en sujetos con DM la coexistencia de una VPc-f elevada con valores de IA75 y onda refleja similares o inferiores al grupo control28,31. Un aumento de la rigidez aórtica con menor incremento o descenso de la onda refleja podría sugerir una mayor penetración de la energía pulsátil en la microcirculación cerebral y renal, lo que, sin embargo, no concuerda con la correlación significativa negativa entre IA75 y GRAp-a objetivada en nuestra investigación. Es posible que el IA75 no sea un buen marcador de la rigidez aórtica y de la onda refleja. Las limitaciones del IA75 como medida de la magnitud de la onda refleja derivan de que no solo es influenciado por la velocidad de la onda de pulso sino también por otros factores cardiacos32,33.
Se puede deducir de nuestros hallazgos que la rigidez aórtica aumenta en presencia de factores de riesgo vascular como la HTA, la DM y la ERC. Este aumento es especialmente notable cuando hay ERC y cuando esta coexiste con DM. La VPc-f y el GRAp-a son los marcadores más consistentes para analizar la RAC cuando coexisten los factores de riesgo vascular aquí estudiados.
La relevancia de un aumento de la rigidez aórtica vendrá determinada por su posible repercusión en la lesión de órganos diana que acontece en presencia de factores de riesgo vascular, daño que puede contribuir a la morbimortalidad cardiovascular.
Indicadores de rigidez aórtica y función renalIndicadores de rigidez aórtica y filtrado glomerular estimadoEl otro objetivo de nuestra investigación fue analizar la posible asociación de la rigidez aórtica con dos parámetros de la función renal: FG y albuminuria.
Analizado globalmente el conjunto de los sujetos, observamos una correlación significativa entre todos los marcadores estudiados de rigidez aórtica y el FGe (correlación directa en el caso del GRAp-a e inversa en los otros indicadores), y entre esos indicadores y la albuminuria (correlación inversa en el caso del GRAp-a y directa en los demás).
Introducidos conjuntamente todos los marcadores de rigidez aórtica en la regresión múltiple, la VPc-f y el IA75 fueron los únicos que, tras el ajuste multivariante, se asociaban de forma independiente y significativa con la magnitud del FGe mientras que en la regresión logística solo la VPc-f fue predictora de la presencia de un FGe subnormal. Introducidos individualmente y tras el ajuste multivariante, todos los marcadores de rigidez se asociaban de forma significativa con el valor del FGe y predecían su disminución, pero la VPc-f era el marcador más robusto asociado con el FGe.
El mayor valor de FGe del grupo con ERC+DM comparado con el grupo con ERC persistía cuando en el MANOVA se hacía el ajuste a la VPc-f. Así, en nuestra investigación, el efecto negativo de la rigidez aórtica sobre el valor del FGe parece ser superado por la hiperfiltración inducida por la DM.
Hay pocos estudios que analicen la asociación entre FG y albuminuria con varios parámetros de rigidez arterial. Los resultados de algunos estudios realizados sobre FG y rigidez arterial aórtica no han sido uniformes. Se ha demostrado un aumento progresivo de la VPc-f con el estadio de ERC y una asociación independiente entre VPc-f y FG incluso en estadios muy precoces de insuficiencia renal35–37. Otro estudio ha demostrado la asociación entre la rigidez aórtica determinada por la VPc-f y el FGe en sujetos con y sin HTA y DM9.
Otras investigaciones, sin embargo, no demuestran asociación entre rigidez arterial central y FG. Upadhyay et al.11 comprobaron en una cohorte de Framingham que en la ERC ligera-moderada el FG no se asociaba de forma independiente con la rigidez aórtica valorada por varios índices (VPc-f, PPc, IA). La causa de esta discrepancia no está clara. Es posible que el uso de la cistatina para estimar el FG y un ajuste multivariable muy riguroso a los factores de riesgo cardiovascular en el estudio de Upadhyay contribuyan a los diferentes resultados. Estos factores de riesgo pueden ejercer efectos importantes en la rigidez arterial en sujetos con ERC. En nuestra investigación, seguimos observando una asociación significativa de la VPc-f con el FGe cuando añadimos el perfil lipídico a las otras variables de ajuste.
Se concluye que existe una asociación inversa entre rigidez aórtica y FGe, y un valor predictivo significativo de aquella de la presencia de un descenso del FGe en sujetos con factores de riesgo vascular. La VPc-f es el índice de rigidez aórtica más robusto comparado con otros marcadores de rigidez central.
Indicadores de rigidez aórtica y albuminuriaEn nuestra investigación, la rigidez aórtica determinada por la Vpc-f, tras el ajuste multivariante, se asociaba directa y significativamente con la magnitud y prevalencia de albuminuria. Igual que en el caso de FGe, todos los demás marcadores de rigidez desaparecían del modelo cuando se incorporaba la VPc-f. Sin embargo, incluidos de forma individual, todos se relacionaban con la albuminuria, aunque con mucha menos intensidad que la VPc-f.
Otros estudios han evidenciado una relación entre la rigidez aórtica y la albuminuria. En un trabajo realizado en la cohorte de Framingham37 se observó una asociación independiente de la VPc-f y PPc con la prevalencia de albuminuria con una OR cuantitativamente mayor para la VPc-f. En otros estudios poblacionales tanto el FGe como la albuminuria se asociaban de forma independiente con la rigidez aórtica9 siendo esta relación inversa con el FGe y directa con la albuminuria. La asociación directa entre rigidez arterial y albuminuria se objetivó incluso con valores de albuminuria considerados normales38. En algunas publicaciones, la relación directa entre la rigidez arterial con albuminuria es más fuerte y consistente que la relación inversa entre la rigidez aórtica y el FG11,35.
En nuestro estudio, la asociación de un descenso del FGe y un aumento de la albuminuria con la VPc-f no se modificaba sustancialmente cuando ambas se incluían en la regresión. Esto suscita la posibilidad de que los mecanismos que vinculan estas variables con el riesgo cardiovascular son, al menos en parte, independientes uno de otro, aunque puedan compartir factores como HTA y DM.
Nuestra investigación evidencia que el aumento de la rigidez arterial, evaluado por la VPc-f, es un determinante crucial de los dos parámetros de la función renal: FGe y la albuminuria. La existencia de DM y el incremento de la rigidez arterial contribuyen significativamente a la presencia y magnitud de la albuminuria sin que se observe una interacción significativa entre ellas. La asociación significativa de ambas variables con la albuminuria, cuando se incluyen conjuntamente en el modelo, sugiere que su efecto sobre la albuminuria se produce por procesos distintos.
El mecanismo por el que el aumento de la rigidez aórtica contribuye a la disfunción renal no está claro. Woodard et al. demostraron una relación inversa entre FG determinado por aclaramiento de iohexol y la rigidez aórtica. Evidenciaron, con un análisis de mediación, que la rigidez aórtica puede contribuir a la reducción del FG por trasmisión de excesiva pulsatilidad a la microcirculación renal que promueve vasoconstricción dinámica y rarefacción vascular39. En otro sentido, un aumento de la relación del flujo retrógrado/anterógrado aórtico, observado en casos de aumento de la rigidez aórtica y que se correlaciona inversamente con el flujo sanguíneo intrarrenal, puede ser el mediador de la asociación entre el aumento de rigidez aórtica y el descenso del FG40. El daño microvascular renal y las alteraciones hemodinámicas promovidas por el aumento de la presión de pulso aórtico secundario a la mayor rigidez aórtica también pueden producir albuminuria41.
La presencia de un gradiente normal de rigidez arterial periférica-aórtica contribuye, por una parte, a mantener la perfusión coronaria y evitar la sobrecarga cardiaca y, por otra, limita la trasmisión de la energía pulsátil a la periferia y protege a la microcirculación de órganos con habitual baja resistencia como el riñón y el cerebro42. Teniendo en cuenta las consecuencias fisiopatológicas de una disminución del gradiente se ha propuesto que el gradiente de rigidez, valorado por la relación VPc-r/VPc-f podría ser mejor que la VPc-f para valorar la posible asociación de la rigidez aórtica con la lesión de órganos diana y con la morbimortalidad. En sujetos con ERC tratados con diálisis el GRAp-a tiene mayor poder predictivo de mortalidad que la VPc-f43. Este hecho no se ha confirmado en estudios poblacionales44. Por otra parte, en sujetos con HTA, el GRAp-a ha demostrado una asociación con el FG significativa y similar a la VPc-f, pero de sentido inverso45. En nuestro estudio el GRAp-a, igual que los otros marcadores de rigidez aórtica (aunque en sentido inverso), se asociaba con la magnitud del FGe y de la albuminuria cuando se introducía de forma aislada en el modelo de regresión, pero su asociación significativa desaparecía cuando en el modelo se incluía la VPc-f que era el marcador de rigidez más consistentemente asociado con la disfunción renal. De nuestros hallazgos se puede deducir que la disminución del GRAp-a es fundamentalmente atribuible a un aumento de la VPc-f (que debe seguir siendo considerado como el marcador más importante de la rigidez aórtica) más que a un descenso de la VPc-r.
Consecuencias cardiacas del aumento de la rigidez aórticaAdemás de su repercusión en la función renal, el aumento de la rigidez aórtica también tiene efectos cardiacos. Un aumento de la VPc-f favorece la llegada de la onda refleja a la aorta ascendente durante la sístole aumentando la PASc con la consiguiente sobrecarga cardiaca y, por otra parte, disminuye la presión arterial diastólica aórtica comprometiendo la perfusión coronaria que se produce fundamentalmente en la diástole. Estudios experimentales han demostrado que una aorta proximal rígida se asocia a una reducción de la perfusión coronaria, especialmente a nivel subendocárdico46. En nuestro estudio, observamos una correlación directa entre el iBuckberg, estimación no invasiva del aporte de oxígeno y de la perfusión subendocárdica, con el FGe, e inversa con la albuminuria, y una correlación inversa con los parámetros de rigidez aórtica (salvo una relación directa con el GRAp-a). Sin embargo, en la regresión múltiple, tras el ajuste multivariante, el único marcador de rigidez aórtica asociado independiente e inversamente con la magnitud del iBuckberg fue la VPc-f.
Se ha demostrado que, tanto en la población general como en las poblaciones de alto riesgo vascular, el FGe y la albuminuria, independientemente de otros factores de riesgo vascular tradicionales, predicen la morbimortalidad cardiovascular47. La asociación observada en nuestra investigación de la rigidez aórtica con el FGe, la albuminuria y la perfusión subendocárdica suscita la posibilidad de que el aumento de rigidez aórtica sea el nexo entre la disfunción renal y los eventos cardiovasculares.
ConclusionesPodemos concluir de nuestros hallazgos que la rigidez aórtica aumenta en presencia de factores de riesgo vascular como la HTA, la DM y la ERC. Este incremento es especialmente notable cuando hay ERC y cuando esta coexiste con DM. Una mayor rigidez aórtica se asocia de forma inversa e independiente con la magnitud del FGe y de forma directa con la cuantía de la albuminuria. Por otra parte, el aumento de la rigidez aórtica predice la presencia de una disminución de FGe y de una albuminuria anormal. La Vpc-f es el parámetro de rigidez aórtica que se asocia de forma más significativa y consistente con la disfunción renal. Aunque la VPc-f depende fundamentalmente del grosor y elasticidad de la pared de la aorta y de las arterias ileofemorales, puede integrar las variables diferentes, pero hemodinámicamente relacionadas, que determinan los otros marcadores de rigidez aórtica.
Nuestro estudio tiene limitaciones. Es un estudio transversal por lo que no se puede establecer una relación causal entre rigidez aortica y disfunción renal. Realmente se trata de una asociación bidireccional. Un aumento de la rigidez aórtica puede producir alteraciones renales y, por otra parte, en la ERC concurren múltiples alteraciones fisiopatológicas que pueden condicionar un aumento de la rigidez aórtica. Además, existen variables independientes que afectan simultáneamente a la elasticidad de la pared vascular y originan daño renal. En nuestro estudio no realizamos todas las determinaciones de laboratorio en la totalidad de los sujetos lo que puede limitar el efecto de estas variables en las asociaciones observadas. No obstante, la inclusión de las variables disponibles de laboratorio en nuestros análisis de regresión no modificó sustancialmente los resultados.
Nuestra investigación también tiene aspectos relevantes. Se usa la VPc-f que se considera el estándar de oro para el estudio de la rigidez aórtica. Se ha reunido un número importante de sujetos que se han distribuido en grupos representativos de diferentes factores de riesgo vascular. En nuestro conocimiento, no hay estudios que analicen la rigidez aórtica en un grupo tan variado de enfermos. Finalmente, el uso de una metodología estadística rigurosa nos permite analizar la asociación de las diversas variables con ajustes para minimizar los efectos de las diferencias de edad y comorbilidades entre los distintos grupos.
Se requieren estudios prospectivos para analizar la verdadera implicación de las alteraciones de la RAC y periférica en las lesiones de órgano diana y en la morbimortalidad cardiovascular en los sujetos con factores de riesgo vascular.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.