En un fracaso renal agudo (FRA) se activa un fuerte componente inflamatorio como respuesta al daño renal, y uno de los principales mediadores de este proceso es la interleuquina proinflamatoria 6 o IL-6. A su vez, ligado a este fenómeno también se producen alteraciones en los distintos componentes del metabolismo mineral como son aquellos dependientes del factor de crecimiento de fibroblasto (FGF)23 y el cofactor antienvejecimiento klotho. El objetivo de este trabajo fue explorar la asociación entre la función renal y los niveles sistémicos tanto de IL-6 como de FGF23 y klotho, en las etapas tempranas de un FRA, analizando la capacidad predictora de IL-6 en la mortalidad temprana asociada al FRA.
Materiales y métodosSe analizaron los niveles plasmáticos de IL-6, klotho y FGF23 en muestras procedentes de 28 pacientes con FRA, y se relacionaron con la función renal en el momento del ingreso hospitalario, y después de 24 y 72h. Además, se analizó la capacidad predictora de IL-6 sobre la mortalidad asociada al FRA en los tres tiempos del estudio. En un modelo experimental de FRA nefrotóxico en ratón, se analizaron también los valores sistémicos de IL-6 y FGF23 tras las 24 y 72h desde la inducción del daño renal, así como en ratones que sobreexpresan la proteína antienvejecimiento, klotho.
ResultadosLos niveles de IL-6 aumentaron en los pacientes con FRA, especialmente en el momento del ingreso hospitalario, y fueron disminuyendo en paralelo a la mejora de la función renal. Al mismo tiempo que el aumento de IL-6, se produjo el incremento sistémico de FGF23 y el descenso de klotho, existiendo una correlación significativa y positiva entre los niveles de IL-6 y FGF23. Además, obtuvimos que los niveles sistémicos de IL-6 son un buen predictor de la mortalidad en los pacientes, con un área bajo la curva igual a uno tras las 72h desde el diagnóstico de FRA. En el modelo de FRA experimental en ratón, observamos también un incremento en los niveles plasmáticos tanto de IL-6 como de FGF23, tras las 24h del daño renal. Sin embargo, en los ratones transgénicos con sobreexpresión de klotho, no se produjo tal incremento en ninguna de ellas.
ConclusionesExiste una asociación entre el daño renal, el incremento de la IL-6 y de FGF23 en pacientes con FRA, especialmente en el momento del diagnóstico. Además, los niveles elevados de IL-6 predicen la mortalidad de estos pacientes a corto y medio plazo, considerándose un buen biomarcador pronóstico con una predicción total tras las 72h desde el diagnóstico del FRA. Mantener unos niveles adecuados de klotho podría prevenir la respuesta inflamatoria mediada por la IL-6 y por lo tanto también aminorar el grado y severidad del daño renal tras un FRA.
In acute kidney injury (AKI), a strong inflammatory component is activated in response to the renal damage, and one of the main mediators behind this process is the pro-inflammatory interleukin 6 or IL-6. Beside to this phenomenon, there are also alterations in different components of mineral metabolism, such as those dependent on fibroblast growth factor (FGF)23 and the anti-ageing cofactor klotho. The aim of this work was to explore the association between renal function and systemic levels of IL-6, as well as FGF23 and klotho in the early stages of AKI, analysing the predictive capacity of IL-6 in early mortality associated with AKI.
Materials and methodsPlasma levels of IL-6, klotho and FGF23 were analysed in samples from 28 patients with AKI and related to renal function on hospital admission, and after 24 and 72hours. In addition, the predictive capacity of IL-6 on AKI-associated mortality was analysed at the three study time points. In an experimental nephrotoxic -AKI mouse model, systemic IL-6 and FGF23 values were also analysed 24 and 72hours after induction of kidney damage, as well as in mice overexpressing the anti-ageing protein, klotho.
ResultsSystemic IL-6 levels increased in AKI patients, especially in hospital admission time, and decreased in parallel with improving renal function. At the same time as IL-6 values increased, there was an increase in FGF23 and a decrease in klotho levels, with a significant and positive correlation between IL-6 and FGF23 levels. In addition, we obtained that systemic IL-6 levels were a good predictor of mortality in these patients, with an area under the curve equal to one at 72hours after AKI. In the experimental mouse AKI model, we also observed an increase in plasma levels in both IL-6 and FGF23 after 24hours of kidney damage. Nevertheless, in transgenic mice overexpressing klotho, there was no such increase in any of them.
ConclusionsThere is an association between renal damage and increased levels of IL-6 and FGF23 in patients with AKI, especially on hospital admission time. Moreover, IL-6 levels are able to predict mortality in these patients, being a promising prognostic biomarker at any study time with a strong prediction at 72hours after patient admission. Maintaining adequate klotho levels could prevent the IL-6 mediated inflammatory response and therefore also reduce the degree and severity of renal damage after AKI.
El fracaso renal agudo (FRA) es un síndrome clínico caracterizado por una repentina pérdida de la función renal, diagnosticado por el aumento de la creatinina sérica y el descenso de la diuresis1,2. Este importante problema de salud pública afecta anualmente a millones de personas y su incidencia ha aumentado considerablemente en los últimos años, especialmente entre pacientes ingresados en las unidades de cuidados intensivos (UCI)3. La etiología del FRA es muy diversa, pero comparten un marcado componente inflamatorio renal que perpetúa este daño4. Este fenómeno desencadena una respuesta inmune en el riñón donde se liberan mediadores inflamatorios, como son las citoquinas y las quimiocinas, desencadenando una respuesta proinflamatoria, que también puede detectarse sistémicamente en los pacientes5,6. Entre los mediadores inflamatorios relevantes en el FRA se encuentran el factor de necrosis tumoral alfa (TNF-α), o las interleuquinas 18 (IL-18) y 6 (IL-6)7. La IL-6, en particular, desempeña un papel crucial en el daño renal, con valor predictivo sobre la severidad del daño, las complicaciones cardiovasculares8,9 y la mortalidad en pacientes críticos en la UCI10. A pesar de su importancia, no es una citoquina que se analice de forma rutinaria en pacientes con FRA en el momento del ingreso, perdiéndose su capacidad predictora en la aparición de posibles complicaciones graves asociadas al FRA. A nivel experimental, diferentes estudios han demostrado una asociación entre el FRA y la IL-6, por ejemplo en modelos murinos de FRA inducido por isquemia-reperfusión renal o modelos nefrotóxicos, conectando la inflamación local y sistémica a través de esta citoquina11,12. Estos hallazgos sugieren que la IL-6 podría ser un buen biomarcador y una posible diana terapéutica para el manejo clínico del FRA.
Por otro lado, en la enfermedad renal es bien conocido que se producen también alteraciones en los componentes del metabolismo mineral óseo como son los fosfatos, el factor de crecimiento de fibroblasto (FGF)23 y el factor antienvejecimiento klotho. La hiperfosfatemia es una condición común en la enfermedad renal que induce el aumento de FGF23 para favorecer la fosfaturia. La disfunción renal contribuye al acúmulo de fosfatos y FGF23 en sangre. Todo ello se ve agravado por la disminución del correceptor de FGF23, αklotho. Klotho es una proteína antienvejecimiento que es sintetizada principalmente en los riñones13, cuya expresión renal y también sus niveles plasmáticos se encuentran alterados en un FRA14. En los últimos años, entre las distintas acciones beneficiosas de klotho también se le ha adjudicado una acción antiinflamatoria incluso fuera del entorno puramente renal, donde se ha demostrado que el tratamiento exógeno con klotho es capaz de disminuir la liberación de citoquinas proinflamatorias, y de mejorar la función de los cardiomiocitos ventriculares tras un FRA experimental15. A pesar de todas estas evidencias, la relación entre los componentes del metabolismo mineral y el contexto inflamatorio asociado al FRA no está completamente definida. Por todo ello, el objetivo de este trabajo fue estudiar la citoquina IL-6 junto con los niveles de FGF23 y klotho como biomarcadores del daño renal tras un FRA, así como su poder predictor de mortalidad desde la admisión hospitalaria. Además, exploramos el papel de klotho como nefroprotector en el contexto de un FRA experimental y su posible relación con la IL-6.
MétodosEstudio piloto con pacientes con FRARealizamos un estudio clínico retrospectivo con muestras de plasma de 28 pacientes con FRA obtenidas del Biobanco del Hospital Universitario Ramón y Cajal-IRYCIS (Registro Nacional de Biobancos B.0000678, Madrid) integrado en la plataforma de Biobancos y Biomodelos del ISCIII (PT20/00045). Estudiamos la evolución del FRA en el momento de la admisión en el hospital, y tras 24 y 72h. Todos los pacientes firmaron el consentimiento informado. Los criterios de inclusión en el estudio fueron: 1) ser mayor de 18 años, y 2) haber sido diagnosticados de FRA en el momento del ingreso hospitalario. Los criterios de exclusión fueron: 1) ser menor de 18 años, 2) embarazo o 3) no tener el consentimiento informado. El tipo de FRA fue diagnosticado y clasificado según las guías AKIN (Acute Kidney Injury Network)16,17. Los datos demográficos y clínicos, así como la presencia de comorbilidades, fueron recogidos en las primeras 24h de ingreso en el hospital para el cálculo del APACHE (Acute Physiology and Chronic Health Evaluation) II score18. Las muestras controles correspondieron a un total de 26 individuos sanos sin ninguna patología procedentes también del Biobanco del Hospital Universitario Ramón y Cajal-IRYCIS. El estudio fue aprobado por el Comité de Ética del Hospital Universitario 12 de Octubre y se realizó siguiendo los principios de la Declaración de Helsinki.
Análisis de los niveles de IL-6, FGF23 y klotho en pacientes con FRALas muestras de sangre de los pacientes fueron recogidas y procesadas en el momento de la admisión hospitalaria, y tras 24 y 72h desde el ingreso. Se obtuvieron las muestras de plasma tras centrifugar la sangre a 2000r.p.m. durante 10min a 4°C y fueron almacenadas a −80°C en el Biobanco del Hospital Universitario Ramón y Cajal-IRYCIS. El Departamento de Bioquímica del Hospital Universitario Ramón y Cajal analizó los principales parámetros de laboratorio relacionados con la función renal utilizados en la práctica clínica habitual, como los niveles de creatinina sérica (sCreat), urea y tasa de filtrado glomerular estimada (TFGe). Se realizaron diferentes análisis de correlación entra las distintas variables de función renal, los parámetros del metabolismo mineral y la citoquina IL-6 en los tres tiempos del estudio. Además, se analizaron todas las variables en función de si los pacientes sobrevivieron (no exitus) o fallecieron (exitus). Mediante kits comerciales de ensayos de inmunoabsorción de ligando a enzimas (ELISA) se determinaron los niveles plasmáticos de la citoquina proinflamatoria IL-6 (ProcartaPlex™ Kit, Invitrogen, París, Francia), FGF23 C-terminal (cFGF23, ELISA, Immutopics, San Clemente, CA) y α-klotho soluble (ELISA, IBL, Fujioka-Shi, Japón).
Modelo experimental de FRA en ratones cepa silvestre y con sobreexpresión de klothoPara el estudio experimental, se emplearon ratones macho adultos C57BL/6J (cepa silvestre o wild type, WT) procedentes de los laboratorios Charles River International Inc. (Wilmington, MA) de 12-14 semanas de edad. El FRA se indujo mediante una única inyección intraperitoneal de ácido fólico (AF, 250mg/kg, Sigma-Aldrich, Sant Louis,) disuelto en 0,3M de NaHCO3; a los ratones control se les administró 0,3M de NaHCO3 como vehículo19. Se extrajeron muestras de plasma de los diferentes grupos experimentales tras las 24 y 72h desde la inyección del AF. También se utilizaron ratones transgénicos que sobreexpresan la proteína klotho (ratones Tg-Kl; EFmKl46), cedidos por el Dr. Kuro-O (Jichi Medical University, Japón). Estos ratones son capaces de sobreexpresar la forma transmembrana de klotho de forma ubicua gracias a la inserción del promotor del factor de elongación 1-α humano (EFmKl)20. A los ratones Tg-Kl se les sometió al mismo procedimiento experimental que a los ratones WT para la inducción del FRA y se obtuvieron las muestras de plasma a los mismos tiempos. Los estudios con animales se realizaron siguiendo las Directrices para el Cuidado Ético de Animales de Experimentación de la Unión Europea (2010/63/UE) y fueron aprobados por el Comité Bioético de la Universidad Autónoma de Madrid y por la Dirección General de Agricultura y Medio Ambiente de la Consejería de Medio Ambiente de la Comunidad de Madrid (PROEX 186.5/20).
Análisis de IL-6 y FGF23 en el modelo experimental de FRALos valores plasmáticos de cFGF23 y la IL-6 se analizaron mediante kits de ELISA siguiendo las instrucciones de los fabricantes. Para la cuantificación de cFGF23 se empleó el kit de ELISA de Immunotopics, Inc. (San Clemente, CA), y los niveles de IL-6 se analizaron con el kit de ProcartaPlex™ (Invitrogen, París, Francia).
Análisis estadísticoPara determinar si los datos siguen una distribución normal se realizó el test de Kolmogorov-Smirnov. Las diferencias entre variables paramétricas se analizaron mediante el test t de Student o el análisis ANOVA de una vía con el test de Newman-Keuls. El cálculo de la probabilidad de mortalidad de los pacientes con FRA en función de la concentración plasmática de la citoquina IL-6 se realizó mediante el cálculo del área bajo la curva (ABC) empleando el análisis ROC (receiver operating characteristic curve). El valor óptimo de corte o cut-off a partir del cual la concentración plasmática de IL-6 discrimina entre los pacientes que sobrevivieron frente a los que no, se obtuvo a partir del cálculo del índice de Youden21. Las diferentes correlaciones entre las variables se calcularon con el coeficiente de correlación de Pearson. Para el análisis estadístico de los datos se usaron los softwares GraphPad Prism v8.0 (GraphPad Software Inc., San Diego, CA) y el SPSS Statistics v22 (IBM, Armonk, NY). Los datos se representan como la media±desviación estándar en el estudio clínico, y la media±error estándar en el estudio experimental. La significación estadística se consideró para valores de p<0,05.
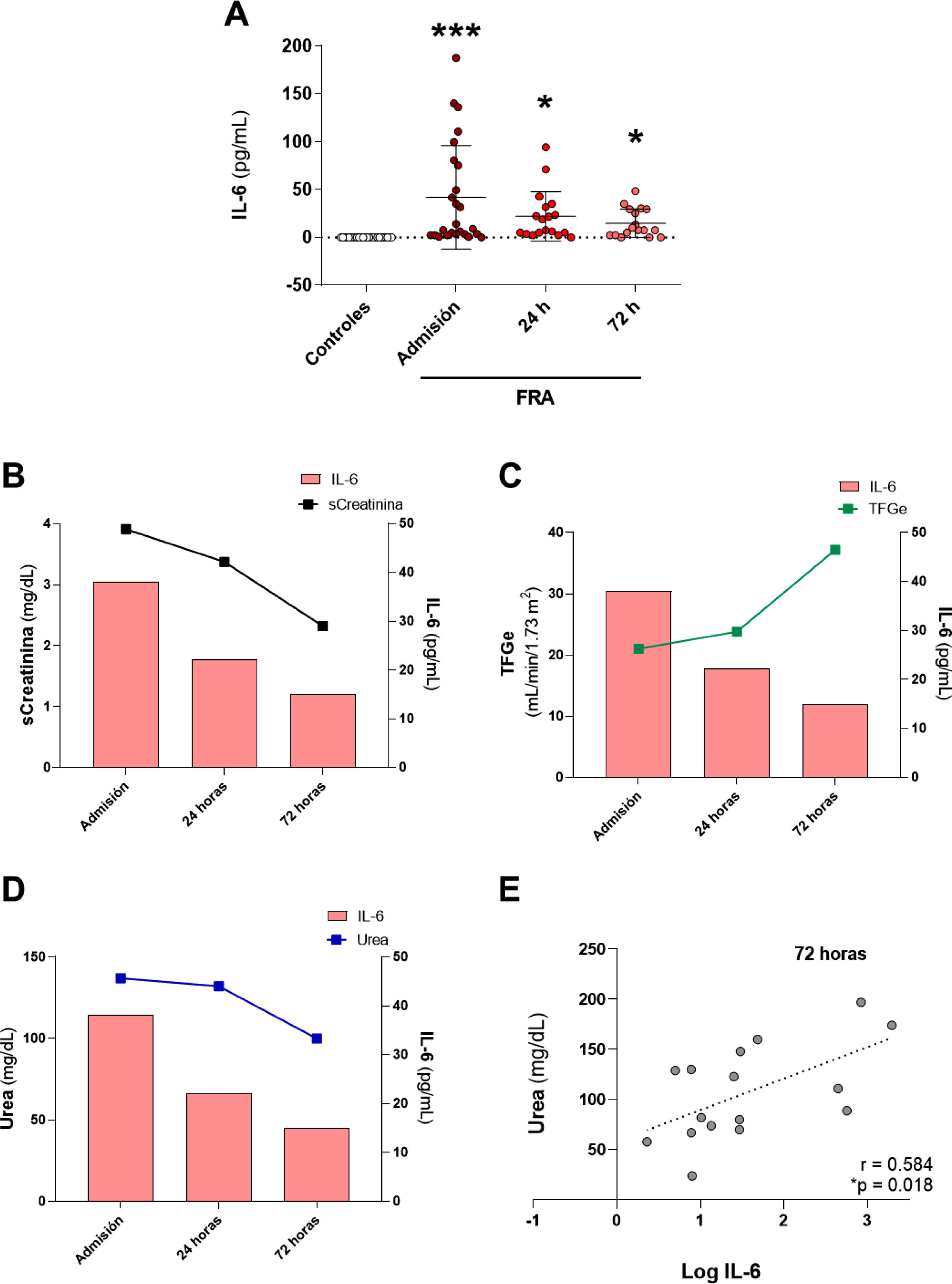
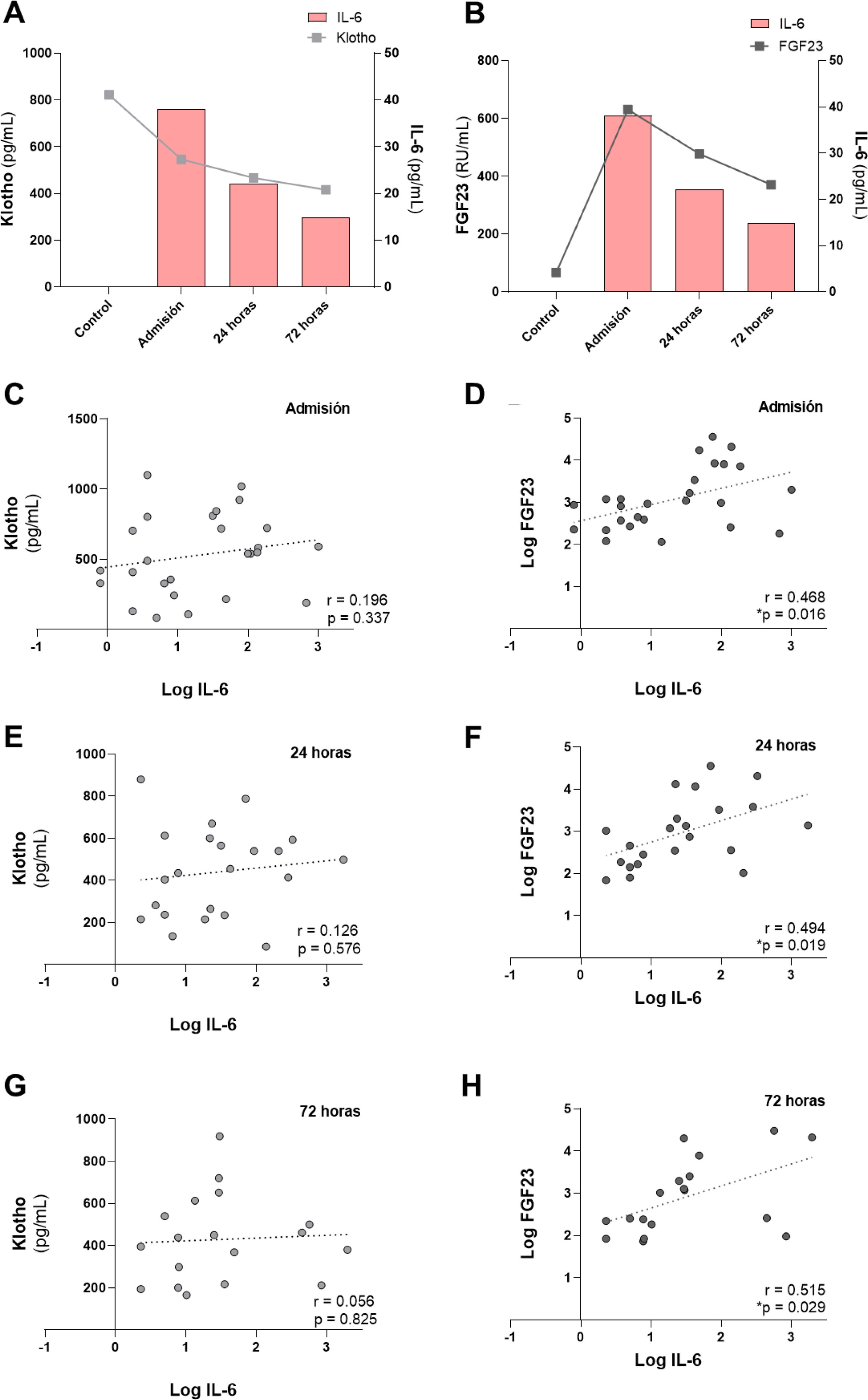
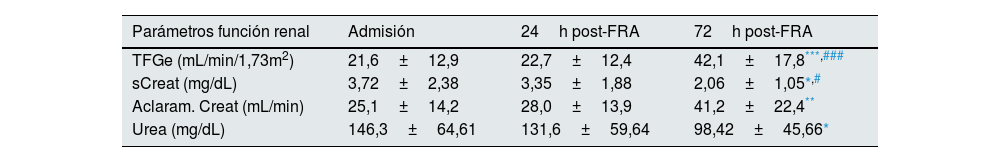
ResultadosValoración de la función renal y de parámetros del metabolismo mineral en pacientes con FRADe la cohorte de 28 pacientes con FRA, el 75% (21) eran hombres con una edad media de 64,3±16,1 años. Según los criterios AKIN de diagnóstico y clasificación de los estadios del FRA, del total de los pacientes, el 8,7% se encontraban en estadio 1, el 17,4% en estadio 2, y el 73,9% en estadio 3. Las causas del FRA fueron: necrosis tubular aguda (19), prerrenal (7), glomerulonefritis aguda (1) y nefritis aguda túbulo-intersticial (1). Del total de los pacientes, 6 fallecieron (21,4%). En la tabla 1 se muestran los resultados de los parámetros bioquímicos de acuerdo con la función renal, la concentración de biomarcadores relacionados con el metabolismo mineral de los pacientes con FRA en los tres tiempos de estudio, así como los valores obtenidos en el grupo de individuos control. Todos los pacientes, independientemente del momento, presentaron una TFGe inferior a 60mL/min/1,73m2 tras el FRA, aumentando de forma progresiva y significativa tras 72h post-FRA respecto al momento de la admisión hospitalaria y respecto 24h post-FRA (p<0,001). Tanto la creatinina sérica (sCreat) como la urea presentaban los valores más altos en el momento de la admisión hospitalaria, disminuyendo significativamente a las 72h (p<0,05 vs. admisión, p<0,05 vs. 24h post-FRA en el caso de la creatinina sérica). Tras 72h desde el ingreso, se produjo también una mejora del aclaramiento de creatinina comparado con el momento de la admisión (p<0,01). En la figura suplementaria 1 se muestran los resultados correspondientes a los parámetros analizados de función renal separando entre los pacientes que sobrevivieron frente a aquellos que no. Obtuvimos que la creatinina sérica disminuyó significativamente entre la admisión y 72h en los pacientes que sobrevivieron, mientras que no se observaron cambios en aquellos que fallecieron. En relación con la urea, en el grupo de supervivientes se produjo el descenso significativo tras las 72h. En cambio, en el grupo de no supervivientes, los valores de urea se mantuvieron elevados significativamente respecto al grupo de supervivientes tras las 72h. Por último, en relación con la TFGe, en los supervivientes aumentó tras las 72h, mientras que en los no supervivientes no hubo cambios. En relación con los marcadores del metabolismo mineral, al comparar con los valores de referencia del grupo control, obtuvimos la elevación significativa de cFGF23 en los tres tiempos estudio (p<0,001 vs. admisión, p<0,01 vs. 24h post-FRA y p<0,05 vs. 72h post-FRA), así como la disminución significativa de klotho (p<0,001 vs. admisión, 24h post-FRA y 72h post-FRA). Sin embargo, no obtuvimos diferencias significativas en los niveles plasmáticos de cFGF23 y klotho entre los tres tiempos de estudio. Estos resultados nos indican una mejoría de la función renal tras las 72h, pero sin cambios aparentes entre los niveles de los marcadores cFGF23 y klotho en el momento de la admisión y a las 24 y 72h post-FRA.
Parámetros de la función renal y del metabolismo mineral en pacientes con FRA en el momento de la admisión, tras 24 y 72h después del ingreso en el hospital
| Parámetros función renal | Admisión | 24h post-FRA | 72h post-FRA |
|---|---|---|---|
| TFGe (mL/min/1,73m2) | 21,6±12,9 | 22,7±12,4 | 42,1±17,8***,### |
| sCreat (mg/dL) | 3,72±2,38 | 3,35±1,88 | 2,06±1,05*,# |
| Aclaram. Creat (mL/min) | 25,1±14,2 | 28,0±13,9 | 41,2±22,4** |
| Urea (mg/dL) | 146,3±64,61 | 131,6±59,64 | 98,42±45,66* |
| Parámetros metabolismo mineral | Controles | Admisión | 24h post-FRA | 72h post-FRA |
|---|---|---|---|---|
| FGF23 (RU/mL) | 67,0±34,1 | 631,0±546,9*** | 477,7±450,7** | 371,2±408,6* |
| Klotho | 822,1±355,0 | 533,0±273,6** | 460,0±225,2*** | 410,0±217,4*** |
Los datos están expresados como la media±DE.
FGF23: factor de crecimiento de fibroblastos 23; FRA: fracaso renal agudo; sCreat: creatinina sérica; TFGe: tasa de filtrado glomerular estimada.
La concentración plasmática de IL-6 fue significativamente más elevada en los pacientes con FRA respecto al grupo de los individuos control en los tres tiempos de estudio, encontrando la mayor concentración de IL-6 circulante en el momento de la admisión hospitalaria (fig. 1A, p<0,001 vs. grupo control). Transcurridas 24 y 72h desde el ingreso, los niveles de IL-6 fueron disminuyendo manteniéndose significativamente elevados comparados con el grupo control de referencia (fig. 1A, p<0,05 vs. grupo control). Cuando comparamos los niveles sistémicos de IL-6 y la evolución de los diferentes parámetros de la función renal medidos en los tiempos postadmisión hospitalaria (sCreat, urea y TFGe), observamos que a medida que mejoraba la función renal con el incremento de la TFGe (fig. 1C), el descenso de la sCreat (fig. 1B) y de la urea (fig. 1D), los niveles de IL-6 también disminuían, indicando una evidente relación entre el daño renal agudo y el incremento de esta citoquina proinflamatoria en el momento del ingreso hospitalario. Se analizaron las correlaciones entre los distintos parámetros de función renal y los niveles de IL-6 a los tres tiempos de estudio, sin obtener correlación significativa entre ellas (datos no mostrados), excepto para el caso de la correlación entre los niveles de urea e IL-6, donde obtuvimos una correlación positiva y significativa tras las 72h (fig. 1E).
Análisis de los niveles sistémicos de la citoquina proinflamatoria IL-6 en pacientes con FRA y su relación con la función renal. (A) Niveles plasmáticos de IL-6 y su relación con los valores de la creatinina sérica (sCreat) (B), la tasa de filtrado glomerular estimada (TFGe) (C) y la urea (D) en pacientes con FRA en el momento de la admisión en el hospital, tras 24 y 72h desde el ingreso. (E) Correlación entre los niveles sistémicos de IL-6 con la urea 72h post-FRA. *p<0,05, ***p<0,001 vs. control.
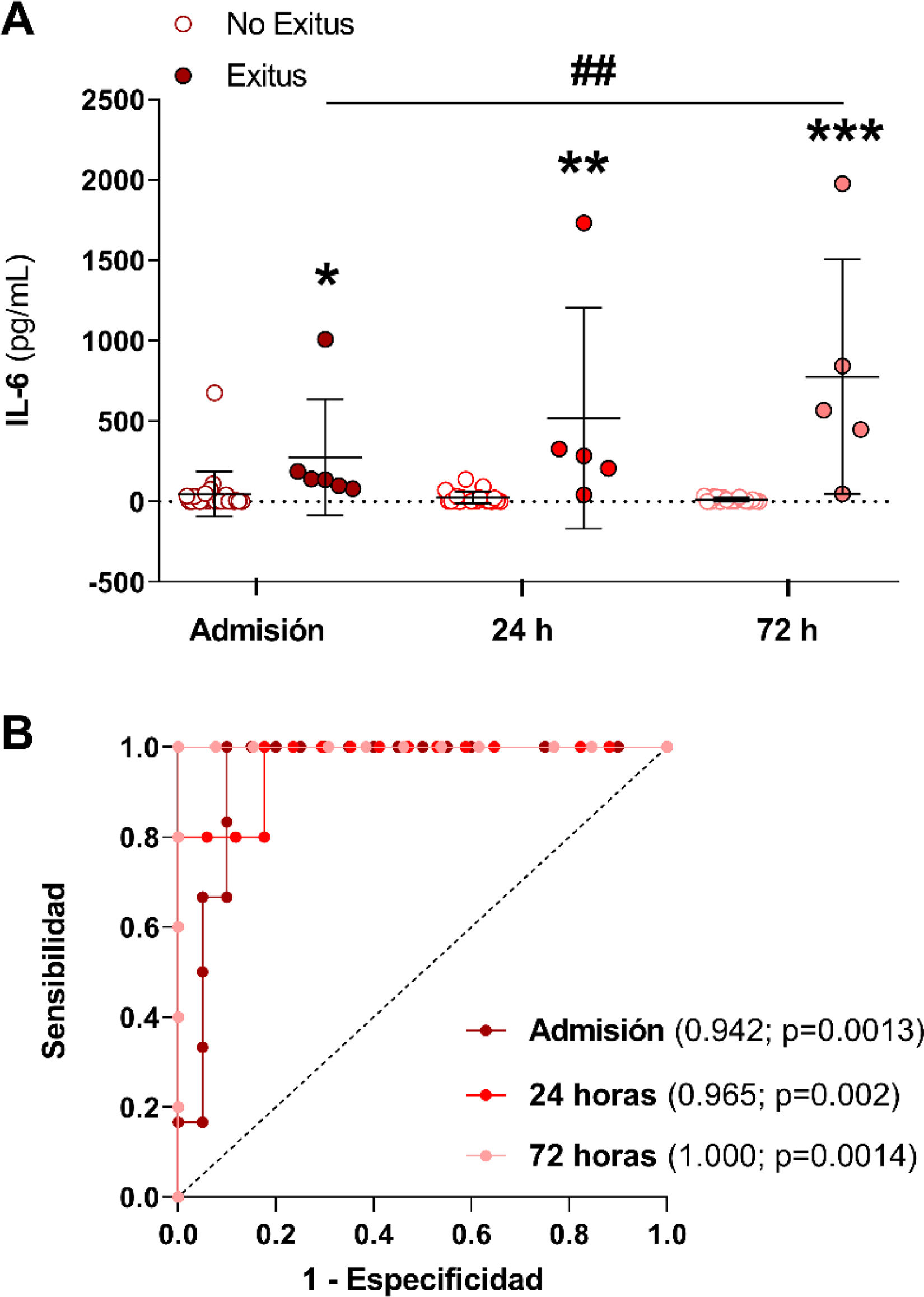
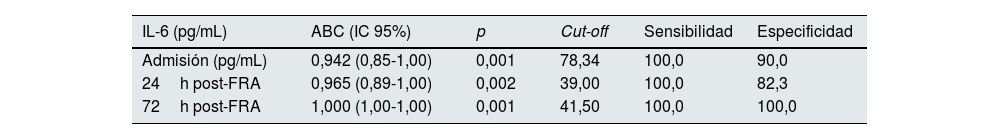
A continuación, analizamos si los niveles plasmáticos de IL-6 variaban entre los pacientes con FRA que sobrevivieron (no exitus) frente a aquellos que finalmente fallecieron (exitus) en los tres tiempos de estudio. En la fig. 2A se muestra que en los pacientes que sobrevivieron, la concentración de IL-6 va disminuyendo desde el momento del ingreso hasta las 72h post-ingreso, mientras que los pacientes que fallecieron presentaron mayores valores de IL-6 frente a aquellos que sobrevivieron en todos los tiempos, especialmente tras las 72h post-ingreso (fig. 2A, p<0,05, p<0,01 p<0,001 vs. supervivientes tras la admisión, 24 y 72h, respectivamente). Además, los niveles de IL-6 tras las 72h fueron significativamente mayores que los obtenidos en la admisión en aquellos pacientes que fallecieron (fig. 2A, p<0,001 vs. admisión). Por este motivo, analizamos si IL-6 podría ser un buen biomarcador predictor de mortalidad en nuestra cohorte de pacientes con FRA mediante el cálculo del área bajo la curva (ABC) y el análisis de las curvas ROC en los tres momentos del estudio. Cuánto más cercana a uno sea el ABC de un biomarcador, mejor predictor es, consiguiendo obtener un valor de corte o cut-off a partir del cual el biomarcador indicaría una elevada probabilidad de mortalidad. En la fig. 2B se muestran las ABC de la IL-6 en los tres tiempos de estudio de los pacientes con FRA, y en la tabla 2 se describen los valores de las ABC, los intervalos de confianza (IC), los puntos de corte, sensibilidad, especificidad y los valores de p de IL-6 en la admisión y tras 24 y 72h post-ingreso. Como puede observarse, la IL-6 es capaz de discriminar de forma significativa entre los pacientes con FRA que van a sobrevivir de los que no en los tres tiempos de estudio, alcanzando ya una buena discriminación en el momento de la admisión del paciente al hospital (ABC=0,942; p=0,0013; fig. 2B), y alcanzando una predicción total con valor de uno de ABC tras 72h post-ingreso en el hospital (fig. 2B, tabla 2, ABC=1,000, IC95%=1,00-1,00, p=0,001). El punto de corte en cuanto a los valores de concentración plasmática de IL-6 que predice la mortalidad es de 78,34pg/mL en el momento de la admisión al hospital y de 41,50pg/mL tras 72h post-ingreso (tabla 2).
Niveles de IL-6 en los pacientes que sobrevivieron al FRA frente a los que no y su capacidad predictora de mortalidad. (A) Valores plasmáticos de la citoquina IL-6 en pacientes con FRA que sobrevivieron (no exitus) frente a aquellos que fallecieron (exitus) en el momento de la admisión hospitalaria, tras 24 y 72h desde el diagnóstico del FRA. (B) Curvas ROC para determinar el valor predictivo de mortalidad de la citoquina IL-6 en el momento de la admisión hospitalaria (línea granate), tras 24 (línea roja) y 72h desde el diagnóstico del FRA (línea rosa) (B). *p<0,05, **p<0,01, ***p<0,001 vs. su respectivo grupo no exitus según el tiempo de estudio.
Áreas bajo la curva (ABC) y valores de corte de la IL-6 para la predicción de mortalidad en pacientes con fracaso renal agudo (FRA) en el momento de la admisión, y tras 24 y 72h desde el ingreso en el hospital
| IL-6 (pg/mL) | ABC (IC 95%) | p | Cut-off | Sensibilidad | Especificidad |
|---|---|---|---|---|---|
| Admisión (pg/mL) | 0,942 (0,85-1,00) | 0,001 | 78,34 | 100,0 | 90,0 |
| 24h post-FRA | 0,965 (0,89-1,00) | 0,002 | 39,00 | 100,0 | 82,3 |
| 72h post-FRA | 1,000 (1,00-1,00) | 0,001 | 41,50 | 100,0 | 100,0 |
En nuestra cohorte de pacientes observamos previamente (tabla 1) el descenso de los niveles sistémicos de klotho tras el momento de la admisión del paciente con FRA al hospital. Por este motivo, estudiamos su relación con los niveles de IL-6 en cada tiempo analizado. Así, obtuvimos que se producía un fuerte descenso de la concentración plasmática de klotho respecto al grupo de individuos sanos en el momento de la admisión hospitalaria, que coincidía con la mayor concentración de IL-6 observada en los pacientes con FRA (fig. 3A). Por el contrario, los niveles circulantes de cFGF23 aumentaron, obteniendo su pico máximo en el momento de la admisión, coincidiendo con los valores máximos observados para la IL-6. Ambos biomarcadores disminuyeron tras las 24 y 72h post-FRA (fig. 3B). Analizamos las correlaciones entre esta citoquina con los marcadores del metabolismo mineral, klotho y cFGF23, medidos en los tres tiempos del estudio. No hubo correlación entre IL-6 con los niveles de klotho (fig. 3C, E y G). Sin embargo, sí existió una correlación significativa y positiva entre la concentración de cFGF23 e IL-6 en todos los tiempos analizados, admisión y tras 24 y 72h (fig. 3D, F y H).
Relación entre los niveles de IL-6 con los marcadores de metabolismo mineral cFGF23 y klotho en los pacientes con FRA. Relación entre la concentración plasmática de la citoquina IL-6 y la concentración sistémica de klotho (A) y de cFGF23 (B). Correlaciones entre los niveles sistémicos de IL-6 con klotho en la admisión (C), tras 24h (E) y 72h desde el FRA (G), y con cFGF23 en la admisión (D), tras 24h (F) y 72h desde el FRA (H).
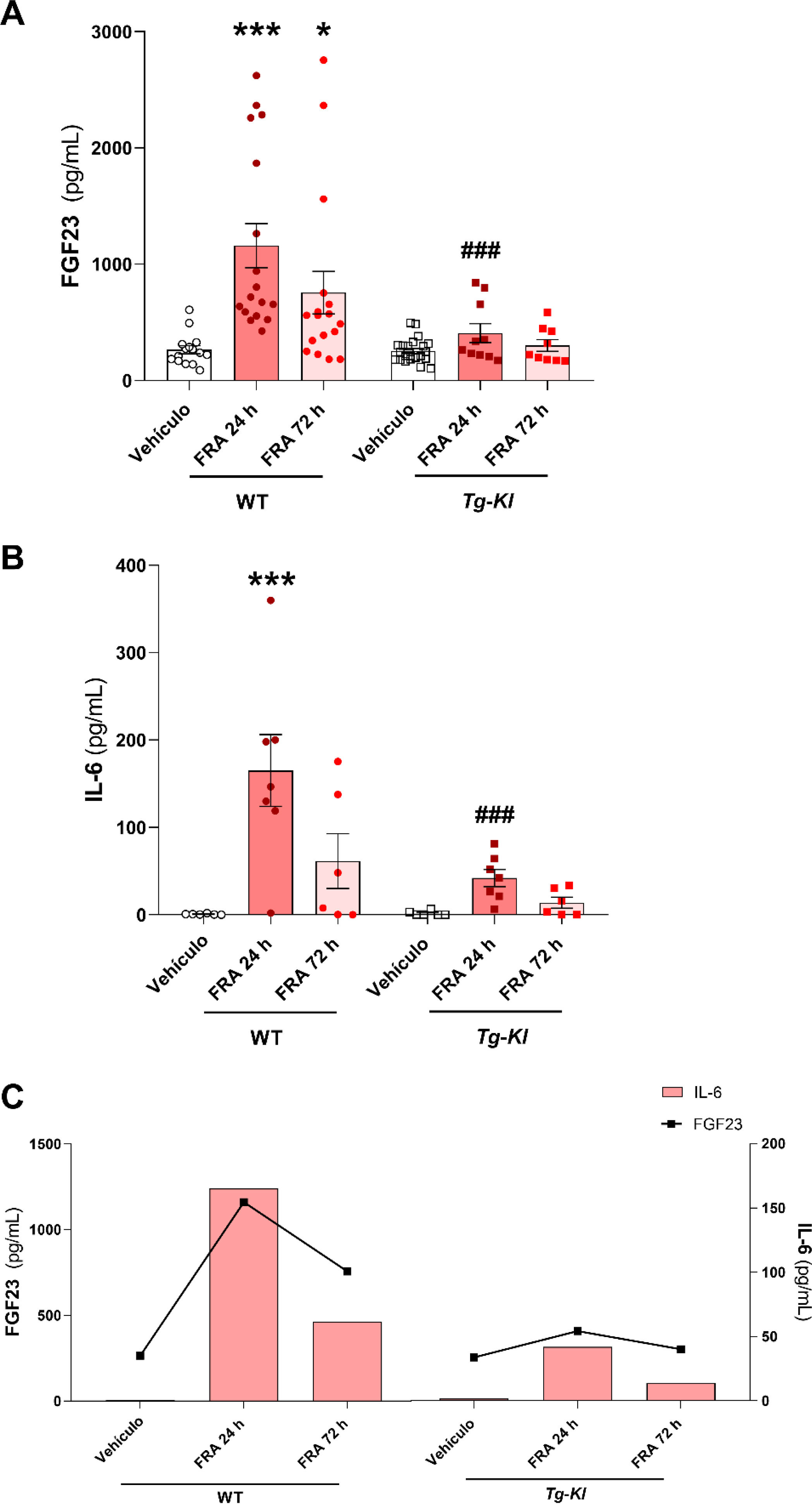
Dado que en las muestras de los pacientes con FRA obtuvimos el descenso de los niveles plasmáticos de klotho en comparación con el grupo control, quisimos estudiar en un modelo experimental murino de FRA nefrotóxico, inducido por la inyección de ácido fólico, si la sobreexpresión de klotho podía prevenir el aumento de IL-6. En primer lugar, analizamos la concentración en plasma de IL-6 tanto en ratones WT como en la cepa de ratones transgénicos que sobreexpresan klotho (Tg-Kl), tras 24 y 72h postinducción del FRA. Como obtuvimos una correlación positiva y significativa entre los niveles de cFGF23 y la IL-6 en los pacientes con FRA en el momento de la admisión hospitalaria (fig. 3D), así como tras 24 y 72h (fig. 3F y H), analizamos los niveles de cFGF23 en todos los grupos experimentales. Así, observamos que cFGF23 aumentó significativamente tras las 24h desde la inducción del FRA (fig. 4A, p<0,001), manteniéndose, aunque más baja, también significativamente elevada tras las 72h post-FRA en los ratones WT (fig. 4A, p<0,05). Sin embargo, en los ratones Tg-Kl con FRA, cFGF23 no aumentó, siendo significativamente menor que los encontrados en los ratones WT tras 24h post-FRA (fig. 4A, p<0,001). Obtuvimos el mismo patrón para los niveles circulantes de IL-6 en ratón, con un incremento significativo de IL-6 en los ratones WT tras 24h desde el daño renal (fig. 4B, p<0,001), disminuyendo tras 72h, mientras que en los ratones Tg-Kl, IL-6 no aumentó de forma significativa, y además sus niveles fueron significativamente menores que los encontrados en los ratones WT 24h post-FRA (fig. 4B, p<0,001). De forma global, en la figura 4C se representa la comparación entre los niveles de IL-6 y cFGF23 en las dos cepas de ratones con FRA con y sin sobreexpresión de klotho, donde además parece que la sobreexpresión de klotho protege del incremento sistémico inducido por el FRA de ambas moléculas.
Relación entre los niveles de IL-6 y cFGF23 en ratones con FRA inducido en ratones WT y ratones con sobreexpresión génica de klotho Tg-Kl. Niveles plasmáticos de cFGF23 (A) y de la citoquina IL-6 (B) en ratones WT y ratones que sobreexpresan klotho (Tg-Kl) tras 24 y 72h desde la inducción del FRA. (C) Relación entre la citoquina IL-6 y cFGF23 en los ratones WT y Tg-Kl tras las 24 y 72h desde la inducción del FRA (C). *p<0,05, ***p<0,001 vs. vehículo WT; ###p<0,001 vs. grupo WT con 24h post-FRA.
Entre los diferentes mecanismos patológicos asociados al FRA destaca el fuerte componente inflamatorio desencadenado a nivel renal, que conduce a la liberación de diferentes mediadores proinflamatorios a la circulación sistémica. De entre todos ellos, la citoquina proinflamatoria IL-6 tiene un importante papel en el inicio del daño renal. Por otro lado, son bien conocidas las alteraciones de los distintos componentes del metabolismo mineral durante un FRA, como es la liberación de la hormona fosfatúrica FGF23, así como la disminución renal y sistémica de klotho. Nuestro estudio demuestra que los valores de IL-6 se encuentran elevados en el paciente con FRA, especialmente en el momento de su admisión al hospital, y van disminuyendo a medida que se va recuperando la función renal. Además, destacamos que los niveles de IL-6 tienen alta capacidad predictora de mortalidad en el paciente con FRA desde el momento de su ingreso al hospital, siendo esta predicción total tras 72h desde la admisión. Por otro lado, los niveles de IL-6 se asocian con los niveles de cFGF23 encontrados tanto en el paciente con FRA como en un modelo experimental de FRA en ratón. Además, es importante mencionar que los ratones con FRA, pero con sobreexpresión de klotho, no muestran elevación ni de la IL-6 ni del cFGF23. Con todo ello, IL-6 se propone como un buen biomarcador temprano de predicción de la mortalidad asociada al FRA, que es a su vez dependiente de los componentes del metabolismo mineral FGF23 y klotho.
Dada la elevada incidencia del FRA entre los pacientes hospitalizados, sobre todo en aquellos pacientes críticos en la UCI los cuales asumen una elevadísima mortalidad, biomarcadores válidos para la detección precoz de la severidad de un FRA y su mortalidad asociada serían una herramienta muy útil para la intervención temprana del paciente, especialmente en aquel con altas probabilidades de agravamiento de su estado de salud. En este sentido, nuestros resultados demuestran que el pico máximo de concentración sistémica de IL-6 tuvo lugar en el momento de la admisión hospitalaria del paciente con FRA, y aunque tras 24 y 72h los niveles continuaron significativamente elevados respecto al grupo de individuos sanos, existe una tendencia a su estabilización con el paso del tiempo (fig. 1A). Tal estabilización venía asociada a la recuperación de la función renal (fig. 1B-D). Este incremento plasmático de IL-6 durante el FRA, además de deberse al aumento de su síntesis local a nivel renal y su posterior liberación a la sangre, también podría deberse a la reducción de su aclaramiento renal, contribuyendo ambas circunstancias a este aumento de IL-6 que encontramos en sangre, especialmente en el momento de la admisión del paciente, siendo por tanto un biomarcador temprano de daño inflamatorio asociado con un claro compromiso de la función renal11,22,23. Nuestros hallazgos apoyan estudios previos en los cuales también se postula la IL-6 como un biomarcador a tener en cuenta tras un daño renal9,24. Cuando analizamos los niveles de IL-6 en función de la supervivencia de los pacientes con FRA (fig. 2B), observamos que mientras la IL-6 en los pacientes con FRA que sobrevivieron disminuía de forma progresiva con el tiempo, los valores de IL-6 en los que fallecieron iban aumentando de forma significativa, encontrando su máxima concentración tras las 72h desde el FRA. Además, es a las 72h donde la predicción de mortalidad de los valores de IL-6 es del 100%, con un valor de corte de 41,5pg/mL, valor umbral que debería ser una señal de alarma en el manejo clínico de los pacientes con FRA que ingresan en un hospital (tabla 2).
Es característico que en la ERC se produzcan anomalías en el metabolismo mineral, como son la hipocalcemia, hiperfosfatemia, el aumento de FGF23 y la disminución de la expresión renal y sistémica de klotho, y muchas de estas anomalías también son comunes en un FRA25. Además, otros estudios han demostrado que en la ERC los niveles elevados de FGF23 correlacionan con el estado inflamatorio de estos pacientes, donde la IL-6, la proteína C reactiva y FGF23 son además factores de riesgo independientes en términos de mortalidad26. En este estudio analizamos si existía una relación entre los niveles plasmáticos de IL-6 y los componentes del metabolismo mineral cFGF23 y klotho. En nuestra cohorte, el pico máximo de concentración de cFGF23 coincidió con el pico máximo de IL-6, siendo este en el momento de la admisión del paciente FRA al hospital (fig. 3B), existiendo una correlación positiva y significativa entre ambos (fig. 3D). Por su parte, la caída máxima de los niveles plasmáticos de klotho también ocurrió en el momento del ingreso coincidiendo con la mayor concentración encontrada de IL-6 (fig. 3A), y aunque con el paso de las horas la función renal se iba recuperando y los niveles de IL-6 disminuyendo, klotho continuaba bajando tras las 72h post-ingreso. Estos resultados apuntan a la existencia de una estrecha relación entre el empeoramiento de la función renal, el fenómeno inflamatorio, y la regulación del metabolismo mineral tras un FRA. Para comprobar esta relación, a continuación estudiamos la IL-6 en un modelo experimental nefrotóxico de FRA en ratón, que es bien sabido que cursa con una fuerte reducción de la expresión de klotho y aumento de los niveles de FGF2327. Nuestros resultados demuestran que en los ratones WT se reprodujo el aumento plasmático tanto de cFGF23 como de IL-6 tras las 24 y 72h desde la inducción del FRA, como ocurría en los pacientes, obteniendo el pico de concentración de ambas moléculas tras las 24h. Por el contrario, en los ratones Tg-Kl con sobreexpresión genética de klotho, no aumentaron de forma significativa ni IL-6 ni cFGF23 (fig. 4A-C), demostrando el papel protector de klotho tanto a nivel inflamatorio como a nivel del metabolismo mineral. Estudios previos han demostrado también que la inflamación es capaz de activar la síntesis de FGF23, y concretamente, la citoquina IL-6 es uno de los mediadores inflamatorios que contribuye a su aumento activando la transcripción de FGF2328,29. Además, se ha descrito que FGF23 también promueve la inflamación creando un circuito de retroalimentación positiva, agravando el daño renal28. Por lo tanto, IL-6 podría ser uno de los posibles contribuyentes en la elevación de los niveles sistémicos de FGF23 más allá de la hiperfosfatemia en la enfermedad renal, y particularmente en el contexto de un FRA donde el componente inflamatorio agudo es muy importante. Klotho es una proteína transmembrana que, además de actuar como correceptor del receptor de FGF23 (FGFR1) facilitando la función fosfatúrica de FGF23, la escisión de su dominio extracelular da lugar a la forma soluble de klotho (sKl). sKl es liberada a la circulación sistémica como un factor endocrino, pudiendo ejercer sus funciones antiapoptóticas, antifibróticas y antiinflamatorias sobre diferentes órganos del cuerpo25,30. En relación con sus acciones sobre la inflamación, klotho es capaz de disminuir la expresión de ciertas citoquinas proinflamatorias y aumentar la secreción de factores antiinflamatorios31–33. Dado que hemos obtenido que en los ratones que sobreexpresan klotho, IL-6 no aumenta del mismo modo que ocurre en los ratones WT, podemos pensar que al inhibir la síntesis de IL-6 y, por lo tanto, atenuar el daño renal inducido por el ácido fólico en condiciones de sobreexpresión de klotho, la función renal de estos ratones está protegida. Una de las principales limitaciones de este trabajo ha sido el no poder concluir si el descenso de la IL-6 circulante que vemos en los ratones Tg-Kl se debe a la acción de la forma transmembrana de klotho, o bien si es un efecto sistémico sobre el estatus inflamatorio gracias a su forma soluble. Estudios previos han demostrado que los ratones con sobreexpresión de klotho mantienen los niveles de klotho renales tras la inducción del FRA27. Además, otros estudios han demostrado que estos ratones transgénicos tienen una elevación de los niveles de klotho sistémicos34. Estos resultados sugieren que el mantenimiento de los niveles de klotho, ya sean renales, sistémicos o ambos, en circunstancias de FRA, podría ser el responsable de inhibir la síntesis de IL-6, como observamos que ocurre en nuestros ratones con sobreexpresión de klotho tras la inducción del FRA. De la misma forma, con los resultados obtenidos en pacientes tampoco podemos concluir si el aumento de IL-6 o la disminución de klotho, o incluso ambas circunstancias, es lo que determina la severidad del FRA. Podría elucubrarse que en condiciones donde klotho esté disminuido, este factor predisponga a mayor estado inflamatorio y que ello determine mayor severidad renal y peor pronóstico. Estudios futuros tendrán que resolver estos aspectos. Apoyando estos resultados, a nivel clínico se ha demostrado que niveles más elevados de klotho correlacionan con niveles más bajos de IL-6 en pacientes en diálisis peritoneal35, así como que el déficit de klotho parece contribuir al incremento de la inflamación en pacientes con ERC en estadio final, especialmente en aquellos en hemodiálisis36.
En conclusión, con este estudio demostramos que existe una asociación significativa entre la disfunción renal aguda y el aumento de la citoquina proinflamatoria IL-6 y de FGF23, en un contexto de FRA, especialmente en el momento de la admisión hospitalaria. La determinación de IL-6 en el momento que el paciente llega al hospital con un FRA sería de especial relevancia, ya que su capacidad predictora de mortalidad es muy elevada, tanto en el momento de la admisión como en los primeros días posteriores al ingreso del paciente. Además, también demostramos cómo los niveles de klotho pueden determinar la protección a nivel renal en cuanto a los procesos inflamatorios desencadenados que pueden conducir al incremento de la síntesis de IL-6.
FinanciaciónEste estudio fue principalmente financiado por una de las ayudas a investigación de la Sociedad Española de Nefrología/Fundación SENEFRO 2021 y parcialmente por el Instituto de Salud Carlos III (ISCIII) (PI20/00763, CPII20/00022, FI21/00212, PI23/00182) y cofinanciado por la Unión Europea, Ministerio de Universidades (FPU20/03005), Consejería de Educación de la Comunidad de Madrid (PEJ-2021-AI/SAL-21426), Red en Biomedicina de la Comunidad de Madrid (P2022/BMD-7223 CIFRA_COR-CM), Redes en Investigación Nacional (RED2022-134511-T), y la Sociedad Española de Cardiología (SEC)/Fundación Española del Corazón (SEC/FEC-INV-BAS 23).
Conflicto de interesesLos autores de este manuscrito no tienen conflictos de interés que declarar.