INTRODUCCIÓN
La asociación entre fósforo (P) y supervivencia se ha descrito hace aproximadamente una década en pacientes en programa de hemodiálisis1,4. A continuación, la vinculación entre P y supervivencia ha sido explorada en sucesivos escenarios. En pacientes con enfermedad renal crónica (ERC) aún no en diálisis se ha descrito un efecto adverso tanto sobre la supervivencia del paciente5,6, como sobre la supervivencia libre de entrada en diálisis, es decir, sobre la progresión de la ERC6,7. Un tercer escenario, en cierta medida sorprendente, es la asociación entre P y supervivencia en estudios poblacionales, donde los niveles de P se encuadran dentro del rango establecido como «normal»8-10.
El nivel de evidencia de todos estos estudios, amplios en general, viene limitado por su carácter observacional y retrospectivo. Ninguna de estas observaciones se ha realizado en ensayos prospectivos que otorguen el máximo nivel de evidencia. A pesar de ello, esta información es relevante, y representa un reto para redefinir los valores diana de P en el enfermo renal. A nivel experimental, también supone un desafío indagar en los mecanismos por los que el P tiene un efecto adverso sobre la supervivencia en general, y sobre la morbilidad y mortalidad cardiovasculares en particular.
En el presente artículo, revisaremos la asociación descrita entre P y supervivencia en los sucesivos escenarios y sus implicaciones sobre el establecimiento de nuevos los niveles diana de P.
ASOCIACIÓN ENTRE FÓSFORO Y SUPERVIVENCIA EN HEMODIÁLISIS
Durante la década de 1980 y gran parte de la de 1990, el objetivo prioritario en las alteraciones del metabolismo mineral era el control del hiperparatiroidismo. Para ello se usaban altas dosis de calcitriol y se recomendaban niveles de P no superiores a 6,5 mg/dl y de hasta 10,5 mg/dl de calcio. El precio que se pagó fue muy caro, puesto que se observó, ya tarde, que esta práctica conducía a un incremento de las calcificaciones de tejidos extraesqueléticos, especialmente los cardiovasculares.
A finales de la década de 1990 una serie de trabajos describieron una relación adversa entre P y supervivencia. Estos estudios1 revelaron que el riesgo de muerte aumentaba cuando los valores de P eran superiores a 5,5 mg/dl, y otros posteriores2-4 pusieron este umbral en 5, 6 y 6,5 mg/dl para riesgo de muerte de origen cardiovascular. Aunque todos fueron estudios observacionales y retrospectivos, las series de enfermos eran amplias y el meticuloso estudio estadístico aplicado condujo a aceptar como evidencia que niveles de P superiores a 5,5 mg/dl incrementaban la mortalidad. Estas recomendaciones fueron divulgadas por las guías KDOQI en 200311 y se han aceptado hasta la actualidad. El pasado año, las recomendaciones establecidas por nefrólogos españoles en la guías S.E.N.12 situaban este umbral en valores de 5 mg/dl.
No se han comunicado beneficios de la supervivencia con niveles de P inferiores a 5 mg/dl en pacientes en hemodiálisis. Más bien se ha sugerido que valores relativamente bajos de P se asocian a un incremento de la mortalidad, probablemente debido al deterioro del estado nutricional de estos enfermos2,4.
La asociación entre P y supervivencia, hasta donde alcanza nuestra información, no ha sido explorada o demostrada específicamente en pacientes en diálisis peritoneal o en trasplantados renales.
ASOCIACIÓN ENTRE FÓSFORO Y SUPERVIVENCIA DEL PACIENTE CON ERC AÚN NO EN DIÁLISIS
En general, los pacientes que aún no han iniciado diálisis tienen niveles de P más bajos que el enfermo en diálisis13,14. Esto ha conducido a estudiar la asociación del P y la supervivencia dentro de otro rango de valores de P. Kestembaun et al.5 estudiaron una serie amplia de pacientes con distintos estadios de ERC (creatininemia >1,2 mg/dl y filtración glomerular renal [GFR] media de 50 ml/min) y analizaron la mortalidad en función de categorías de P. Fue destacable que niveles de P superiores a 3,5 mg/dl incrementaban el riesgo de muerte por cualquier causa y de muerte y/o infarto de miocardio en un análisis de riesgos proporcionales de Cox. Por su parte, Voormolen et al.6 también describieron un incremento del riesgo de muerte en función del incremento de los niveles de P, en este caso en enfermos con ERC en estadios 4 y 5. Cada incremento de P de 1 mg/dl multiplicaba por 1,6 el riesgo de muerte en un modelo de Cox ajustado para factores de confusión.
ASOCIACIÓN ENTRE FÓSFORO Y PROGRESIÓN DE LA ERC
Estudios antiguos realizados en animales de experimentación15,16 y en humanos17,18 demostraron los beneficios de la restricción dietética de P sobre la progresión de la ERC. Los mecanismos no han sido aclarados, pudiendo relacionarse con incremento de la nefrocalcinosis, hiperparatiroidismo, o simplemente, dada la relación entre la ingesta de proteínas y de P19, acompañando a los beneficios renoprotectores de la restricción proteica de la dieta20.
Más recientemente, dos estudios clínicos, observacionales, han descrito la asociación entre P y progresión de la ERC6,7. Schwarz S et al.7 en un estudio realizado en varones con estadios 1-5 de ERC encontraron un deterioro renal acelerado con niveles de P superiores a 3,8 mg/dl. Por su parte, Voormolen et al.6 describieron que por cada mg/dl de incremento de P, la progresión de la ERC se aceleraba 1,8 ml/min/año.
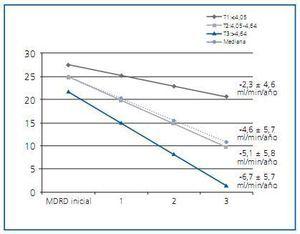
Nosotros analizamos la asociación entre P y progresión de ERC en pacientes con GFR <50 ml/min. Se estudiaron un total de 333 pacientes que iniciaron consulta de ERC avanzada durante el periodo 2001-2006. El análisis no ajustado (Kaplan-Meier) y ajustado (modelo de Cox) reveló que el aumento de P es predictor de evolución desfavorable del daño renal21. Con objeto de verificar la robustez de nuestro análisis, aplicamos dos modelos multivariados adicionales, controlando para otros factores de riesgo establecidos, especialmente la albuminuria. Empleando el modelo de regresión lineal analizamos la pendiente de deterioro renal ¿estimada por la ecuación MDRD22 ¿ en función de los terciles de P. La mediana de pérdida de función renal fue de -4,6 ± 5,7 ml/min/año, siendo significativamente más rápida en pacientes con P más elevado (figura 1). A continuación, exploramos la influencia del P sobre la supervivencia sin necesidad de diálisis, empleando en este caso la calcemia, la fosforemia y el cociente albúmina:creatinina en orina como indicadores dependientes de tiempo, es decir, considerando las variaciones de estos parámetros durante el periodo de seguimiento. Los estudios previos habían examinado la asociación entre P basal y deterioro renal, sin considerar los cambios bioquímicos en el tiempo. De esta forma investigamos la influencia del P en un escenario temporal, más real que si restringimos el análisis a los datos basales. Aplicando este modelo, cada incremento de 1 mg/dl de P se asoció a un HR (IC 95%) ajustado de 2,1 (1,6-2,8); p<0,0001.
ASOCIACIÓN ENTRE FÓSFORO Y SUPERVIVENCIA EN ESTUDIOS POBLACIONALES
Tres artículos recientes han destacado la asociación entre P y supervivencia en estudios poblacionales. El primero fue publicado por Tonelli et al.9 en un análisis post hoc del estudio CARE23 donde demuestran una asociación independiente entre P y riesgo de muerte o episodios cardiovasculares, en una población con infarto de miocardio previo. Resultó destacable que el riesgo aumentaba con niveles de P superiores a 3,5 mg/dl, es decir, dentro del rango alto de la normalidad. El segundo estudio pertenece a Dhingra et al.8 y fue realizado en una población sin enfermedad renal, ni riesgo cardiovascular. Los autores también encontraron una asociación entre niveles de P superiores a 3,5 mg/dl y episodios cardiovasculares. En el tercer estudio, realizado por Foley et al.10, estudiaron la asociación de P y calcificaciones coronarias en una serie amplia de adultos jóvenes procedentes del estudio CARDIA24. Los autores describen una asociación independiente entre niveles de P superiores a 3,9 mg/dl y calcificaciones coronarias. Aunque todos los autores coinciden en que estos datos deben ser confirmados en estudios prospectivos, todo indica que niveles de P incluso en el rango alto de la normalidad se asocian a riesgo de calcificaciones vasculares, episodios cardiovasculares y muerte en la población general.
¿CUÁLES SON LOS NIVELES ÓPTIMOS?
A la luz de la reciente información, los clásicos niveles óptimos recomendados para el enfermo renal en las guías DOQI11 quedan en entredicho. Los valores de P considerados como normales por los laboratorios de referencia y la bibliografía consultada están en un rango de 2,5-4,5 mg/dl. Sin embargo, la información reciente obtenida de estudios poblacionales sugiere que valores superiores a 3,5 mg/dl aumentan el riesgo de episodios cardiovasculares y muerte.
Las guías KDOQI11 han recomendado niveles óptimos de P entre 2,7-4,6 mg/dl para ERC en estadios 3 y 4, y niveles entre 3,5-5,5 mg/dl para estadios 5 y 5D, es decir, GFR <15 ml/min o en diálisis. Asimismo, las recomendaciones establecidas por la S.E.N.12 recomiendan mantener valores inferiores a 5 mg/dl. Sin embargo, los estudios realizados en pacientes con ERC aún no en diálisis, sugieren que valores entre 3,5 y 4,5 mg/dl aumentan el riesgo de muerte y progresión de la ERC. Resulta paradójico constatar que valores de P entre 3,5-5 mg/dl hayan demostrado peor supervivencia en el enfermo en diálisis4, y que, a su vez, muestren beneficios en estudios poblacionales25,26 y en pacientes con ERC aún no en diálisis5.
Advertidos por la información reciente, las guías KDIGO, que se publicarán de forma oficial próximamente, recomendarán alcanzar valores próximos al rango normal en todos los estadios de ERC, sin señalar valores concretos. Aunque la información previa se ha basado en estudios retrospectivos y observacionales, a falta de mayor nivel de evidencia parece razonable recomendar llevar los niveles de P en el enfermo renal, independientemente del estadio, a parámetros próximos al rango normal.
Figura 1.