La hemodiafiltración con reinfusión endógena del ultrafiltrado (HFR) es una técnica de diálisis caracterizada por un cartucho de resina con poder adsorbente que combina los mecanismos difusión, convección y adsorción en un solo esquema terapéutico. Después de cerca de 20 años de experiencia clínica con HFR, el presente artículo revisa la evidencia acumulada con esta técnica, planteando si la adición de la adsorción, como tercer mecanismo depurativo, debería ser el siguiente paso en el tratamiento de los pacientes en hemodiálisis. La HFR, a pesar de producir una extensa eliminación de toxinas urémicas, ha demostrado reducir la pérdida de nutrientes y componentes fisiológicos durante la sesión de diálisis frente a la hemodiafiltración on-line, mitigando el estado inflamatorio y el estrés oxidativo en esta población. Además de su facilidad de uso, la técnica también es altamente biocompatible y puede utilizarse en situaciones de un acceso vascular comprometido. En base a estas observaciones, la HFR parece ser una técnica especialmente útil para pacientes con elevada comorbilidad, incluyendo aquellos con fragilidad, desnutrición o enfermedad cardiovascular. En esta revisión, como panel de consenso de nefrólogos con experiencia clínica en HFR, examinamos la literatura existente y resumimos nuestros puntos de vista sobre cómo usar esta técnica, qué perfil de paciente puede ser más adecuado para la HFR, y cómo prescribir y monitorizar de manera práctica esta modalidad de diálisis.
Hemodiafiltration with endogenous reinfusion of the ultrafiltrate (HFR) is a dialysis technique characterized by a resin cartridge with adsorptive properties that combines the mechanisms of diffusion, convection, and adsorption in a single therapeutic regimen. After nearly 20 years of clinical experience with HFR, this article reviews the accumulated evidence with this technique, considering whether adsorption reduction, as a third purification mechanism, should be the next step in the treatment of hemodialysis patients. HFR, beyond producing an extensive removal of uremic toxins, has demonstrated to reduce the loss of nutrients and other physiological components during the dialysis session as compared to online hemodiafiltration, ameliorating the inflammatory state and oxidative stress in this population. In addition to its ease of use, the technique is also highly biocompatible and can be used in patients with a compromised vascular access. Based on these observations, HFR appears to be an especially useful therapy for high-comorbidity patients, including those with frailty, malnutrition, or cardiovascular disease. In this review, we, as a consensus panel of nephrologists experienced with HFR, survey existing literature and summarize our views on when to use this technique, which patients may be best suited for HFR, and how to effectively prescribe and monitor this modality of dialysis in daily clinical practice.
El objetivo último de la diálisis es aumentar la supervivencia de las personas en terapia renal sustitutiva, mejorando su calidad de vida y minimizando las complicaciones relacionadas con la propia técnica de diálisis1. Para lograr este objetivo, las prescripciones de diálisis se han modificado en las últimas décadas, mejorando la biocompatibilidad de las membranas de diálisis y aumentando la eficacia de la eliminación de solutos urémicos de pequeño y mediano peso molecular mediante una optimización de la difusión y la convección. Pese a que la hemodiafiltración en línea (HDF-OL) con alto volumen convectivo han supuesto sin duda un avance en la reducción de la morbilidad y la mortalidad de los pacientes en hemodiálisis (HD)2,3, la calidad de vida y la supervivencia de la población en diálisis siguen siendo bajas4,5.
¿Hemos alcanzado la máxima eficiencia de diálisis que podemos obtener manipulando únicamente el tamaño de los poros? Tiempo para la adsorciónAunque el desarrollo de membranas de alto flujo –incluyendo aquellas de «cut-off» medio– ha mejorado el aclaramiento de moléculas medias6, las moléculas que superan los 70kDa no son eliminables mediante filtración o difusión7,8. Del mismo modo, el aclaramiento dialítico de p-cresol sulfafto (pCS), y otras toxinas urémicas ligadas a proteínas (PBUTs, protein-bound uremic toxins), es deficiente con el tratamiento difusivo y está limitado con la HDF-OL9, y solo unos pocos estudios han explorado cómo mejorar su eliminación mediante otras terapias extracorpóreas10–14. Este dato es de especial relevancia, dado que las PBUTs guardan una gran correlación con las complicaciones cardiovasculares de los pacientes con enfermedad renal crónica (ERC) en HD11–13,15,16, primera causa de muerte en esta población17,18. Llegados a este punto, parece muy difícil mejorar la depuración de las toxinas urémicas mediante la simple manipulación del tamaño de los poros sin pagar el precio de una mayor pérdida de albúmina y otras sustancias beneficiosas, como aminoácidos, vitaminas, hormonas y factores de crecimiento y de la coagulación7,19. En este contexto, la adsorción, basada en la separación de masas por un agente sólido denominado sorbente20, podría ser una interesante estrategia para eliminar PBUTs y moléculas más grandes que el límite impuesto por el «tamaño de la albúmina»7,8,15,21.
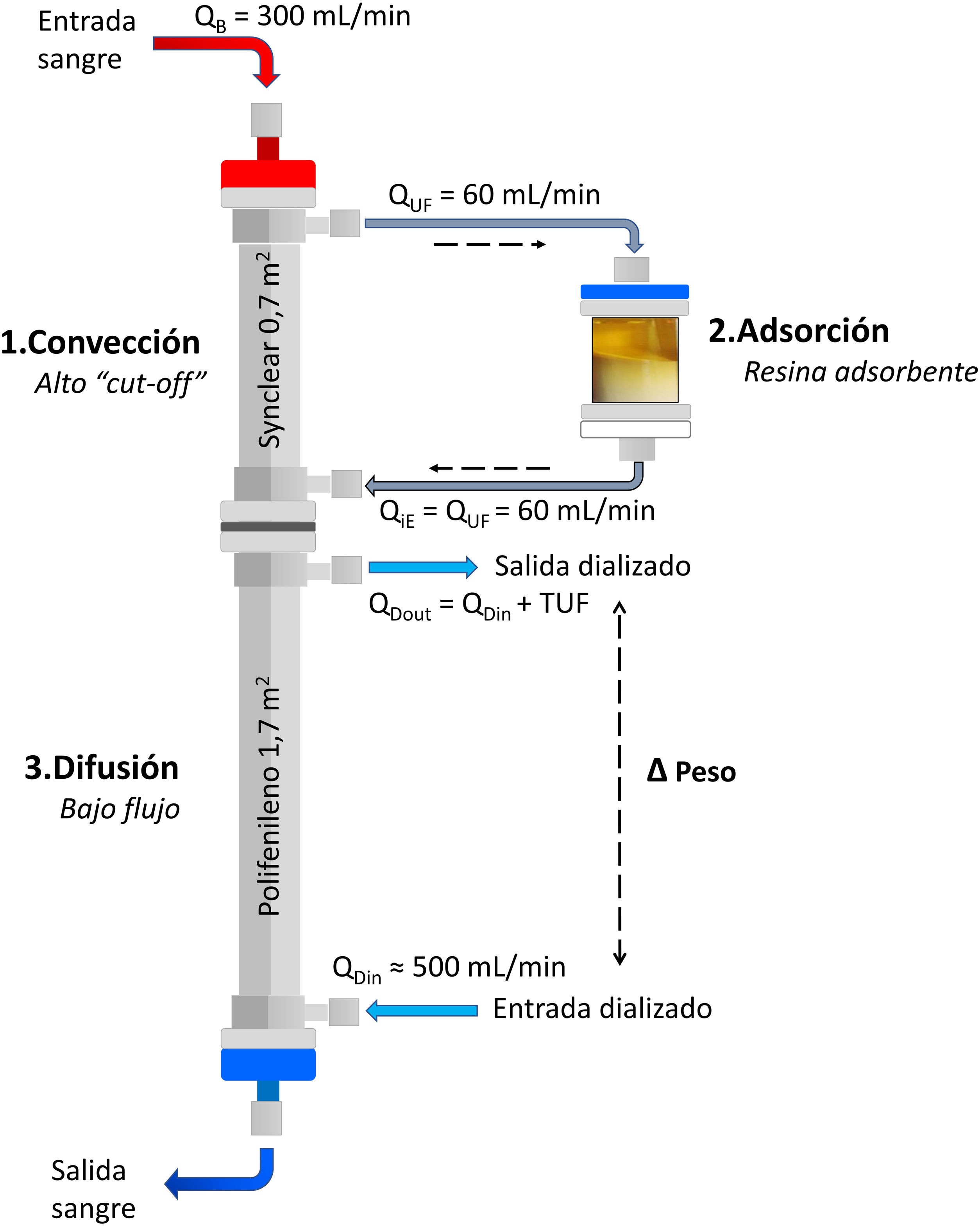
Adsorción: ¿qué técnicas hay disponibles?Más allá de la capacidad de adsorción de algunas membranas como las de polimetilmetacrilato (PMMA)22–24, las dos técnicas propiamente adsortivas disponibles para los pacientes con ERC en HD son la hemoperfusión (HP) y la HDF con regeneración en línea del ultrafiltrado (HFR, Hemo-Filtrate-Reinfusion)7,25,26. Aunque ambas técnicas utilizan un cartucho con un material adsorbente, la HP requiere que el sorbente sea altamente biocompatible, ya que existe un contacto directo del adsorbente con las células sanguíneas, lo que ha limitado históricamente su uso26–28. Por el contrario, la HFR utiliza un dializador con doble cámara más un cartucho adsortivo (fig. 1), donde el propio líquido ultrafiltrado del paciente es regenerado y posteriormente reinfundido a la sangre del paciente, evitando el contacto directo entre las células sanguíneas y el material adsorbente, superando así los problemas de tolerabilidad y coagulación sanguínea observados inicialmente con la HP29.
Esquema de HFR-supra. Adaptado de: Wratten y Ghezzi29 y de Donati et al.30. Δ Peso: balance de peso intradiálisis; QB: flujo de sangre; QDin: flujo de entrada del dializado; QDout: flujo de salida del dializado; QiE: flujo de reinfusión endógena; QUF: flujo del ultrafiltrado (agua plasmática).
La presente revisión tiene como doble objetivo analizar, sintetizar y discutir la evidencia acumulada en los últimos años con el uso de la HFR, y en segundo lugar, como panel de consenso de nefrólogos con experiencia clínica con esta modalidad de diálisis, resumir nuestros puntos de vista acerca del cómo usar esta técnica y para qué perfil de pacientes está especialmente indicada, ofreciendo al clínico una visión práctica a la hora de prescribir y monitorizar esta técnica en su actividad asistencial.
Qué es y cómo funciona la HFRConcepto de HFR: combinando difusión, convección y adsorciónLa HFR es una terapia de reemplazo renal que utiliza un dializador de doble cámara más un cartucho adsortivo, combinando en un solo esquema terapéutico los mecanismos de convección, adsorción y difusión (fig. 1)7. En una primera fase, la sangre pasa por un dializador de muy alta permeabilidad donde es ultrafiltrada mediante un gradiente de presión (fase convectiva), generándose un ultrafiltrado endógeno (o agua plasmática) que luego se regenera al pasar por el cartucho (fase adsortiva) donde un adsorbente (carbón o resina) retiene diferentes toxinas y citoquinas. En esta etapa de convección/adsorción no hay una pérdida neta de fluidos ni de albúmina, siendo el ultrafiltrado limpio reinfundido a la sangre para ser sometido a HD convencional. La regeneración de grandes volúmenes de plasma ultrafiltrado obtenidos en el primer filtro de HFR permite tratar un gran volumen de agua plasmática, y al mismo tiempo, posibilita el retorno de muchas sustancias beneficiosas como hormonas, pequeños péptidos y muchas vitaminas25. La sangre con el ultrafiltrado limpio pasa entonces por un filtro de baja permeabilidad (fase difusiva) que permite la eliminación de pequeñas moléculas, así como la ultrafiltración necesaria para conseguir un adecuado balance hídrico en el paciente30.
Evolución histórica de la HFRLa HFR surgió a partir de la HDF con difusión y convección separadas (PFD, Paired Filtration-Dialysis) que utilizaba un filtro de doble cámara hidráulicamente separadas y de distinta permeabilidad31, al cual se le añadió un cartucho adsorbente de carbón32,33. Desde el primer momento, HFR demostró ser una técnica bien tolerada y altamente biocompatible, con una menor respuesta inflamatoria y con capacidad de depurar medianas moléculas como la β2-microglobulina (β2-m)34,35. El desarrollo de la HFR fue un proceso complejo que sufrió numerosos cambios evolutivos para encontrar un adecuado adsorbente que retuviera una amplia variedad de mediadores y que, al mismo tiempo, fuera apto para el tratamiento extracorpóreo, siendo HFR-supra la versión más eficaz y actual (tabla 1)36–46.
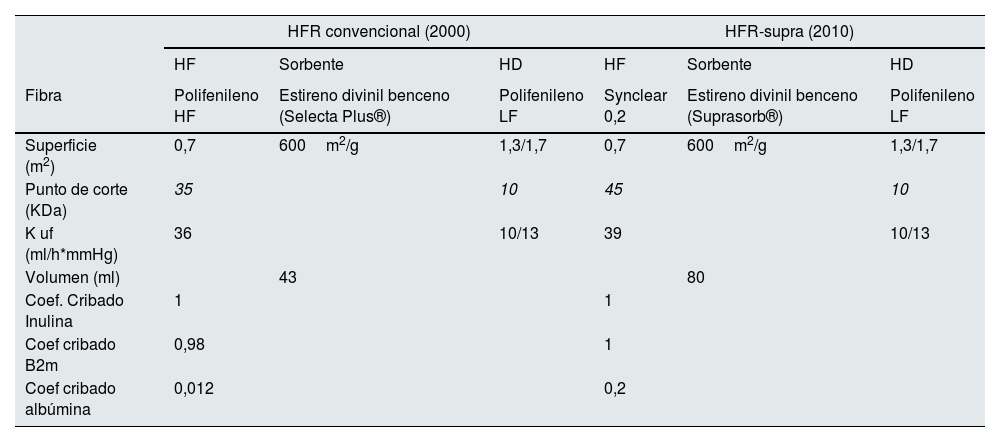
Características y evolución histórica de las distintas modalidades de HFR40
| HFR convencional (2000) | HFR-supra (2010) | |||||
|---|---|---|---|---|---|---|
| HF | Sorbente | HD | HF | Sorbente | HD | |
| Fibra | Polifenileno HF | Estireno divinil benceno (Selecta Plus®) | Polifenileno LF | Synclear 0,2 | Estireno divinil benceno (Suprasorb®) | Polifenileno LF |
| Superficie (m2) | 0,7 | 600m2/g | 1,3/1,7 | 0,7 | 600m2/g | 1,3/1,7 |
| Punto de corte (KDa) | 35 | 10 | 45 | 10 | ||
| K uf (ml/h*mmHg) | 36 | 10/13 | 39 | 10/13 | ||
| Volumen (ml) | 43 | 80 | ||||
| Coef. Cribado Inulina | 1 | 1 | ||||
| Coef cribado B2m | 0,98 | 1 | ||||
| Coef cribado albúmina | 0,012 | 0,2 | ||||
La HFR convencional surgió a partir del año 2000 al sustituir el sorbente exclusivamente de carbón utilizado en la HDF con difusión y convección separadas (PFD, Paired Filtration-Dialysis), por un cartucho con mayor capacidad adsortiva (Selecta Plus®, Bellco). Dicho cartucho contenía dos materiales adsorbentes: partículas esféricas blancas de resina macroporosa e insoluble (20ml) y carbón activado sin recubrimiento (240ml)36. Debido a la naturaleza ultrafiltrada del fluido regenerado, la HFR permitió en su origen el uso de adsorbentes de carbón en una «forma no recubierta», de mayor capacidad adsortiva, superando los problemas de bioincompatibilidad y coagulación sanguínea observados inicialmente con la HP, que precisaba el uso de carbones en forma «recubierta», más biocompatibles, pero con una menor capacidad de adsorción25. La resina, de naturaleza no iónica e hidrofóbica, permitió la adsorción de solutos de mediano y alto peso molecular, incluyendo β2-m, citoquinas proinflamatorias, y productos de glicación avanzada (AGEs, Advanced Glycation End-products); mientras que el carbón era capaz de adsorber creatinina y ácido úrico y otros solutos de bajo peso molecular36–39. Finalmente, desde mediados de 2010 disponemos de una nueva técnica mejorada de HFR, denominada HFR-supra, en la que la membrana convectiva de polifenileno de alto flujo (con un «cut-off» de 35kDa) ha sido sustituida por una membrana de super alto flujo (Synclear 0,2®, Bellco/Medtronic), con un «cut-off» >55kDa y un coeficiente de cribado de albúmina de 0,2 (similar al de los filtros de alto «cut-off»)40, y en la que se utiliza un nuevo cartucho (Suprasorb®, Bellco/Medtronic), que contiene el doble de resina que el cartucho Selecta® utilizado en la HFR convencional41, mejorando aún más la capacidad convectiva y adsortiva de la técnica42–46.
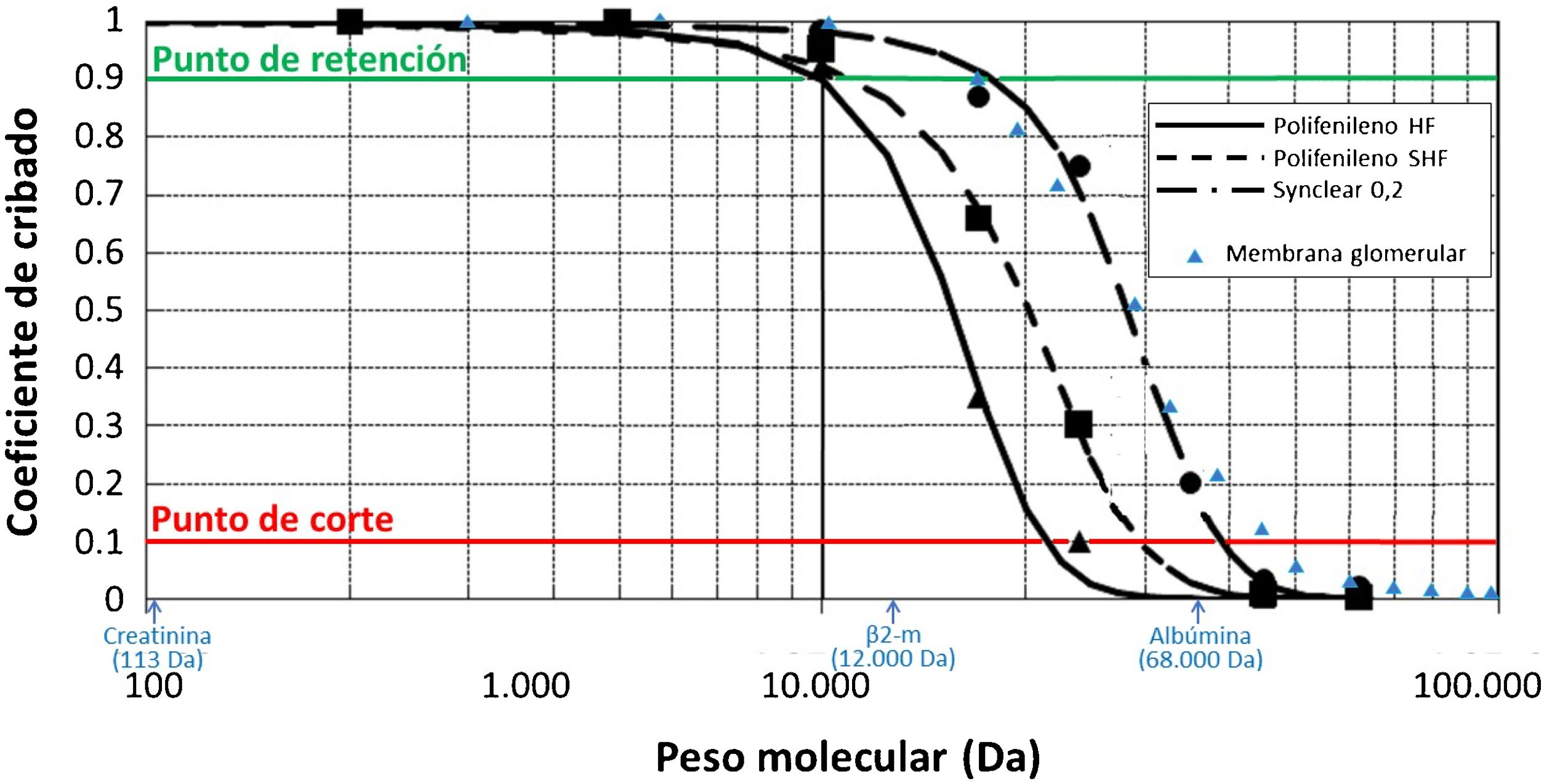
La reinfusión endógena, característica exclusiva de la HFR, ha permitido incrementar progresivamente la permeabilidad de la membrana utilizada en esta primera fase convectiva más allá del límite impuesto para albúmina (tabla 1)22,40,47–49, dado que la resina no adsorbe la albúmina presente en el ultrafiltrado, y será, por tanto, reinfundida en la sangre del paciente (fig. 1). HFR-supra utiliza en esta primera fase convectiva una membrana de 0,7m2 de superficie de superalto flujo (Synclear 0,2®, Bellco/Medtronic), caracterizado por un «cut-off» alto (>55.000Da), muy superior al de las otras membranas de alto flujo habitualmente utilizadas en HDF-OL y con un coeficiente de cribado que se asemeja mucho más al del glomérulo (fig. 2)40. En comparación con la membrana de polifenileno de alto flujo utilizado en HFR tradicional, el ultrafiltrado contiene concentraciones significativamente más elevadas de moléculas de peso medio-alto (que podrán ser posteriormente adsorbidas) como la IL-6 (24.700Da) o la α1-glicoproteína (43.500Da) y, obviamente, albúmina (66.500Da)22,48,49. El ultrafiltrado es conducido desde este hemofiltro a una resina de estireno neutro de 80g con un área de adsorción de 35.000m250.
Representación esquemática de las curvas de cribado de las distintas membranas utilizadas en HFR (Polifenileno HF, Polifenileno SHF, Synclear 0,2). Los puntos de la curva en los que el coeficiente de cribado es de 0,1 y 0,9 para un determinado peso molecular determinan en cada membrana el punto de corte («cut-off») y el punto de retención («retention onset»), respectivamente. Mientras que el punto de corte refleja el peso molecular a partir del cual el 90% de los solutos va a quedar retenido, el punto de retención señala el peso molecular a partir del cual se va a retener más de un 10% de los solutos. Como puede verse en la gráfica, Synclear 0,2 difiere mucho de Polifenileno HF y SHF tanto en su «retention onset» como en su «cut-off». Esto se traduce en un mayor coeficiente de cribado de la membrana Synclair y, por tanto, en un mayor aclaramiento de sustancias de mediano peso molecular y de toxinas ligadas a proteínas, una vez pasen a través de la resina. Adaptado de: Grandi et al.40, Boschetti-de-Fierro et al.98 y de García-Prieto et al.99 Los datos referidos a la membrana glomerular (triángulos en azul) se han añadido para su comparación según los datos recogidos por Axelsson et al.100 β2-m: β2-microglobulina.
El cartucho de la HFR-supra consta de una resina estirénica hidrófoba con unos gránulos o perlas de un diámetro de partícula único de aproximadamente 100μm y poros internos que miden entre 20 y 50Å (macroporos). La naturaleza química de la resina, sumada a su gran superficie adsorbente en relación con su volumen (aproximadamente 700m2/g de resina), le confiere una alta capacidad para adsorber diversas toxinas urémicas en el rango de moléculas de peso molecular medio y alto, incluyendo β2-m, homocisteína, hormona paratiroidea, FGF23 y diversas citoquinas, como IL-6, TNF-alfa y TGF-alfa20,36,41–44,51–53. Pequeñas moléculas como la creatinina y el ácido úrico son también retenidos en el cartucho, mientras que la urea, el fósforo y el potasio son reinfundidos sin cambios en el ultrafiltrado regenerado, siendo posteriormente dializados en el filtro difusivo. De igual modo, el calcio, el bicarbonato, la albúmina y diversos oligoelementos como manganeso, selenio o zinc no se modifican a su paso por la resina25.
La adsorción es un fenómeno fisicoquímico que consiste en la interacción de una molécula con la superficie de la resina mediante atracciones hidrofóbicas, electrostáticas o iónicas54. Aunque ninguna teoría para predecir la adsorción ha sido universalmente aceptada, existen diversos factores que influyen en la capacidad adsortiva de la resina, como la densidad de empaque del adsorbente, la longitud y el diámetro interior del cartucho, o la distancia entre los gránulos, cuya discusión va más allá del alcance de este manuscrito, y que han sido recientemente revisados7,55. Sin embargo, sí es de interés para el clínico entender que la cinética final del transporte adsortivo depende de la concentración inicial del soluto y, especialmente, del flujo del ultrafiltrado (QUF) a través del cartucho. Mientras que algunas moléculas tienen una buena adsorción en un amplio rango de QUF, otras pueden tener una importante disminución en su adsorción a medida que aumenta el QUF a través del cartucho, al disminuir el tiempo de interacción entre la resina y el agua plasmática, y por tanto, la eficacia adsortiva de la técnica55. A fin de optimizar el mecanismo adsortivo, en la HFR-supra se recomienda un QUF de alrededor de 60-70ml/min, lo que se traduce en aproximadamente 14-17l de volumen de reinfusión endógena en una sesión típica de 4h50. El monitor de diálisis Flexya™ (Bellco/Medtronic) que realiza la HFR tiene un programa de software que automáticamente determina el mejor QUF basado inicialmente en la velocidad lineal máxima (el caudal que proporciona la mejor adsorción). El monitor también determina automáticamente el hematocrito del paciente y la presión transmembrana para ajustar el QUF según estos parámetros, de manera que el QUF suele ser mayor al inicio de la sesión de diálisis que al final29,50.
Reinfusión endógena y difusiónDespués de la adsorción, el ultrafiltrado libre de toxinas es reinfundido a la sangre del paciente que, a su vez, pasa por la segunda cámara del filtro, donde tendrá lugar una HD convencional (fig. 1). Se trata de un filtro de 1,7m2 de superficie de polifenileno de bajo flujo (Kuf=13ml/h/mmHg) donde tiene lugar la eliminación de pequeñas moléculas y la corrección de la acidosis metabólica mediante mecanismo difusivo47. Es a este nivel donde además se produce mediante ultrafiltración el balance hídrico neto de la técnica para alcanzar el peso seco objetivo del paciente29,47,50.
Características diferenciales de la HFR respecto a la HDF-OLAunque ambas técnicas combinan la difusión y la convección con el fin de mejorar la depuración de medianas y grandes moléculas, existen destacables diferencias entre ambas técnicas más allá de la capacidad adsortiva asociada a la HFR (tabla 2). En primer lugar, la doble cámara del filtro HFR permite la separación completa de la convección y de la difusión7, de manera que el mismo volumen de ultrafiltrado obtenido en la primera cámara se devuelve como líquido de sustitución al circuito de sangre justo antes de la segunda cámara del filtro, lo que permite un menor consumo de agua de diálisis y un nulo riesgo de retrofiltración25. En segundo lugar, la regeneración del ultrafiltrado tras su paso por el cartucho adsortivo minimiza el riesgo de pérdida de albúmina y otros nutrientes descrita con la HDF-OL56,57. En tercer lugar, en la HFR el volumen de reinfusión que se administra es de unos 15l por sesión50, mientras que en la HDF-OL el objetivo convectivo es de al menos 21-23l por sesión en posdilución58, siendo este último un objetivo poco factible en pacientes con un acceso vascular subóptimo58–60. Por último, mientras que el rendimiento de la HDF-OL se beneficia de un incremento del flujo de infusión (QI) mediante el aumento del QB61, en el caso de la HFR el aumento excesivo del QUF endógeno facilitado por un aumento del QB puede ser contraproducente al disminuir la eficacia adsortiva de la técnica44,55,62,63. En conclusión, la HFR permite una eliminación más adecuada de las moléculas de peso molecular medio que la HDF-OL en pacientes comórbidos con un acceso vascular limitado que no alcanzan un alto volumen convectivo50,59.
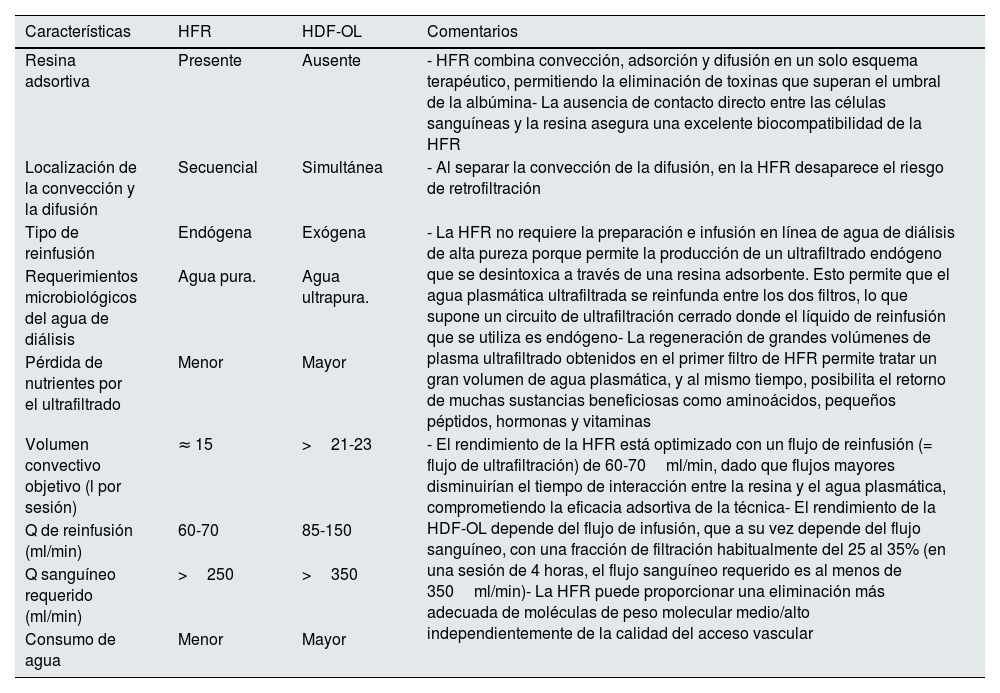
Características diferenciales entre la HFR y la HDF-OL
| Características | HFR | HDF-OL | Comentarios |
|---|---|---|---|
| Resina adsortiva | Presente | Ausente | - HFR combina convección, adsorción y difusión en un solo esquema terapéutico, permitiendo la eliminación de toxinas que superan el umbral de la albúmina- La ausencia de contacto directo entre las células sanguíneas y la resina asegura una excelente biocompatibilidad de la HFR |
| Localización de la convección y la difusión | Secuencial | Simultánea | - Al separar la convección de la difusión, en la HFR desaparece el riesgo de retrofiltración |
| Tipo de reinfusión | Endógena | Exógena | - La HFR no requiere la preparación e infusión en línea de agua de diálisis de alta pureza porque permite la producción de un ultrafiltrado endógeno que se desintoxica a través de una resina adsorbente. Esto permite que el agua plasmática ultrafiltrada se reinfunda entre los dos filtros, lo que supone un circuito de ultrafiltración cerrado donde el líquido de reinfusión que se utiliza es endógeno- La regeneración de grandes volúmenes de plasma ultrafiltrado obtenidos en el primer filtro de HFR permite tratar un gran volumen de agua plasmática, y al mismo tiempo, posibilita el retorno de muchas sustancias beneficiosas como aminoácidos, pequeños péptidos, hormonas y vitaminas |
| Requerimientos microbiológicos del agua de diálisis | Agua pura. | Agua ultrapura. | |
| Pérdida de nutrientes por el ultrafiltrado | Menor | Mayor | |
| Volumen convectivo objetivo (l por sesión) | ≈ 15 | >21-23 | - El rendimiento de la HFR está optimizado con un flujo de reinfusión (= flujo de ultrafiltración) de 60-70ml/min, dado que flujos mayores disminuirían el tiempo de interacción entre la resina y el agua plasmática, comprometiendo la eficacia adsortiva de la técnica- El rendimiento de la HDF-OL depende del flujo de infusión, que a su vez depende del flujo sanguíneo, con una fracción de filtración habitualmente del 25 al 35% (en una sesión de 4 horas, el flujo sanguíneo requerido es al menos de 350ml/min)- La HFR puede proporcionar una eliminación más adecuada de moléculas de peso molecular medio/alto independientemente de la calidad del acceso vascular |
| Q de reinfusión (ml/min) | 60-70 | 85-150 | |
| Q sanguíneo requerido (ml/min) | >250 | >350 | |
| Consumo de agua | Menor | Mayor |
Diferentes estudios han demostrado la capacidad de la HFR para eliminar un amplio espectro de toxinas urémicas, incluidas las PBUTs (tabla 3). Esquivias-Motta et al.45 realizaron un ensayo aleatorizado y cruzado que comparó la HDF-OL y la HFR en 17 pacientes en HD sin inflamación. En un esquema secuencial de HDF-OL y HFR de 8 semanas de duración, se midieron toxinas urémicas y 13 marcadores de inflamación, disfunción endotelial y estrés oxidativo, siendo cada paciente control de sí mismo. La HFR mostró una mayor reducción de indoxil-sulfato (IS) que la HDF-OL. Riccio et al.44 en 12 pacientes inflamados definidos con un nivel de PCR mayor de 3mg/l, mostraron que el cartucho adsorbente retenía pCS un 53% respecto al 35% con HD. En otro estudio realizado en China con 37 pacientes63, una sesión de HFR en pacientes en HDF-OL suponía una reducción media de pCS e IS en un 40,9% y 43,6%, respectivamente. En otros estudios obtienen resultados variables dependiendo del diseño y población incluida50.
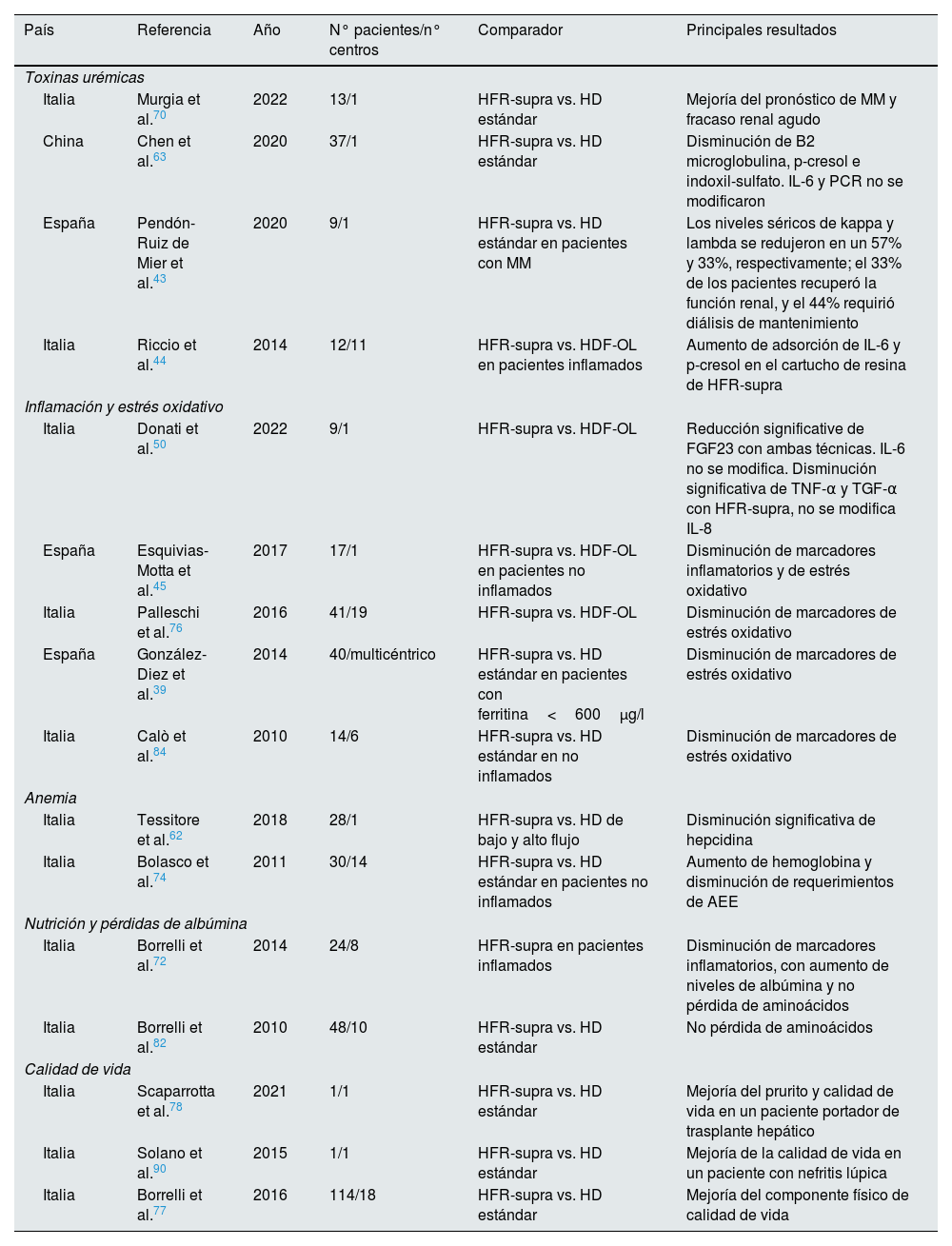
Estudios clínicos con HFR-supra
| País | Referencia | Año | N° pacientes/n° centros | Comparador | Principales resultados |
|---|---|---|---|---|---|
| Toxinas urémicas | |||||
| Italia | Murgia et al.70 | 2022 | 13/1 | HFR-supra vs. HD estándar | Mejoría del pronóstico de MM y fracaso renal agudo |
| China | Chen et al.63 | 2020 | 37/1 | HFR-supra vs. HD estándar | Disminución de B2 microglobulina, p-cresol e indoxil-sulfato. IL-6 y PCR no se modificaron |
| España | Pendón-Ruiz de Mier et al.43 | 2020 | 9/1 | HFR-supra vs. HD estándar en pacientes con MM | Los niveles séricos de kappa y lambda se redujeron en un 57% y 33%, respectivamente; el 33% de los pacientes recuperó la función renal, y el 44% requirió diálisis de mantenimiento |
| Italia | Riccio et al.44 | 2014 | 12/11 | HFR-supra vs. HDF-OL en pacientes inflamados | Aumento de adsorción de IL-6 y p-cresol en el cartucho de resina de HFR-supra |
| Inflamación y estrés oxidativo | |||||
| Italia | Donati et al.50 | 2022 | 9/1 | HFR-supra vs. HDF-OL | Reducción significative de FGF23 con ambas técnicas. IL-6 no se modifica. Disminución significativa de TNF-α y TGF-α con HFR-supra, no se modifica IL-8 |
| España | Esquivias-Motta et al.45 | 2017 | 17/1 | HFR-supra vs. HDF-OL en pacientes no inflamados | Disminución de marcadores inflamatorios y de estrés oxidativo |
| Italia | Palleschi et al.76 | 2016 | 41/19 | HFR-supra vs. HDF-OL | Disminución de marcadores de estrés oxidativo |
| España | González-Diez et al.39 | 2014 | 40/multicéntrico | HFR-supra vs. HD estándar en pacientes con ferritina<600μg/l | Disminución de marcadores de estrés oxidativo |
| Italia | Calò et al.84 | 2010 | 14/6 | HFR-supra vs. HD estándar en no inflamados | Disminución de marcadores de estrés oxidativo |
| Anemia | |||||
| Italia | Tessitore et al.62 | 2018 | 28/1 | HFR-supra vs. HD de bajo y alto flujo | Disminución significativa de hepcidina |
| Italia | Bolasco et al.74 | 2011 | 30/14 | HFR-supra vs. HD estándar en pacientes no inflamados | Aumento de hemoglobina y disminución de requerimientos de AEE |
| Nutrición y pérdidas de albúmina | |||||
| Italia | Borrelli et al.72 | 2014 | 24/8 | HFR-supra en pacientes inflamados | Disminución de marcadores inflamatorios, con aumento de niveles de albúmina y no pérdida de aminoácidos |
| Italia | Borrelli et al.82 | 2010 | 48/10 | HFR-supra vs. HD estándar | No pérdida de aminoácidos |
| Calidad de vida | |||||
| Italia | Scaparrotta et al.78 | 2021 | 1/1 | HFR-supra vs. HD estándar | Mejoría del prurito y calidad de vida en un paciente portador de trasplante hepático |
| Italia | Solano et al.90 | 2015 | 1/1 | HFR-supra vs. HD estándar | Mejoría de la calidad de vida en un paciente con nefritis lúpica |
| Italia | Borrelli et al.77 | 2016 | 114/18 | HFR-supra vs. HD estándar | Mejoría del componente físico de calidad de vida |
Una de las aplicaciones más estudiadas en relación con la HFR es su capacidad de depurar las cadenas ligeras, cuya precipitación a nivel tubular produce daño renal agudo en el mieloma múltiple. Mientras que los actuales tratamientos quimioterápicos disminuyen la producción de las cadenas ligeras, cuya vida media va desde horas a varios días, la eliminación de la circulación de dichas cadenas constituye un tratamiento coadyuvante en estos pacientes. Técnicas como la plasmaféresis o el uso de dializadores de alto «cut-off» (45-60Kd) se han utilizado a lo largo de los últimos años, sin haber demostrado en diferentes ensayos aleatorizados disminuir el daño renal en pacientes con mieloma64–68. Ambas técnicas requieren suplementación de albúmina, y la plasmaféresis se debe asociar además a HD lo que implica un alto coste. En 2010, Testa et al.69 demostraron que la HFR-supra eliminaba cadenas ligeras. En un reciente estudio español43, en 9 pacientes con fracaso renal agudo secundario a mieloma múltiple y tratados con HFR, los niveles séricos de kappa y lambda se redujeron en un 57% y 33%, respectivamente, manteniéndose estables los niveles de albúmina sérica; el 33% de los pacientes recuperó la función renal, el 22% falleció durante el primer año y el 44% requirió diálisis de mantenimiento. En otro estudio italiano que incluyó 13 pacientes con mieloma y fallo renal70, la tasa media de reducción al final del ciclo con HFR-supra fue del 85% para cadenas kappas y del 40% para las lambdas; el 46% de los pacientes mostraron una recuperación parcial de la función renal dentro del tercer mes, permaneciendo en diálisis el 38%. Se desconoce sin embargo el efecto de la HFR en la histología renal, principal parámetro pronóstico en la afectación renal del mieloma71.
Biocompatibilidad: efecto en la inflamación y estrés oxidativoLa HFR es una técnica de diálisis altamente biocompatible que, a pesar de producir una extensa eliminación de toxinas urémicas, minimiza la pérdida de nutrientes y la respuesta inflamatoria durante el tratamiento. El cartucho de resina sintética es capaz de absorber citoquinas y otras toxinas urémicas, mientras que permite pasar nutrientes y antioxidantes, como aminoácidos y vitaminas, con la consiguiente disminución de la inflamación y el estrés oxidativo. Estas características sugieren el uso de HFR en pacientes en HD afectados por inflamación crónica manifiesta e idiopática. Borrelli et al.72 así lo corroboraron en un estudio multicéntrico en 24 pacientes inflamados con niveles de PCR>5mg/dl y albúmina<4mg/dl, que tras 8 meses de tratamiento con HFR mostraron un descenso significativo de PCR del 35%, un aumento del 14% en los niveles de albúmina, y una disminución de citoquinas proinflamatorias como IL-6, IL-1β y TNFα, sin modificaciones en los niveles de aminoácidos ramificados. La capacidad del cartucho HFR para adsorber IL-6 ha sido confirmada por Riccio et al.44, proponiendo esta técnica como una nueva estrategia para disminuir la inflamación sistémica en pacientes dializados. Aunque la mayoría de los estudios realizados han comparado HD de bajo o alto flujo con HFR, hay algunos con HDF-OL. En un ensayo cruzado y aleatorizado, Esquivias-Motta et al.45 demostraron una mayor disminución de los niveles de IL-6 con HFR frente a la HDF-OL. En un estudio realizado en China en 37 pacientes en HDF-OL, se observó, tras una única sesión de HFR, una disminución de TNF-α del 28,1%, mientras que las concentraciones de IL-6 y PCR se mantuvieron sin cambios63. En relación con el estado inflamatorio de los pacientes en HD, la respuesta al tratamiento de la anemia con agentes eritropoyéticos (AAEE) y ferroterapia ha sido también explorada con HFR, donde su efecto sobre la hepcidina parece tener un papel crucial73. Aunque la hepcidina tiene un bajo PM de 2,8kD y se puede eliminar fácilmente mediante HD convencional, algunos estudios pequeños muestran una mayor disminución de hepcidina con HFR respecto a la HD, con un descenso en los requerimientos de AAEE62,74.
Más allá de su efecto favorable sobre el estado inflamatorio de los pacientes en HD, diferentes trabajos avalan la capacidad antioxidante de la HFR, al objetivar una disminución leve de parámetros de estrés oxidativo como los niveles de LDL-oxidada, superóxido bismutasa, catalasa, glutatión peroxidasa, y hemoperoxidasa con HFR. González-Diez et al.39 realizaron un estudio multicéntrico para valorar parámetros de estrés oxidativo en 40 pacientes con ferritina menor de 600μg/l y diuresis residual<300ml/día, disminuyendo significativamente los niveles de capacidad antioxidante total y peróxido bismutasa tras 12 meses en HFR. La superioridad respecto a la HDF-OL también ha sido probada en algunos trabajos, donde se objetiva una disminución significativa de la mayoría de los parámetros inflamatorios y de estrés oxidativo45. En conclusión, el cambio de HD a HFR en la mayoría de los estudios publicados (tabla 3) permitió una mejoría de la inflamación con una disminución significativa de los niveles séricos de PCR, IL-6, IL-1 y TNF y un aumento significativo de albúmina y prealbúmina. Si estos efectos favorables pueden modificar los resultados clínicos de estos pacientes de alto riesgo, debe ser confirmado por estudios ad-hoc bien diseñados, diferenciando pacientes inflamados de los que no están y comparando HFR con HDF-OL.
Estado nutricionalLa HFR, a pesar de aumentar la eliminación de toxinas urémicas y marcadores inflamatorios, minimiza la pérdida de nutrientes como aminoácidos y vitaminas respecto a la HD de alto flujo y la HDF-OL, que asocian una pérdida de aminoácidos de 4-5g/por sesión75. Se ha comprobado en pequeños estudios que la eliminación de aminoácidos tanto esenciales como ramificados es menor con HFR que con HDF libre de acetato, probablemente por la ausencia de adsorción de aminoácidos por el cartucho y por la reinfusión endógena del plasma67. En otro pequeño estudio aleatorizado se objetivó una menor pérdida de vitamina C en 41 pacientes que utilizaron la técnica de HFR76, mientras que varios estudios han demostrado una menor pérdida de albúmina asociada a la HFR en comparación con HDF-OL44,45,63. La menor pérdida de aminoácidos, vitaminas y albúmina postula a la HFR como una técnica de gran utilizad en pacientes malnutridos y con requerimientos de suplementos nutricionales.
Calidad de vida y supervivenciaAunque positiva, la evidencia sobre el efecto beneficioso de la HFR en la calidad de vida es únicamente observacional. En un estudio transversal italiano que incluyó 114 pacientes de 18 hospitales, se comparó la calidad de vida de 57 pacientes en diálisis convencional y 57 en HFR, sin diferencias basales en cuanto a edad, permanencia en diálisis, comorbilidad y capacidad funcional estimada mediante el índice de Barthel77. Los pacientes tratados por HFR mostraron mejor puntuación del componente físico del SF-36 y particularmente en los componentes de funcionamiento físico y actividades diarias, mientras que no existieron diferencias en la puntuación del componente mental. En otro pequeño estudio se sugiere que la HFR podría aliviar el prurito asociado a la ERC78, síntoma que incide de una manera negativa en la calidad de vida79. Carecemos de estudios que hayan comparado de manera específica la mortalidad asociada a la HFR respecto a otras modalidades de HD80, por lo que todavía se desconoce si los beneficios anteriormente comentados de la técnica sobre el estado inflamatorio y nutricional de los pacientes se pueden traducir en una mayor supervivencia.
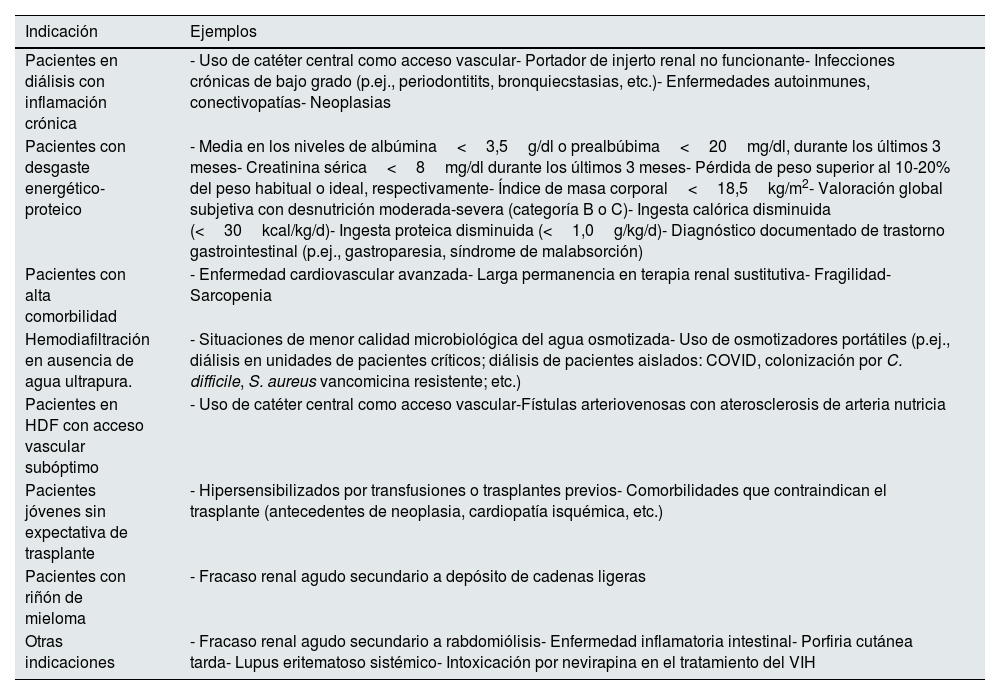
Consideraciones prácticas para la HFRA quién prescribir HFR: indicaciones y objetivos clínicosSi bien podemos indicar la HFR en cualquier tipo de pacientes, al ser considerada una técnica superior en biocompatibilidad, depuración de toxinas urémicas y preservación del estado nutricional, hay circunstancias concretas y pacientes con necesidades específicas en los que esta técnica estaría especialmente indicada y que deben tenerse en cuenta a fin de prescribir una terapia de diálisis lo más individualizada posible centrada en el paciente (tabla 4).
- -
Pacientes en diálisis con inflamación crónica. La HFR permite paliar el estado inflamatorio crónico y por ende sus consecuencias, siendo especialmente útil en pacientes, con catéteres centrales de hemodiálisis, portadores de injertos renales no funcionantes, con procesos infecciosos crónicos de bajo grado (dentarios u otros), neoplasias, etc.45,81.
- -
Pacientes en diálisis crónica con desgaste proteico-energético (DPE). Además del beneficio indirecto en el estado nutricional por mejoría del entorno inflamatorio, una menor pérdida de componentes fisiológicos como vitaminas, Aas, albúmina, etc., de la HFR frente a otras técnicas de diálisis29,76,82, garantiza una mejor preservación del estado nutricional de los pacientes respecto a otras técnicas de diálisis. En este escenario, la HFR se contemplaría como la técnica de diálisis óptima para pacientes en riesgo de desnutrición o desnutridos, sobre todo si están recibiendo nutrición parenteral intradiálisis (NPID) por la menor pérdida de los nutrientes administrados (reinfusión endógena del ultrafiltrado), como sí ocurre en otras técnicas conectivas de diálisis83.
- -
Pacientes con alta comorbilidad. Son candidatos a esta técnica pacientes frágiles, con enfermedad cardiovascular avanzada, etc., que precisan mejorar la capacidad funcional y disminuir la progresión acelerada de la ateroesclerosis, la cardiopatía o la sarcopenia29,84,85, todo ello con el doble objetivo de mejorar la supervivencia con la mejor calidad de vida posible.
- -
Pacientes en HDF sin disposición de agua ultrapura o con acceso vascular subóptimo. Tal y como hemos descrito previamente, la HFR es la única técnica de HDF disponible en situaciones de menor calidad microbiológica del agua de diálisis, en pacientes cuyo acceso vascular solo permite alcanzar un Qb de 250-300ml/min (p.ej., pacientes portadores de catéter venoso central)50,59.
- -
Pacientes jóvenes sin expectativa de trasplante. Incluiría pacientes con alta tasa de sensibilización por trasplantes previos, antecedentes de neoplasia, cardiopatía isquémica, etc., que hacen poco probable su inclusión a corto plazo en programa de trasplante.
- -
Pacientes con riñón de mieloma y fracaso renal agudo. La HFR permite eliminar cadenas ligeras libres con alta eficacia sin las pérdidas mencionadas de albúmina observada con las técnicas tradicionales, a menor costo y con buenos resultados41,43,86,87.
- -
Uso puntual en otros procesos clínicos. Se han reportado en la literatura casos en los que la HFR podría ser útil en diferentes situaciones, incluyendo la eliminación de mioglobina en el fracaso renal agudo secundario a rabdomiólisis30, la enfermedad inflamatoria intestinal88, la porfiria cutánea tarda89, la emisión clínico-analítica en paciente con lupus90, o la intoxicación por nevirapina en el tratamiento del VIH91.
Circunstancias especialmente indicadas para la HFR
| Indicación | Ejemplos |
|---|---|
| Pacientes en diálisis con inflamación crónica | - Uso de catéter central como acceso vascular- Portador de injerto renal no funcionante- Infecciones crónicas de bajo grado (p.ej., periodontitits, bronquiecstasias, etc.)- Enfermedades autoinmunes, conectivopatías- Neoplasias |
| Pacientes con desgaste energético-proteico | - Media en los niveles de albúmina<3,5g/dl o prealbúbima<20mg/dl, durante los últimos 3 meses- Creatinina sérica<8mg/dl durante los últimos 3 meses- Pérdida de peso superior al 10-20% del peso habitual o ideal, respectivamente- Índice de masa corporal<18,5kg/m2- Valoración global subjetiva con desnutrición moderada-severa (categoría B o C)- Ingesta calórica disminuida (<30kcal/kg/d)- Ingesta proteica disminuida (<1,0g/kg/d)- Diagnóstico documentado de trastorno gastrointestinal (p.ej., gastroparesia, síndrome de malabsorción) |
| Pacientes con alta comorbilidad | - Enfermedad cardiovascular avanzada- Larga permanencia en terapia renal sustitutiva- Fragilidad- Sarcopenia |
| Hemodiafiltración en ausencia de agua ultrapura. | - Situaciones de menor calidad microbiológica del agua osmotizada- Uso de osmotizadores portátiles (p.ej., diálisis en unidades de pacientes críticos; diálisis de pacientes aislados: COVID, colonización por C. difficile, S. aureus vancomicina resistente; etc.) |
| Pacientes en HDF con acceso vascular subóptimo | - Uso de catéter central como acceso vascular-Fístulas arteriovenosas con aterosclerosis de arteria nutricia |
| Pacientes jóvenes sin expectativa de trasplante | - Hipersensibilizados por transfusiones o trasplantes previos- Comorbilidades que contraindican el trasplante (antecedentes de neoplasia, cardiopatía isquémica, etc.) |
| Pacientes con riñón de mieloma | - Fracaso renal agudo secundario a depósito de cadenas ligeras |
| Otras indicaciones | - Fracaso renal agudo secundario a rabdomiólisis- Enfermedad inflamatoria intestinal- Porfiria cutánea tarda- Lupus eritematoso sistémico- Intoxicación por nevirapina en el tratamiento del VIH |
Tras seleccionar la modalidad de HFR a utilizar (siendo HFR-supra de elección por su mayor permeabilidad del filtro convectivo y su mayor cantidad de resina adsorbente), debemos establecer los parámetros habituales del monitor:
- ∘
Qb: 300-350ml/min, para un flujo máximo de ultrafiltrado de 70ml/min, que permita un tiempo suficiente de contacto del ultrafiltrado con el sorbente para adecuar la capacidad adsortiva de la técnica.
- ∘
Qd: 500ml/min.
- ∘
Baño de diálisis y heparinización según características del paciente.
- ∘
Tiempo recomendado: mínimo de 4h a fin de optimizar el tratamiento.
La HFR no precisa de ninguna monitorización especial fuera de la práctica clínica habitual. El éxito clínico con HFR vendrá dado por la mejoría y/o normalización de los parámetros clínico-analíticos, los beneficios en la tolerancia del procedimiento, en la calidad de vida y en la morbimortalidad del paciente previamente comentados77,78.
Ajuste de medicación en HFR-supraAunque no existen datos específicos en la literatura, es muy probable que la HFR precise de un ajuste de dosis de numerosos fármacos, tal y como ocurre con otras técnicas convectivas y adsortivas92,93. En pacientes críticos, han descrito una alta adsorción de piperacilina y vancomicina mediante adsorción por filtración de plasma acoplado, un tipo de terapia continua de reemplazo renal que utiliza el mismo sorbente que la HFR con un volumen de 140ml92. Aquellos fármacos dentro del rango de peso molecular medio, con baja unión a proteínas y con carga neutra o positiva son en los que especialmente se puede observar una mayor depuración durante las técnicas convectivas en comparación con la HD convencional93. A la espera de estudios que analicen el efecto de la HFR sobre antibióticos y otros fármacos, un enfoque práctico es administrar dichos fármacos después del tratamiento de diálisis y realizar monitorizaciones plasmáticas periódicas94.
Barreras potenciales para la HFR. Consideraciones económicasEl uso de HFR, al utilizar una resina con capacidad adsortiva, está asociado a un mayor coste, siendo esta la principal barrera que ha tenido históricamente esta técnica para generalizar su uso. Sin embargo, incluso considerando los costos más elevados de la HFR frente a HDF-OL (unos 50€/sesión vs. 25€/sesión, respectivamente)50, debe subrayarse que la HFR permite ofrecer ventajas tanto económicas (menor consumo de agua, ausencia de necesidad –aunque recomendable– de agua ultrapura) como clínicas. Como hemos comentado previamente, varios ensayos clínicos a pequeña escala han demostrado que la HFR puede eliminar más eficazmente moléculas de tamaño mediano y grande, así como PBUTs, respecto a las técnicas de diálisis actuales, incluyendo la HDF-OL, con mayor biocompatibilidad y sin necesidad de un óptimo acceso vascular. Tenemos también evidencia observacional de que, en comparación con la HD estándar, la HFR podría reducir la incidencia de eventos cardiovasculares, mejorar la supervivencia y la calidad de vida. Todos estos efectos podrían suponer un aumento potencial en los años de vida ajustados a la calidad para los pacientes que reciben HFR en comparación con otras técnicas de diálisis, que serían suficientes para justificar el costo adicional, tal y como ha sido descrito con otras técnicas adsortivas95.
Orientación para futuras investigacionesA pesar de las potenciales ventajas de la HFR sobre la HD de alto flujo y la HDF-OL con alto transporte convectivo, esta técnica podría beneficiarse de mejoras en el diseño de los prototipos actualmente disponibles. Una de las limitaciones de la HFR es el escaso efecto sinérgico entre las fases adsortiva y difusiva que tiene la técnica para la eliminación de algunas toxinas. Así, por ejemplo, la depuración de medianas y grandes moléculas como la β2-m (11.800Da), la mioglobina (17.200Da) o las cadenas ligeras kappa (22.500Da) y lambda (45.000Da) se produce exclusivamente mediante adsorción, dado que la baja permeabilidad de la membrana empleada durante la fase difusiva previene su eliminación a este nivel63. Para incrementar la capacidad depurativa de la HFR, el primer escalón ha sido sustituir esta membrana difusiva de baja por una de alta permeabilidad, dando lugar a la denominada HFR de alto flujo (HFR-H)46. Los resultados preliminares disponibles obtenidos con este cambio, pendientes de su publicación definitiva, son muy interesantes ya que permiten incrementar la eliminación de toxinas urémicas de mediano y alto peso molecular, con una mejoría de otros parámetros biológicos relacionados con la inflamación, el estrés oxidativo y la senescencia. Otra posibilidad sería sustituir el filtro difusivo por una membrana de medio «cut-off» o incluso realizar modificaciones en el monitor de diálisis que permitiesen la realización de una HDF-OL, aunque esta variante podría resultar técnicamente más compleja. Por último, la optimización de la resina podría ser una alternativa muy interesante para mejorar aún más los resultados obtenidos con la HFR. Además del efecto adsortivo que tiene el carbón activado para la depuración de las PBUTs y que ha sido recientemente detallado96, trabajos basados en la nanotecnología demuestran como las estructuras metal-orgánicas (MOFs, Metal-Organic Frameworks) pueden ser potencialmente aplicadas también en la depuración por adsorción. Los MOFs son polímeros constituidos por ligandos orgánicos polidentados unidos a iones metálicos que forman redes altamente porosas. En un trabajo reciente, se ha descrito como uno de estos MOFs, el nanoZIF-8, consigue una alta eliminación de pCS e IS97. Estos prometedores resultados abren la puerta al desarrollo en un futuro próximo de nuevos métodos adsortivos para el sistema de la HFR. Por último, son necesarios estudios prospectivos, controlados y aleatorizados, con un adecuado número de pacientes seguidos a largo plazo, que establezcan la potencial ventaja de la HFR-supra sobre las otras modalidades de diálisis en lo que respecta a mortalidad, tasa de hospitalización, comorbilidad y calidad de vida.
ConclusionesEn los últimos años, paralelamente al aumento de los beneficios clínicos y de supervivencia que hemos obtenido con el uso generalizado de la HDF-OL respecto a la HD convencional, también hemos asistido a un cambio en el perfil de los pacientes en diálisis que son cada vez más mayores y con más comorbilidades, y continúan teniendo problemas asociados con la inflamación, el estrés oxidativo y el exceso de morbimortalidad cardiovascular. Ante esta situación, las terapias de reemplazo renal deben aspirar a ofrecer un tratamiento que no solo esté dirigido a prolongar la supervivencia, sino más bien a mejorar la calidad de vida. En este contexto, la HFR representa una respuesta biotecnológica que ofrece un compromiso entre la optimización de la eliminación de toxinas y la eventual pérdida de sustancias fisiológicas beneficiosas. En resumen, la HFR es un procedimiento altamente biocompatible, con buena tolerancia clínica y estabilidad cardiovascular, en el que la convección se separa de la difusión, lo que elimina el riesgo potencial de retrofiltración. La regeneración de altos volúmenes de ultrafiltrado de plasma mediante una resina adsortiva permite la eliminación de manera efectiva de toxinas urémicas de tamaño molecular medio y PBUTs, sin pérdida de albúmina y otras sustancias beneficiosas, evitando los riesgos asociados con la infusión de fluidos exógenos y la necesidad de un óptimo acceso vascular. Además de su facilidad de uso, la HFR se asocia a una disminución de la inflamación y del estrés oxidativo, con potenciales ventajas para pacientes frágiles y con altos niveles de comorbilidad. A pesar de estos datos alentadores, son necesarios estudios adicionales a largo plazo que confirmen estos hallazgos y permitan posicionar adecuadamente el papel de la HFR dentro de las técnicas de reemplazo renal actualmente disponibles para los pacientes en diálisis.
- •
La HFR es una técnica de diálisis caracterizada por un cartucho de resina con poder adsorbente que combina los mecanismos de difusión, convección y adsorción en un solo esquema terapéutico.
- •
La regeneración de altos volúmenes de ultrafiltrado de plasma mediante una resina adsortiva permite la eliminación de manera efectiva de toxinas urémicas de tamaño molecular medio y PBUTs, sin pérdida de albúmina y otras sustancias beneficiosas, evitando los riesgos asociados con la infusión de fluidos exógenos y la necesidad de un óptimo acceso vascular.
- •
El uso de HFR se asocia a una disminución de la inflamación y del estrés oxidativo respecto a la HD convencional y la HDF en línea.
- •
La HFR es un procedimiento altamente biocompatible, con buena tolerancia clínica y hemodinámica, siendo una técnica especialmente indicada para pacientes de elevada comorbilidad cardiovascular, frágiles o desnutridos.
Pablo Molina: honorarios por conferencias de Abbott, Baxter, Fresenius-Kabi, Palex y Vifor Pharma; consultorías de Baxter, Fresenius-Kabi, Palex y Vifor Pharma, así como becas de viaje de Palex y Vifor Pharma.
Marian Goicoechea: honorarios por asesoría o ponencia de Medtronic, Astra-Zeneca, Vifor-CSL y Astellas
Emma Huarte: honorarios por conferencias de Abbott, Baxter, Astra-Zeneca.
Francisco Maduell: honorarios por asesoría o ponencia de Amgen, Baxter, Fresenius Medical Care, Medtronic, Nipro y Vifor.
Alejandro Valero: sin conflictos de interés.
Alejandro Martín Malo: ha recibido honorarios como consultor o ponente de Astellas, Astra-Zeneca, Diaverum, Medtronic y Vifor-Pharma
Los autores queremos dar las gracias al personal de enfermería de todas nuestras Unidades de Diálisis por su impagable dedicación a los pacientes en terapia renal sustitutiva. Los autores también agradecen a D. Federico García Lorente y a D. Riccardo Barini su ayuda en la redacción del artículo.