La preeclampsia (PE) es un trastorno hipertensivo del embarazo asociado a una elevada morbimortalidad materna y fetal, y un mayor riesgo futuro de complicaciones cardiovasculares.
ObjetivoAnalizar si las mujeres que han tenido PE grave en su embarazo presentan parámetros de rigidez arterial (RA) superiores a las de aquellas cuya PE cursó sin signos de gravedad.
MétodosSe evaluaron 65 mujeres que habían desarrollado PE durante su gestación, divididas en 2 grupos: grupo de PE sin criterios de gravedad o PE no grave (n=30) y grupo de PE con criterios de gravedad o PE grave (n=35). Se determinó la velocidad de onda de pulso carótida-femoral (VOPcf), el índice de aumento central normalizado a 75 latidos por minuto (IAc75) y presión de aumento central (PAc) al mes y a los 6 meses posparto. La comparación de proporciones se llevó a cabo mediante la prueba de Chi-cuadrado, la comparación de medias entre grupos se utilizaron la prueba t de Student o la prueba de Mann-Whitney, y la comparación de medias de un mismo grupo en momentos evolutivos diferentes, la prueba t para o el test de Wilcoxon. La correlación, con y entre parámetros hemodinámicos, se llevó a cabo con el coeficiente de correlación de Spearman y la asociación entre variables demográficas, antecedentes personales y parámetros hemodinámicos, y valores alterados de RA se llevó a cabo mediante modelos de regresión lineal y logística.
ResultadosLas mujeres con PE grave presentaban, al mes y a los 6 meses posparto, valores de presión arterial, tanto central como periférica, así como parámetros de RA y amplificación de pulso, superiores a aquellas mujeres cuya PE no revistió gravedad. Los valores del índice de aumento central (IAc) al mes y a los 6 meses posparto fueron superiores, aunque no de forma significativa, en el grupo de PE grave respecto al grupo de PE no grave (24,0 [16,5-34,3] vs. 19,0% [14-29] y 24,0 [14,0-30,0] vs. 20,0% [12,3-26,8], respectivamente). La velocidad onda de pulso carótida-femoral (VOPcf) fue superior de forma significativa, tanto al mes como a los 6 meses posparto en el grupo de PE grave respecto al grupo de PE no grave (10,2 [8,8-10,7] vs. 8,8m/s [8,3-9,6] y 10,0 [8,8-10,6] vs. 8,8m/s [8,3-9,3], respectivamente). La amplificación de la presión sistólica central y de la presión de pulso central fueron también superiores, aunque no de forma significativa, en el grupo de PE grave respecto al de PE no grave.
ConclusiónLas mujeres que han tenido PE grave presentan parámetros de RA más acusados que los de aquellas en las que la PE no revistió especial gravedad. Debiera evaluarse la conveniencia de incluir de forma rutinaria entre las mujeres que han tenido PE la determinación del IAc y especialmente la VOPcf, como estrategia de evaluación del riesgo cardiovascular.
Preeclampsia (PE) is a hypertensive disorder of pregnancy associated with high maternal and fetal morbidity and mortality and increased future risk of cardiovascular complications.
ObjectiveTo analyze whether women who have had PE with severe features in their pregnancy have higher arterial stiffness (AS) parameters than those whose PE course was without signs of severity.
MethodsSixty-five women who developed PE during their gestation were evaluated, divided into two groups: PE group without severe features or non-severe PE (n=30) and PE group with severe features or severe PE (n=35). Carotid-femoral pulse wave velocity (cfPWV), central augmentation index corrected to a heart rate of 75 beats per minute (AIxc75) and central augmentation pressure (cAP) were determined one month and six months postpartum. Comparison of proportions was carried out using the chi-square test, comparison of means between groups using the Student's t-test or the Mann-Whitney test, and comparison of means of the same group at different evolutionary moments, using the t-test or the Wilcoxon test. Correlation, with and between hemodynamic parameters, was carried out with Spearman's correlation coefficient and the association between demographic variables, personal history and hemodynamic parameters, and altered arterial stiffness parameters was carried out using linear and logistic regression models.
ResultsWomen with severe PE presented, both at 1 and 6 months postpartum, higher values of blood pressure, both central and peripheral, as well as AR and pulse amplification parameters, than those women whose PE was not severe. Central augmentation index (cAIx) values at 1 month and 6 months postpartum were higher, although not significantly, in the severe PE group compared to the non-severe PE group (24.0 (16.5-34.3) vs. 19.0% (14-29) and 24.0 (14.0-30.0) vs. 20.0% (12.3-26.8), respectively). Carotid-femoral pulse wave velocity (cfPWV) was significantly higher at both 1 and 6 months postpartum in the severe PE group compared to the non-severe PE group (10.2 (8.8-10.7) vs. 8.8m/s (8.3-9.6) and 10.0 (8.8-10.6) vs. 8.8m/s (8.3-9.3), respectively). Central systolic pressure and central pulse pressure amplification were also higher, although not significantly, in the severe PE group in comparison with the non-severe PE group.
ConclusionsWomen who have had severe PE have more pronounced arterial stiffness parameters than those in whom PE was not particularly severe. The determination of cAIx and cfPWV, as a strategy for the assessment of cardiovascular risk, should be evaluated among women who have had PE.
La preeclampsia (PE) es un trastorno hipertensivo del embarazo asociado a una elevada morbimortalidad materna y fetal. En su etiología de carácter multifactorial, se distinguen factores placentarios asociados a disminución de la perfusión placentaria, y factores clínicos de riesgo materno, tales como hipertensión arterial (HTA), edad, obesidad, diabetes mellitus (DM) o trombofilia1,2. El eslabón entre la hipoxia placentaria relativa y el síndrome clínico materno incluye una cascada de mecanismos secundarios entre los que se encuentra un desequilibrio entre factores pro-angiogénicos y anti-angiogénicos, estrés oxidativo materno y disfunción endotelial e inmunológica, que serían los responsables de una disfunción endotelial generalizada determinante de rigidez arterial (RA), y cuyo desarrollo se encuentra asociado al daño cardiovascular (CV)3.
En los últimos años se han desarrollado nuevas técnicas no invasivas de evaluación de la función endotelial en los vasos periféricos, entre las que destaca la velocidad de onda de pulso (VOP), como marcador de RA y la valoración clínica de la función endotelial4.
La RA constituye un predictor independiente de morbimortalidad, y su incremento, asociado fundamentalmente a la edad, el género y la presión arterial (PA), se vincula con el desarrollo de enfermedad cardiovascular (ECV) y la mortalidad por todas las causas, con independencia de la presencia de otros factores de riesgo de cardiovascular (RCV)5. Por ello, su detección precoz puede tener un papel importante en la prevención de este tipo de enfermedades.
La PA se mide de manera convencional sobre la arteria braquial, y constituye el estándar de referencia para el diagnóstico y manejo de la hipertensión. Sus parámetros son potentes predictores del daño estructural CV, la morbilidad y la mortalidad. Sin embargo, los fenómenos de amplificación y reflexión de la onda de pulso que se producen a lo largo del árbol arterial, determinan que la PA central (PAc), más representativa de la carga ejercida sobre los órganos principales como el corazón el cerebro y los riñones, difiera sustancialmente de la presión arterial periférica (PAp)6 y, aunque las vigentes directrices europeas para el manejo de la HTA cuestionan el valor pronóstico de la determinación de la PAc en la práctica clínica7, diversos estudios señalan la relevancia y superioridad de la PAc respecto de la PAp en la evaluación del riesgo, la predicción de daño de órganos diana, eventos CV adversos y mortalidad8–11. De otro lado, se ha sugerido que la evaluación de PAc puede mejorar las decisiones terapéuticas ya que determinados fármacos antihipertensivos pueden tener efectos sustancialmente distintos sobre la PAc a pesar de mostrar efectos similares sobre la PAp6.
Diversos parámetros hemodinámicos se encuentran asociados a la RA. Entre ellos, los más estudiados, son el índice de aumento (IA) y la VOP. El valor de IA depende de la RA y está influenciado por los reflejos de onda que se producen a lo largo del árbol arterial, y aunque resulte técnicamente más fácil de medir que la VOP y se encuentre relacionado con factores de RCV, enfermedad arterial coronaria y muerte por ECV12, su dependencia con la edad13 y la posibilidad de verse afectado por determinados tratamientos antihipertensivos6, hace que sea considerado un marcador indirecto de la RA, no intercambiable con la VOP14. En cuanto a la VOP, su medida constituye un procedimiento no invasivo, inocuo, de corta duración y sencillo de realizar en la práctica asistencial. Dada su fiabilidad y la gran cantidad de evidencias que demuestran su asociación con la ECV, independientemente de los factores de riesgo existentes, la VOP carótida-femoral (VOPcf), constituye el estándar de oro para la cuantificación de la RA, siendo considerada como uno de los marcadores de daño orgánico con mayor valor predictivo CV, mayor reproducibilidad y aceptable relación costo-efectividad7,15.
Las cifras de normalidad de la PAp se encuentran bien definidas a nivel europeo7 y, aunque si bien existen trabajos que proponen valores normales y rangos de referencia para diversos parámetros de PAc, RA y amplificación de onda de pulso13,16–20, la heterogeneidad de las poblaciones analizadas y la ausencia de una metodología estandarizada para su evaluación, dificultan, en general, la implementación de su uso en la práctica clínica.
Nuestro objetivo es analizar si las mujeres que han tenido PE grave en su embarazo presentan parámetros de RA superiores a las de aquellas cuya PE cursó sin signos de gravedad.
Material y métodosPoblación de estudioEstudio prospectivo llevado a cabo sobre 65 mujeres consecutivas remitidas desde la Unidad de Patología Gravídica de Servicio de Ginecología y Obstetricia al Servicio de Nefrología del Hospital Universitario Marqués de Valdecilla entre el 01/01/2021 y 30/06/2021, por desarrollo de PE durante su gestación.
Según la gravedad de la PE, la cohorte se dividió en 2 grupos, grupo de PE sin criterios de gravedad o PE no grave (n=30) y grupo de PE con presencia de criterios de gravedad o PE grave (n=35). El diagnóstico y la clasificación de la PE según su gravedad se estableció con arreglo a los criterios de The American College of Obstetricians and Gynecologists (ACOG)21. La PE de inicio temprano se definió como un diagnóstico de PE antes de las 34 semanas de gestación22. Parámetros demográficos, factores de RCV, antecedentes obstétricos y datos de la gestación fueron recabados mediante entrevista personal con la paciente y cotejados con su historia clínica. El estudio fue realizado siguiendo las reglas de la Declaración de Helsinki y aprobado por el Comité de Ética de Investigación Clínica de nuestra institución (número de referencia: 2018.170). Todas las participantes dieron su consentimiento informado.
Determinaciones analíticasSe recabaron de la historia clínica de la paciente los valores de creatinina sérica y proteinuria en el momento del diagnóstico de la PE.
Determinaciones hemodinámicasLos parámetros hemodinámicos periféricos y centrales se determinaron por un mismo observador debidamente entrenado, de forma no invasiva, mediante un dispositivo automatizado SphygmoCor® XCEL (AtCor Medical Pty. Ltd., Sydney Australia). La presión arterial sistólica periférica (PASp) y la presión arterial diastólica periférica (PADp), se registró con un manguito braquial de tamaño adecuado, colocado en el brazo dominante, con la paciente sentada y con la espalda y el brazo apoyados sobre una superficie rígida tras un período de descanso de al menos 5min. Se efectuaron 3 mediciones, desechándose la primera y promediándose las 2 últimas. La presión de pulso periférica (PPp) se definió como (PPp=PASp-PADp). Para la determinación de la presión arterial media periférica (PAMp), se aplicó la siguiente aproximación23: PAMp=PADp+0,4×PPp.
El sistema SphygmoCor® XCEL deriva la forma de onda de presión aórtica central de las pulsaciones registradas por el manguito colocado en la arteria braquial, utilizando una función de transferencia generalizada integrada en el software del dispositivo (versión 1.3). El análisis de la forma de onda aórtica proporciona parámetros clave que incluyen presión arterial sistólica central (PASc), presión arterial diastólica central (PADc) y presión de pulso central (PPc), calculado como PPc=PASc-PADc, presión arterial media central (PAMc), e índices de RA como la presión de aumento central (PAc), definida como la diferencia entre el segundo y el primer pico sistólico, y el índice de aumento central (IAc), definido como la PAc expresada como porcentaje de la PPc, así como su valor estandarizado a una frecuencia cardiaca (FC) estándar de 75 latidos por minuto (IAc75). Se efectuaron 3 mediciones, desechándose la primera y promediándose las 2 últimas determinaciones válidas de los parámetros hemodinámicos centrales. La amplificación de presión arterial sistólica (aPAS), se expresó como la diferencia de PASp y PASc (aPAS=PASp-PASc) y la amplificación de la presión de pulso (aPP), se cuantificó de 3 formas: a) como la diferencia entre la PPp y PPc (aPP=PPp-PPc), b) como incremento porcentual entre la PPp y PPc (aPP=[PPp-PPc]/PPc×100) y c) mediante la relación de la PPp y PPc (aPP=PPp/PPc)24.
La determinación de la VOPcf se llevó a cabo a partir de pulsos arteriales carotídeos y femorales medidos de forma no invasiva. Las ondas de pulso carotídeo se midieron mediante tonometría de aplanamiento y las ondas de pulso femoral se obtuvieron simultáneamente mediante un manguito parcialmente inflado sobre la arteria femoral en la pierna a medio camino entre la cadera y la rodilla. La VOPcf se determinó calculando la relación entre la distancia corregida entre los sitios de medición del pulso y el retardo de tiempo entre las ondas de pulso carotídeo y femoral. Para el cálculo de la distancia se utilizó el método de sustracción, mediante el cual la longitud de la trayectoria se calculó restando a la distancia entre la muesca supraesternal y la parte superior del manguito del muslo, la distancia entre la muesca supraesternal y el sitio carotídeo y la distancia desde la arteria femoral en el ligamento inguinal hasta el borde proximal del manguito del muslo. Se promediaron dos mediciones válidas de VOPcf.
Se consideraron valores anómalos de VOPcf los que superaban el valor mediano, del grupo etario correspondiente, asignado a la población de referencia por «The Reference Values for Arterial Stiffness Collaboration»16. Se consideraron valores anómalos de PASc y aPSc, los que superaban el valor mediano del grupo etario correspondiente, asignado a la población de referencia en el estudio de Herbert et al.17.
Análisis estadísticoLas variables continuas se describen como media y desviación estándar (DE) o como mediana y rango intercuartílico (RIC). La comparación de proporciones se llevó a cabo mediante la prueba de Chi-cuadrado. La comparación de medias entre grupos diferentes se llevó a cabo mediante la prueba t de Student para muestras independientes o en su caso la prueba de Mann-Whitney, y la prueba t para muestras relacionadas o el test de Wilcoxon en caso de comparación de medias de un mismo grupo en distintos momentos evolutivos. La correlación con, y entre parámetros hemodinámicos se llevó a cabo con el coeficiente de correlación de Spearman. Se evaluó mediante modelos de regresión lineal y logística, la asociación entre conocidos factores de RCV y los principales parámetros de RA. En todos los contrastes de hipótesis se rechazó la hipótesis nula con un error de tipo I o error α<0,05. Los análisis se hicieron con el programa SPSS® versión 22 (SPSS, Chicago, IL, EE. UU.).
ResultadosDatos basalesSe evaluaron 30 mujeres diagnosticadas de PE no grave y 35 mujeres de PE grave, cuyos datos basales figuran en la tabla 1. No se observaron diferencias significativas en edad, factores de RCV o antecedentes obstétricos entre ambos grupos. Las mujeres con PE grave respecto de aquellas con PE sin criterios de gravedad vieron anticipado su parto (35,7±4,1 semanas en PE grave vs, 38,1±2,3 semanas en PE no grave; p=0,006) y utilizaron más la cesárea como forma de finalización de la gestación (51,4 en PE grave vs. 26,7% en PE sin criterios de gravedad; p=0,042). En función del momento de su debut, la PE precoz de observó en el 22,9% de los casos de PE grave y en el 13,3% de los casos de PE no grave. Un 20% de los casos de PE grave cursaron sin proteinuria. Los recién nacidos de madres con PE grave presentaron menor peso que los nacidos de madres con PE no grave, aunque las diferencias no alcanzaron significación estadística.
Descripción general de la población
| PE no grave (n=30) | PE grave (n=35) | Valor de p | |
|---|---|---|---|
| Edad | 33,6±6,5 | 35,0±6,1 | 0,393 |
| Rango de edad, n (%) | |||
| <30 años | 6 (20,0) | 6 (17,1) | 0,459 |
| De 30 a 39 años | 20 (66,7) | 22 (62,9) | 0,705 |
| >39 años | 4 (13,3) | 7 (20,0) | 0,248 |
| Factores de riesgo cardiovascular, n (%) | |||
| HTA previa al embarazo | — | — | — |
| DM | 2 (6,7) | 2 (5,7) | 0,873 |
| Dislipemia | — | — | — |
| Tabaquismo | 1 (3,3) | — | — |
| Persistencia HTA 6 mes posparto | — | 2 (5,7) | — |
| Antecedentes obstétricos, n (%) | |||
| Número gestaciones previas | 0,313 | ||
| Ninguna | 20 (66,7) | 18 (51,4) | |
| Una o más | 10 (33,3) | 17 (48,6) | |
| Abortos previos | 3 (10,0) | 7 (20,0) | 0,319 |
| PE previa | 5 (16,7) | 4 (11,4) | 0,542 |
| Datos de la gestación actual | |||
| Embarazo múltiple, n (%) | 4 (13,3) | 2 (5,7) | 0,403 |
| Técnicas de reproducción asistida, n (%) | 8 (26,7) | 4 (11,4) | 0,208 |
| Parto por cesárea, n (%) | 8 (26,7) | 18 (51,4) | 0,042 |
| Semana de parto, media±DE | 38,1±2,3 | 35,7±4,1 | 0,006 |
| HELLP, n (%) | — | 6 (17,1%) | — |
| Eclampsia, n (%) | — | — | — |
| Clasificación PE en función del momento de aparición, n (%) | 0,324 | ||
| Precoz | 4 (13,3) | 8 (22,9) | |
| Tardía | 26 (86,7) | 27 (77,1) | |
| Complicaciones maternas | |||
| Rotura prematura de membrana n (%) | 1 (3,3) | 1 (2,9) | 0,912 |
| Hemorragia n (%) | 1 (3,3) | 3 (8,6) | 0,381 |
| Epigastralgia n (%) | — | 9 (25,7) | — |
| Cefalea n (%) | — | 15 (42,9) | — |
| Edema de pulmón n (%) | — | — | — |
| Alteraciones visuales n (%) | — | 2 (5,7) | — |
| Alteraciones analíticas n (%) | |||
| Proteinuria n (%) | 30 (100) | 28 (80,0) | 0,010 |
| Proteinúria (mg/24h), Me (RIC) | 851,5 (566,0-1.520,3) | 561,0 (359,3-799,0) | 0,018 |
| Alteración de función renal n (%) | — | 2 (5,7) | — |
| Creatinina (mg/dl), Me (RIC) | 0,69 (0,61-0,87) | 0,64 (0,56-0,78) | 0,426h |
| Trombocitopenia n (%) | — | 6 (17,1) | — |
| Alteración pruebas función hepática n (%) | — | 6 (17,1) | — |
| PAS≥160 y/o PAD≥110mmHg, n (%) | — | 25 (71,4) | — |
| PA al diagnóstico (mmHg), media±DE | |||
| PAS | 150,9±7,5 | 165,9±20,4 | <0,001 |
| PAD | 91,3±7,5 | 98,1±12,4 | 0,010 |
| Datos del recién nacido | |||
| Peso al nacer (mg) media±DE | 3.076,3±446,3 | 3.015,1±326,2 | 0,744 |
| CIR n (%) | 1 (3,3) | 3 (8,6) | 0,381 |
CIR: retraso del crecimiento intrauterino; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PE: preeclampsia.
En el análisis de la función renal al diagnóstico de la PE, las pacientes del grupo de PE no grave presentaron valores de proteinuria significativamente superiores a las del grupo de PE grave (851,5 [566,0-1.520,3] vs. 561,0mg/24 [359,3-799,0]; p=0,018). No se observaron diferencias significativas en los valores de creatinina sérica entre ambos grupos.
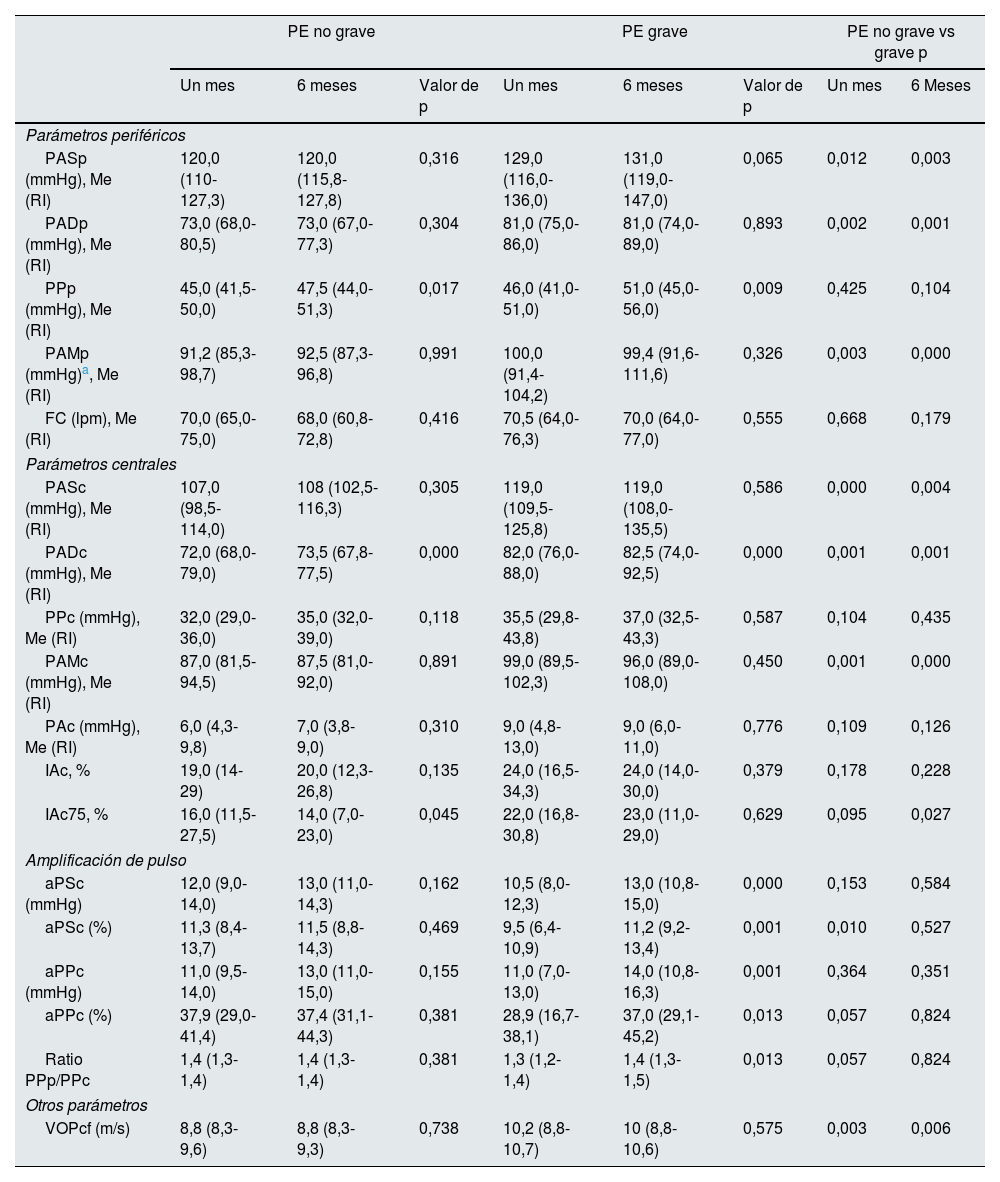
Parámetros vascularesLa tabla 2 recoge los parámetros vasculares obtenidos con el sistema SphygmoCor® XCEL al mes y a los 6 meses posteriores al parto. El análisis de la PAp o PAc, no reflejó sustanciales diferencias dentro de cada grupo entre ambos momentos evolutivos. Sin embargo, la comparación entre ambos grupos, puso de manifiesto que las mujeres con PE grave respecto a aquellas cuya PE no revistió gravedad, mostraron de forma estadísticamente significativa, mayores valores de PAS (hasta 11mmHg a nivel periférico y hasta 12 a nivel central), de PAD (8mmHg a nivel periférico y hasta 10mmHg a nivel central) y de PAM (hasta 9mmHg a nivel periférico y hasta 12mmHg a nivel central).
Parámetros vasculares en función de la gravedad de la preeclampsia
| PE no grave | PE grave | PE no grave vs grave p | ||||||
|---|---|---|---|---|---|---|---|---|
| Un mes | 6 meses | Valor de p | Un mes | 6 meses | Valor de p | Un mes | 6 Meses | |
| Parámetros periféricos | ||||||||
| PASp (mmHg), Me (RI) | 120,0 (110-127,3) | 120,0 (115,8-127,8) | 0,316 | 129,0 (116,0-136,0) | 131,0 (119,0-147,0) | 0,065 | 0,012 | 0,003 |
| PADp (mmHg), Me (RI) | 73,0 (68,0-80,5) | 73,0 (67,0-77,3) | 0,304 | 81,0 (75,0-86,0) | 81,0 (74,0-89,0) | 0,893 | 0,002 | 0,001 |
| PPp (mmHg), Me (RI) | 45,0 (41,5-50,0) | 47,5 (44,0-51,3) | 0,017 | 46,0 (41,0-51,0) | 51,0 (45,0-56,0) | 0,009 | 0,425 | 0,104 |
| PAMp (mmHg)a, Me (RI) | 91,2 (85,3-98,7) | 92,5 (87,3-96,8) | 0,991 | 100,0 (91,4-104,2) | 99,4 (91,6-111,6) | 0,326 | 0,003 | 0,000 |
| FC (lpm), Me (RI) | 70,0 (65,0-75,0) | 68,0 (60,8-72,8) | 0,416 | 70,5 (64,0-76,3) | 70,0 (64,0-77,0) | 0,555 | 0,668 | 0,179 |
| Parámetros centrales | ||||||||
| PASc (mmHg), Me (RI) | 107,0 (98,5-114,0) | 108 (102,5-116,3) | 0,305 | 119,0 (109,5-125,8) | 119,0 (108,0-135,5) | 0,586 | 0,000 | 0,004 |
| PADc (mmHg), Me (RI) | 72,0 (68,0-79,0) | 73,5 (67,8-77,5) | 0,000 | 82,0 (76,0-88,0) | 82,5 (74,0-92,5) | 0,000 | 0,001 | 0,001 |
| PPc (mmHg), Me (RI) | 32,0 (29,0-36,0) | 35,0 (32,0-39,0) | 0,118 | 35,5 (29,8-43,8) | 37,0 (32,5-43,3) | 0,587 | 0,104 | 0,435 |
| PAMc (mmHg), Me (RI) | 87,0 (81,5-94,5) | 87,5 (81,0-92,0) | 0,891 | 99,0 (89,5-102,3) | 96,0 (89,0-108,0) | 0,450 | 0,001 | 0,000 |
| PAc (mmHg), Me (RI) | 6,0 (4,3-9,8) | 7,0 (3,8-9,0) | 0,310 | 9,0 (4,8-13,0) | 9,0 (6,0-11,0) | 0,776 | 0,109 | 0,126 |
| IAc, % | 19,0 (14-29) | 20,0 (12,3-26,8) | 0,135 | 24,0 (16,5-34,3) | 24,0 (14,0-30,0) | 0,379 | 0,178 | 0,228 |
| IAc75, % | 16,0 (11,5-27,5) | 14,0 (7,0-23,0) | 0,045 | 22,0 (16,8-30,8) | 23,0 (11,0-29,0) | 0,629 | 0,095 | 0,027 |
| Amplificación de pulso | ||||||||
| aPSc (mmHg) | 12,0 (9,0-14,0) | 13,0 (11,0-14,3) | 0,162 | 10,5 (8,0-12,3) | 13,0 (10,8-15,0) | 0,000 | 0,153 | 0,584 |
| aPSc (%) | 11,3 (8,4-13,7) | 11,5 (8,8-14,3) | 0,469 | 9,5 (6,4-10,9) | 11,2 (9,2-13,4) | 0,001 | 0,010 | 0,527 |
| aPPc (mmHg) | 11,0 (9,5-14,0) | 13,0 (11,0-15,0) | 0,155 | 11,0 (7,0-13,0) | 14,0 (10,8-16,3) | 0,001 | 0,364 | 0,351 |
| aPPc (%) | 37,9 (29,0-41,4) | 37,4 (31,1-44,3) | 0,381 | 28,9 (16,7-38,1) | 37,0 (29,1-45,2) | 0,013 | 0,057 | 0,824 |
| Ratio PPp/PPc | 1,4 (1,3-1,4) | 1,4 (1,3-1,4) | 0,381 | 1,3 (1,2-1,4) | 1,4 (1,3-1,5) | 0,013 | 0,057 | 0,824 |
| Otros parámetros | ||||||||
| VOPcf (m/s) | 8,8 (8,3-9,6) | 8,8 (8,3-9,3) | 0,738 | 10,2 (8,8-10,7) | 10 (8,8-10,6) | 0,575 | 0,003 | 0,006 |
aPPc: amplificación de presión de pulso central; aPSc: amplificación de presión sistólica central; FC: frecuencia cardiaca; IAc: índice aumento central; IAc75: índice de aumento central normalizado a 75lpm; PADc: presión arterial diastólica central; PADp: presión arterial diastólica periférica; PAMc: presión arterial media central; PAMp: presión arterial media periférica; PASc: presión arterial sistólica central; PASp: presión arteríal sistólica periférica; PPc: presión de pulso central; PPp: presión de pulso periferíca.
Entre los principales parámetros centrales de RA (PAc, e IAc), no se observaron diferencias significativas en las comparaciones intragrupo. Sin embargo, la comparación entre ambos grupos reflejó que las mujeres con PE grave registraron mayores valores de PAc (hasta 3mmHg) e IAc (hasta un 5 y hasta un 9% en el IAc75), que las mujeres con PE no grave, aunque las diferencias no alcanzaron significación estadística. En lo que se refiere a la amplificación de onda de pulso, entre las mujeres con PE no grave, no se observaron diferencias, entre ambos periodos evolutivos, tanto en la aPSc como en la aPPc, mientras que entre las mujeres con PE grave, se produjeron incrementos significativos, entre el mes 1 y el mes 6 del posparto, del orden de 2mmHg en la aPASc (10,5 [8,0-12,3] vs. 13,0mmHg [10,8-15,0]); p<0,001 (aproximadamente un 1,7%) y de 3mmHg en la aPPc 11,0 (7,0-13,0) vs. 14,0mmHg (10,8-16,3); p=0,001 (aproximadamente un 8%). En las comparaciones entre ambos grupos no se observaron, ni en la aPASc ni en la aPPc, diferencias significativas en ninguno de los momentos analizados.
En cuanto a la VOPcf, la comparación intragrupo no reflejó variaciones significativas entre ambos momentos evolutivos. Sin embargo, la comparación entre grupos si reflejó diferencias significativas, tanto a un mes posparto, 8,8 (8,3-9,6) en el grupo de PE no grave vs. 10,2m/s (8,8-10,7) en el grupo de PE grave, p=0,003, como a 6 meses posparto 8,8 (8,3-9,3) m/s en el grupo de PE no grave vs. 10,0 (8,8-10,6)m/s en el grupo de PE grave; p=0,006.
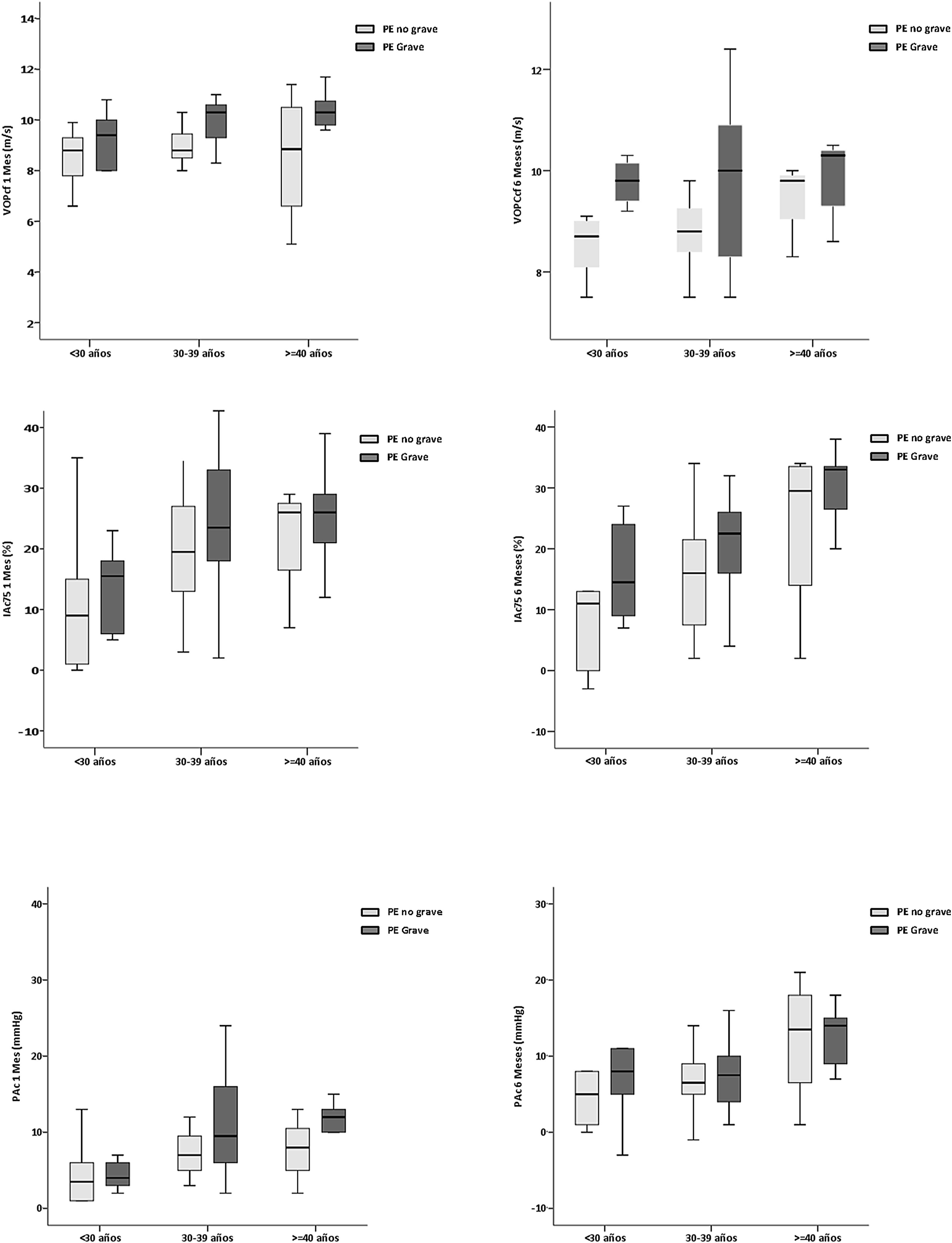
En la figura 1 se muestran las comparaciones entre los grupos PE no grave y PE grave de los principales parámetros analizados por rango de edad (<30, 30-39 y ≥40 años).
Alteración de parámetros de rigidez arterialAlteración de la VOPcf
Un mes posparto, un 90 y un 94,3% de las mujeres de los grupos de PE no grave y PE grave, respectivamente, presentaban valores alterados de la VOPcf, y en un total de 19 mujeres (3 del grupo de PE no grave y 15 del grupo de PE grave), la VOPcf fue superior a 10m/s. A 6 meses posparto, el 100% de las mujeres de ambos grupos presentaban valores alterados de VOPcf, y una mujer del grupo de PE no grave y 10 del grupo de PE grave tenían una VOPcf≥10m/s.
Alteración de la PAScUn mes posparto el 34,5% de las mujeres del grupo de PE no grave y un 70,6% del grupo de PE grave, presentaban valores alterados de PASc. A los 6 meses del parto la alteración fue observada en el 50 y el 73,5%, respectivamente.
Alteración de la amplificación de pulsoEn el grupo de PE no grave un 79,3 y un 86,7% de las mujeres, presentaban a uno y 6 meses posparto, respectivamente, valores medianos de aPASc superiores a los establecidos para su grupo etario de referencia. En el grupo de PE grave, la alteración se observó en el 76,5 y 91,2%, respectivamente
Correlación y asociaciónEl análisis de correlación de los principales parámetros de RA reflejo que, en el grupo de PE no grave, la VOPcf se correlacionó un mes después del parto con la PASp (rho=0,462) y a los 6 meses posparto con la edad y con la PASp (rho=0,416 y 0,603), respectivamente. En el grupo de PE grave, se correlacionó un mes posparto con la PASp (rho=0,308) y a 6 meses posparto con la edad y el IAc (rho=0,607 y 0,448), respectivamente.
Por su parte, el IAc se correlacionó, en el grupo de PE no grave, un mes posparto con la VOPcf, la PPc y con el APc (rho=0,443, 0,591 y 0,973), respectivamente y a los 6 meses posparto con la edad, la PASp, la VOPcf y con la APc (rho=0,423, 0,464, 0,448 y 0,965, respectivamente). En el grupo de PE grave se correlacionó un mes posparto con la edad, la PASp, la PPc y el APc (rho=0,448, 0,473, 0,668 y 0,955), respectivamente y a los 6 meses posparto con la edad, la VOPcf, la PPc y el APc (rho=0,351, 0,550, 0,578 y 0,928), respectivamente.
En los modelos de regresión lineal, no encontramos asociación entre parámetros de RA con la talla, el índice de masa corporal (IMC), o la prevalencia de factores de RCV como dislipemia, tabaquismo, obesidad, y DM. En los modelos de regresión logística, tampoco encontramos asociación entre estos factores y valores alterados de los principales parámetros de RA.
DiscusiónEl principal hallazgo del presente estudio fue que las mujeres con PE grave presentan valores, tanto al mes como a los 6 meses posparto, de PAc como PAp, así como parámetros de RA y amplificación de pulso, superiores a aquellas mujeres cuya PE cursó sin gravedad.
En mujeres preeclámpticas, incluso tras la normalización de la PA después del parto, se ha observado la persistencia, incluso de hasta varios años de índices alterados RA25–28, lo que puede proporcionar una explicación potencial del aumento del RCV es estas mujeres29–32. Sin embargo, estudios que evalúan la disfunción endotelial y la RA varios años después del embarazo preeclámptico no han sido concluyentes33–35. Hasta donde sabemos, este es el primer estudio que analiza, de una forma consistente, la RA y la amplificación de la onda de pulso en función de la gravedad de la PE. Estudios previos como el de Khalil et al.31 observaron que tanto la PAc como el IAc75, fueron significativamente más altos en PE grave vs. PE sin gravedad (p<0,001). Sin embargo, el análisis de la onda de pulso para evaluar la RA se llevó a cabo 24/48h previas al inicio de la terapia antihipertensiva, por lo que no pudieron constatar si la RA volvía a la normalidad después del parto y, de ser así, en cuánto tiempo. En otro estudio, Avni et al.36, constaron que las mujeres que desarrollaron PE grave en su embarazo mostraban parámetros de RA (PAc, IAc e IAc75) más elevados que aquellas otras con PE no grave. Sin embargo, el grupo de PE grave solo contaba con 5 mujeres, y la determinación de los parámetros vasculares centrales y de RA, se tomaron a lo largo del embarazo y sin establecer una uniformidad temporal del momento de su determinación. En nuestro estudio, hemos analizado la evolución de los parámetros de RA de manera uniforme al mes y a los 6 meses posteriores al parto, observando que las mujeres con PE grave presentan parámetros sostenidos de RA y amplificación de onda pulso más acusados que aquellas con PE no grave.
Se ha constatado una estrecha asociación entre la edad y la PA con la RA. Sin embargo, la asociación con otros factores de RCV, independientes de la PA, como dislipemia, tabaquismo, obesidad, sexo, FC y DM resulta inconsistente37–41. La PAc representa en términos absolutos el aumento de la presión aórtica motivado por el reflejo de la onda de pulso a través del árbol arterial, habiéndose señalado un aumento lineal de este parámetro con la edad. Igualmente, existe una estrecha asociación entre la edad y el IAc, más marcada en individuos jóvenes (menores de 50 años), y la VOPcf, más sensible en los mayores de 50 años, lo que, además de determinar que estos 2 parámetros no resulten intercambiables a la hora de determinar la RA, sugiere que el IAc podría ser un marcador más sensible del envejecimiento arterial en individuos más jóvenes y la VOP más sensible en los mayores de 50 años13. En nuestro estudio, tan solo hemos observado correlación significativa consistente en ambos periodos evolutivos entre la edad y el IAc en el grupo de PE grave, pero no así con la PAc ni con la VOPcf, circunstancia que justificamos por la homogeneidad de la población analizada y la escasa variabilidad de la edad de las pacientes. En cuanto al resto de factores de RCV, en nuestro trabajo, tampoco hemos observado diferencias significativas en, talla, IMC, o prevalencia de factores como dislipemia, tabaquismo, obesidad, sexo, FC y DM, entre ambos grupos de mujeres, ni tampoco hemos encontrado correlación lineal o asociación entre estas variables y los principales parámetros de RA (PAc, IAc y VOPcf). Igualmente, estudios como el de Wilkinson et al.42, señalan una relación lineal inversa entre la frecuencia cardiaca y el IAc y directa con la ratio PPp/PPc, ninguna de las cuales hemos detectado en nuestro estudio. También se ha informado de mayores índices de RA entre la PE de inicio temprano que en las de inicio tardío31,43. Sin embargo, nosotros, al igual que en la revisión sistemática de Kirollos et al.28, no hemos encontrado diferencias significativas en función del momento de aparición de la PE.
La amplificación de pulso se encuentra determinada por fenómenos de reflexión y muestran una gran variabilidad entre sujetos diferentes e incluso dentro de un mismo sujeto ante determinados cambios fisiopatológicos, así como con la administración de fármacos que afectan la FC44,45. Un trabajo de McEniery et al.46 constataron que, además de la edad, la FC, el sexo y la altura, todos los factores de RCV y la presencia de enfermedad CV se encontraban asociados de forma independiente con la ratio PPp/PPc, y la diferencia PSp-PSc. En nuestro trabajo no hemos encontrado asociación entre estos parámetros de amplificación de pulso con la edad, altura, FC ni otros factores de RCV, debido probablemente a que mientras en el citado trabajo se analizaba población con rango de edades de ≤20 años hasta ≥80 años, la mayoría sin factores de RCV, o como mucho con un solo factor de riesgo, las mujeres de nuestro estudio presentan escasa variabilidad en su edad, así como una baja prevalencia de factores adicionales de RCV.No nos quedan claras las causas específicas de estas diferencias de RA en función de la gravedad de la PE, aunque es muy probable que su etiología, como en la PE, sea multifactorial. Es posible que factores de tipo inmunológico, representen un papel importante en la mayor rigidez observada en estas las pacientes diagnosticadas de PE grave, tal como hemos observado en un estudio previo llevado a cabo por nuestro equipo, en el que constatamos que la RA, evaluada tres meses después del parto mediante el análisis de la VOPcf, se encontraba intensamente relacionado con la presencia de anticuerpos antifosfatidilserina/protrombina IgM, y era más intensa entre las mujeres con PE grave que entre las mujeres cuya PE no había revestido gravedad47.
Aunque diversos estudios evidencian la superioridad de la PAc sobre la PAp en la predicción de daño en órganos diana y RCV6,11,48, en la práctica clínica, la HTA y el RCV se diagnostica y estratifica, casi exclusivamente, en función de la PA braquial. De hecho, pacientes a quienes se asigna un determinado grado de RCV, sobre la base de un diagnóstico de HTA, según valores de PA braquial, podrían tener un RCV diferente si se tuviesen en consideración valores de PAc y parámetros de RA y amplificación de onda de pulso11. En nuestro estudio, un mes posparto, 19 mujeres (3 del grupo de PE no grave y 16 del grupo de PE grave), presentaban una VOPcf superior a 10m/s y 6 meses posparto, 11 mujeres (tan solo una del grupo de PE no grave), superaban dicho umbral, lo que según los vigentes criterios7 se considera una estimación conservadora de alteraciones significativas de la función aórtica en pacientes de mediana edad.
La RA promueve la remodelación interna de las arterias pequeñas, lo que aumenta la resistencia, la presión arterial y, a su vez, la rigidez de la arteria central, creando así un circuito de retroalimentación insidioso. De otro lado, diversos estudios constatan que la RA no es solo un poderoso predictor de riesgo CV, sino también un marcador asociado con el desarrollo de la enfermedad renal crónica. La RA empeora a medida que disminuye la función renal, se asocia con proteinuria, con trastornos óseos y minerales y predice la muerte y la progresión de la enfermedad renal crónica hacia etapas terminales de la misma49. Por ello, es posible que deban valorarse nuevas estrategias terapéuticas a largo plazo para mujeres que han tenido PE en su embarazo, en especial si la misma cursó con criterios de gravedad, enfocada a la prevención o reducción de la RA, que combinen medidas no farmacológicas como pérdida de peso corporal, reducción de la ingesta de sal y ejercicio físico, y en su caso, con tratamientos farmacológicos antihipertensivos y medicamentos hipolipemiantes y antidiabéticos.
La principal fortaleza de nuestro estudio radica en su carácter prospectivo y hasta donde sabemos ser el primero que analiza, de una forma consistente, al mes y a los 6 meses posparto, la RA y la amplificación de la onda de pulso en función de la gravedad de la PE. Como principales debilidades se encuentra el no haber podido extender más allá de los 6 meses posparto el análisis de los índices de RA, y no haber podido evaluar otros parámetros asociados a la disfunción endotelial, tales como la sobreexpresión de factores antiangiogénicos como el factor soluble tirosin kinasa 1fms-like (sFlt1) y la endoglina solubleo (sEng), o la baja presencia de factores proangiogénicos como el factor de crecimiento placentario (PlGF) y factor de crecimiento endotelial vascular (VEGF), al objeto de comprobar si la RA observada, especialmente en la PE grave, se mantienen el tiempo o se van atenuando con su transcurso.
En conclusión, las mujeres que han tenido PE grave en su embarazo presentan parámetros de RA más acusados que los de aquellas en las que la PE no revistió signos de gravedad, lo que indica un mayor RCV de estas pacientes. Consideramos que entre las mujeres que han presentado PE durante su embarazo, debiera evaluarse la conveniencia de si el IAc y especialmente la VOPcf, métodos factibles, no invasivos y replicables, debieran incluirse de forma rutinaria en las estrategias de evaluación del RCV de estas mujeres.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.