A pesar de que el acceso vascular recomendado para el desarrollo de la hemodiálisis es la fístula arteriovenosa autóloga, cada vez se emplean más catéteres venosos centrales (CVC) tunelizados. La infección es la causa más común de morbilidad, y la segunda causa de mortalidad en esta población. La colonización de las conexiones es la clave en la etiopatogenia de estas infecciones. Los microorganismos que con mayor frecuencia están implicados en la bacteriemia relacionada con catéter (BRC) son Staphylococcus aureus y los estafilococos coagulasa negativos. El diagnóstico de la BRC se puede realizar mediante técnicas conservadoras, como los hemocultivos cuantitativos pareados o los hemocultivos convencionales extraídos a través de CVC y venopunción y el cálculo del tiempo diferencial. El tratamiento dependerá de la situación clínica del paciente, del microorganismo implicado y de la presencia de complicaciones infecciosas locales (tunelitis) o sistémicas (endocarditis, tromboflebitis supurada, osteomielitis). Se puede realizar un tratamiento conservador en pacientes estables con un episodio de bacteriemia causado por microorganismos poco virulentos como los estafilococos coagulasa negativos. En este caso se combinará un tratamiento antibiótico sistémico con uno local (sellado antibiótico). La mejor estrategia para la BRC es la prevención. La medida fundamental de prevención es la asepsia en el procedimiento de inserción y manipulación de los CVC.
A pesar de que el acceso vascular recomendado para el desarrollo de la hemodiálisis es la fístula arteriovenosa autóloga, cada vez se emplean más catéteres venosos centrales (CVC) tunelizados. La infección es la causa más común de morbilidad, y la segunda causa de mortalidad en esta población. La colonización de las conexiones es la clave en la etiopatogenia de estas infecciones. Los microorganismos que con mayor frecuencia están implicados en la bacteriemia relacionada con catéter (BRC) son Staphylococcus aureus y los estafilococos coagulasa negativos. El diagnóstico de la BRC se puede realizar mediante técnicas conservadoras, como los hemocultivos cuantitativos pareados o los hemocultivos convencionales extraídos a través de CVC y venopunción y el cálculo del tiempo diferencial. El tratamiento dependerá de la situación clínica del paciente, del microorganismo implicado y de la presencia de complicaciones infecciosas locales (tunelitis) o sistémicas (endocarditis, tromboflebitis supurada, osteomielitis). Se puede realizar un tratamiento conservador en pacientes estables con un episodio de bacteriemia causado por microorganismos poco virulentos como los estafilococos coagulasa negativos. En este caso se combinará un tratamiento antibiótico sistémico con uno local (sellado antibiótico). La mejor estrategia para la BRC es la prevención. La medida fundamental de prevención es la asepsia en el procedimiento de inserción y manipulación de los CVC.
Criterios de revisión: Se ha realizado una búsqueda bibliográfica en PubMed utilizando los términos enumerados como palabras clave durante los últimos 20 años. Se incluyen como referencias aquellos artículos considerados más relevantes y actuales, así como aquellos considerados como artículos pivotales.
ACCESO VASCULAR EN HEMODIÁLISIS
El acceso vascular ideal en hemodiálisis (HD) es aquel que permite un abordaje seguro y continuo al espacio intravascular, un flujo sanguíneo adecuado para la diálisis, una vida media larga y un bajo porcentaje de complicaciones tanto mecánicas como infecciosas.
El acceso vascular más adecuado para cada paciente depende de la edad, la presencia de comorbilidades asociadas, la anatomía vascular, los accesos previos y la urgencia en la necesidad del acceso.
Las recomendaciones de la Sociedad Española de Nefrología (S.E.N.) acerca del empleo de accesos vasculares se pueden resumir en los siguientes puntos1:
1. El acceso vascular que debe considerarse como primera opción es la fístula arteriovenosa autóloga (evidencia A).
2. En el caso de no existir venas adecuadas, se utilizará una prótesis o un injerto vascular (evidencia B).
3. La implantación de un catéter venoso central (CVC) ha de considerarse cuando no sea posible realizar ninguna de las anteriores, o cuando sea necesario iniciar una sesión de HD sin disponer de un acceso vascular definitivo y maduro (evidencia B).
La prevalencia en aumento de pacientes en programas de HD, asociada a su vez a un incremento de los pacientes con circulación periférica alterada, pacientes diabéticos y/o ancianos, ha generado un incremento en el uso de CVC en nuestras unidades.
Se pueden emplear dos tipos de catéteres: CVC no tunelizados, para usos inferiores a tres-cuatro semanas, y CVC tunelizados, que se emplean durante largos períodos de tiempo. Los CVC tunelizados llevan un manguito de dacrón o poliéster que actúa como anclaje en el tejido subcutáneo induciendo fibrosis. De esta manera, generan una barrera mecánica que impide la migración extraluminal de los microorganismos desde el punto de inserción.
La inserción de un CVC tunelizado debe realizarse, si es posible, en la vena yugular interna derecha, porque es el acceso con mejores resultados en cuanto al flujo y a la frecuencia de estenosis y trombosis venosa2. La vena subclavia debe emplearse sólo cuando el resto de accesos hayan sido previamente utilizados, ya que se asocia con una mayor incidencia de estenosis o trombosis, aunque con una menor tasa de infección3.
Las complicaciones que más frecuentemente limitan la vida útil de un CVC son las mecánicas y las infecciosas. La infección es la causa más común de morbilidad y la segunda causa de mortalidad después de la enfermedad cardiovascular en esta población4. La incidencia de bacteriemia relacionada con catéter (BRC) en pacientes en HD depende del tipo y localización del CVC, de las características de la población y de las medidas de inserción y manipulación de cada centro. La tasa de BRC en CVC no tunelizados oscila entre 3,8 y 6,6 episodios/1.000 días de uso de CVC y entre 1,6 y 5,5 episodios/1.000 días de uso de CVC tunelizado. El empleo de un CVC tunelizado conlleva un aumento en el riesgo de bacteriemia de 7 y 20 veces respecto al de las fístulas arteriovenosas6.
ETIOLOGÍA DE LA INFECCIÓN RELACIONADA CON CATÉTER EN HEMODIÁLISIS
Los microorganismos responsables de una de las dos terceras partes de las BRC son grampositivos7. Staphylococcus aureus y los estafilococos coagulasa negativos son los microorganismos más frecuentemente aislados. Debido a la elevada tasa de portadores de
S. aureusen pacientes en HD (prevalencia del 30-60% en algunos centros), se observa una mayor tasa de BRC por S. aureus que en otros grupos de pacientes portadores de otros tipos de accesos vasculares. S. aureus es un microorganismo muy virulento capaz de ocasionar complicaciones metastásicas como osteomielitis y endocarditis. Otros microorganismos aislados con menor frecuencia son: Streptococcus spp., Enterococcus spp. y Corynebacterium spp. (microorganismos constituyentes también de la microbiota epitelial)7. Los bacilos gramnegativos raramente ocasionan BRC en pacientes en HD7. Algunos autores han descrito episodios polimicrobianos8,
o incluso episodios de BRC casusados por micobacterias u hongos. En la tabla 1 se muestra la distribución de los microorganismos aislados en episodios de BRC en diferentes estudios en pacientes en HD.
PATOGENIA DE LA INFECCIÓN RELACIONADA CON CATÉTER EN HEMODIÁLISIS
La patogenia de la infección relacionada con catéter es multifactorial y compleja. La vía de acceso principalmente involucrada en la infección relacionada con catéteres de HD de larga duración es la colonización endoluminal. El procedimiento diario de HD requiere una gran manipulación de las conexiones, lo que facilita la colonización de las mismas con la microbiota epitelial del paciente o del propio personal sanitario. Los microorganismos también pueden acceder por vía endoluminal al interior del CVC tras la infusión de un líquido contaminado o tras una diseminación hematógena desde un punto distante de infección.
Tras la inserción de un catéter, el segmento intravascular se recubre inmediatamente de proteínas del huésped (fibrina, fibrinógeno, fibronectina, laminina, etc.), que modifican la superficie del biomaterial, y actúan como adhesinas específicas para diferentes microorganismos. A su vez, estas proteínas favorecen también la adherencia de plaquetas, y promueven la trombogénesis y la formación de coágulos de fibrina. Los coágulos formados proporcionan una fuente de nutrientes para la proliferación bacteriana y la formación de biocapas. La masa generada puede disminuir el flujo a través del catéter, llegando incluso a obstruirlo. Además, esta disminución del flujo vascular implica una mayor manipulación del catéter, lo que incrementa el riesgo de infección; por lo que se establece una relación recíproca entre complicaciones mecánicas y colonización del catéter.
Los microorganismos, una vez adheridos, colonizan la superficie del catéter constituyendo una biocapa bacteriana. A continuación comienzan a dividirse y forman microcolonias. En una etapa posterior, los microorganismos comienzan la secreción de un exopolisacárido que constituye una matriz, formando una estructura tridimensional9. El proceso mediante el cual las células se comunican entre sí y mediante el que regulan numerosos factores de virulencia se denomina quorum sensing. Finalmente, algunas células pueden liberarse de la matriz y pueden diseminar la infección a localizaciones distantes.
Se ha demostrado que las bacterias en el interior de la biocapa son capaces de resistir concentraciones de antimicrobianos comprendidas entre 100 y 1.000 veces mayores que las necesarias para erradicar el mismo microorganismo en condiciones de crecimiento planctónico10. Existen numerosas hipótesis que explican esta peculiar forma de resistencia microbiana: 1) la existencia de una matriz polimérica que constituye una barrera de difusión física y química en la penetración de algunos agentes antimicrobianos (p. ej., vancomicina); 2) la existencia de microambientes específicos que pueden alterar la actividad de los antimicrobianos (p. ej., condiciones de anaerobiosis interfieren con la actividad de aminoglucósidos); 3) la generación de microorganismos en fase de crecimiento cero (bacterias persistentes resistentes a la acción de los antimicrobianos) y 4) la estimulación de respuestas de estrés puede provocar cambios genotípicos y fenotípicos en las bacterias que forman la biocapa11.
La interacción entre el microorganismo, el biomaterial y los mecanismos de defensa del paciente, inmunidad alterada en el caso de pacientes en HD, contribuirá al desarrollo de una BRC7. La colonización de la superficie interna de un CVC se produce de forma progresiva, de tal modo que en el momento en el que se alcanza un valor umbral de bacterias por unidad de superficie se origina una BRC (figura 1). El diagnóstico precoz de la colonización de CVC y la instauración de un tratamiento preventivo podrían evitar el desarrollo de complicaciones infecciosas18.
DIAGNÓSTICO DE LA BACTERIEMIA RELACIONADA CON CATÉTER EN HEMODIÁLISIS
La sospecha y el diagnóstico de la infección relacionada con catéter se basa en la presencia de síntomas clínicos, locales y/o sistémicos de infección. Los hallazgos clínicos frecuentes, como la fiebre, presentan una sensibilidad elevada pero una especificidad muy baja, mientras que la inflamación o la presencia de exudados purulentos alrededor del punto de inserción muestran mayor especificidad, aunque poca sensibilidad12.
En muchos casos, el diagnóstico de la infección relacionada con catéter conlleva la decisión terapéutica de la retirada de éste12. Esto, en pacientes críticos o con accesos vasculares limitados, puede ser comprometido. Por ello, se han desarrollado técnicas conservadoras de diagnóstico, como los hemocultivos cuantitativos extraídos a través del CVC y venopunción, y el estudio del tiempo diferencial entre los frascos de hemocultivos convencionales extraídos simultáneamente a través del CVC y venopunción.
El fundamento de los hemocultivos cuantitativos se basa en que, en episodios de BRC, el número de unidades formadoras de colonias (UFC)/ml obtenido de la sangre extraída a través de un CVC colonizado es mayor que el número de UFC/ml obtenido de la sangre extraída a través de una vena periférica (figura 2). Concretamente, se considera que un paciente tiene BRC cuando esta relación es mayor o igual a tres (evidencia AII)12. Capdevila, et al.13 determinaron que recuentos superiores a 100 UFC/ml en la sangre extraída a través del CVC, en pacientes portadores de CVC tunelizado con sintomatología clínica y hemocultivo convencional extraído de venopunción positivo, son indicativos de BRC. El estudio microbiológico debe incluir el cultivo de sangre extraída a través de todas las luces del CVC14. La principal limitación del hemocultivo cuantitativo es la laboriosidad en el procesamiento.
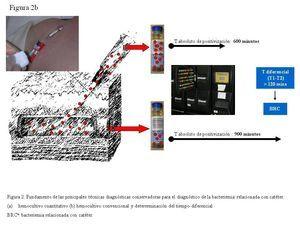
Si inoculamos frascos de hemocultivos convencionales (BacT/Alert, Bactec, etc.) con la sangre extraída a través de un CVC colonizado, con mayor concentración bacteriana y, simultáneamente, inoculamos frascos con la sangre obtenida mediante venopunción, el tiempo absoluto de positivización será inferior en los frascos inoculados con la sangre extraída a través del CVC en los episodios de BRC (figura 2). Blot, et al.15 establecieron un tiempo diferencial de dos horas entre el tiempo de positivización de los hemocultivos extraídos a través de la luz del catéter y los de sangre periférica, con una sensibilidad del 94% y una especificidad del 91%, para el diagnóstico de BRC. Actualmente se continúa considerando BRC un tiempo diferencial de más de dos horas, entre los hemocultivos extraídos a través del CVC y vena periférica (evidencia AII)12. La ventaja de esta técnica es que no requiere ningún procesamiento especial, ya que emplea los sistemas automatizados utilizados convencionalmente en los laboratorios para el procesamiento de los hemocultivos cualitativos.
En ocasiones, los episodios de BRC y sus síntomas se producen tras el inicio de la HD. En estos casos, la extracción de sangre a través del circuito de HD podría sustituir a la sangre extraída a través de venopunción16.
Rushforth, et al.17 describieron una nueva técnica de diagnóstico de BRC mediante la tinción con naranja de acridina y/o Gram de la capa leucocitaria extraída, tras una centrifugación diferencial de la sangre intracatéter. La visualización de un microorganismo en la extensión fue valorada como significativa en este estudio17. La ventaja fundamental de la técnica es que requiere muy poca cantidad de sangre. El cultivo de la monocapa leucocitaria de la sangre intracatéter podría ser útil para el aislamiento de los microorganismos colonizadores de la sangre intracatéter18.
TRATAMIENTO DE LA BACTERIEMIA RELACIONADA CON CATÉTER EN HEMODIÁLISIS
En la última revisión de las guías Infectious Diseases Society of America (IDSA)12 referente al tratamiento de la BRC en pacientes en HD se recomiendan las siguientes opciones de tratamiento según los síntomas y manifestaciones clínicas de los pacientes y los microorganismos aislados: 1) tratamiento antibiótico sistémico y retirada del CVC con requerimiento posterior de inserción de un nuevo CVC para HD; 2) tratamiento antibiótico sistémico y recambio de CVC sobre guía, o 3) tratamiento antibiótico sistémico y tratamiento conservador del CVC mediante sellado antibiótico (SA) (figura 3).
Inicialmente deben extraerse hemocultivos e instaurar un tratamiento empírico sistémico según la epidemiología microbiológica de cada centro. Si un paciente manifiesta síntomas de sepsis grave y/o de shock séptico, infección supurada en el punto de inserción del CVC o a lo largo del túnel subcutáneo, tromboflebitis supurada y/o complicaciones infecciosas a distancia (endocarditis o bacteriemia continua 72 horas después de haber iniciado tratamiento antibiótico adecuado), debe retirarse el CVC y continuar con el tratamiento antibiótico sistémico (evidencia AII)12.
El tratamiento empírico sistémico instaurado dependerá de la sintomatología clínica del paciente, de los factores de riesgo para la infección y de la localización del acceso vascular. Vancomicina es el antibiótico empírico recomendado para el tratamiento de aquellos centros con tasas elevadas de BCR por S. aureus resistentes a meticilina y estafilococos coagulasa negativos. Si S. aureus resistente a meticilina tiene una concentración mínima inhibitoria a vancomicina mayor o igual a 2 mg/l, debería utilizarse daptomicina (evidencia AII)12. No debe utilizarse vancomicina para el tratamiento de bacteriemias por S. aureus sensible a meticilina debido a la menor actividad de la vancomicina respecto a las penicilinas antiestafilocócicas (cloxacilina, cefazolina). Debe realizarse una valoración individual de los pacientes para ampliar la cobertura antibiótica empírica en caso de sospechar una infección por bacilos gramnegativos o Candida spp., en pacientes neutropénicos, sépticos o con factores de riesgo para la infección por estos microorganismos.
En el caso en el que el microorganismo aislado sea S. aureus, Pseudomonas aeruginosa, Candida spp. o micobacterias, el CVC debe retirarse y continuar con el tratamiento antibiótico sistémico adecuado para el microorganismo aislado (evidencia AII). La duración del tratamiento dependerá del microorganismo aislado y de si hay infecciones metastásicas (p. ej., BRC por S. aureus: tres semanas, BRC y endocarditis por S. aureus: seis semanas, BRC y osteomielitis por S. aureus: ocho semanas). En el caso de candidemia, el tratamiento antifúngico debe mantenerse hasta dos semanas después de aclarar la candidemia (figura 3).
En el caso de episodios de BRC no complicada en pacientes estables, sin signos de tunelitis o infección en el sitio de inserción, y causados por estafilococos coagulasa negativos, puede realizarse un tratamiento conservador mediante SA asociado con tratamiento sistémico (evidencia BII). Si el episodio de BRC está causado por microorganismos como Enterococcus spp. y Corynebaterium spp., no existe evidencia científica para recomendar tanto un tratamiento conservador como la retirada del catéter. Del Pozo, et al.19 demuestran la utilidad del SA asociado con terapia sistémica en BRC por estos microorganismos en pacientes estables.
La eficacia del SA ha sido demostrada en muchos estudios in vitro e in vivo19-22. El fundamento del SA consiste en instilar en la luz del CVC altas concentraciones de antibiótico, durante períodos prolongados20. Esta forma de tratamiento proporciona ventajas como una disminución de la toxicidad sistémica, una mayor eficacia del tratamiento frente a bacterias en biocapa, un menor riesgo de selección de microorganismos resistentes y un menor coste de tratamiento de la infección comparado con la retirada y reinserción de un nuevo acceso vascular20.
Las guías IDSA12 realizan recomendaciones para el empleo de SA en determinadas circunstancias clínicas, referenciando al tipo de antibiótico, la concentración empleada y la duración del SA, pero sin evidencias científicas. El SA combina heparina con el antibiótico más adecuado en función del microorganismo aislado y se instila al final de cada sesión de HD a través de cada una de las conexiones del catéter. La duración del tratamiento mediante SA no está establecida. Diferentes autores recomiendan la realización del SA de tres semanas12,16.
ESTRATEGIAS DE PREVENCIÓN DE LA INFECCIÓN RELACIONADA CON CATÉTER EN HEMODIÁLISIS
La prevención es una herramienta fundamental en la disminución de la incidencia de la BRC.
Asepsia en la inserción y manipulación de catéteres venosos centrales tunelizados
Los CVC tunelizados de pacientes en HD deben ser empleados, exclusivamente, para el procedimiento de la HD, deben ser manipulados por personal especializado y se deben seguir medidas estrictas de asepsia. El cumplimiento estricto de las medidas de asepsia durante el procedimiento quirúrgico de inserción del CVC tunelizado y los materiales (guantes, batas, mascarilla, gorro y paño estériles) también han demostrado una reducción en la incidencia de la infección (evidencia IB)16,23.
La profilaxis sistémica con vancomicina o teicoplanina durante la inserción del catéter o durante su manipulación no ha demostrado reducir la incidencia de BRC (evidencia IB)23.
La elección de la vena de inserción del CVC influye en el riesgo de flebitis y complicaciones infecciosas23. El riesgo de infección es mayor en CVC insertados en la vena yugular interna que en la subclavia12. Sin embargo, la trombosis y la estenosis limitan la inserción de los CVC en vena subclavia23. El riesgo de colonización y de trombosis venosa profunda es mayor en la vena femoral que en la subclavia o yugular interna3.
El punto de inserción y el túnel subcutáneo deben revisarse en cada sesión de HD para descartar complicaciones. Son útiles los apósitos estériles, transparentes y semipermeables para poder visualizar el punto de inserción del CVC y evitar manipulaciones innecesarias (evidencia IA)23. Los apósitos no deben macerar la piel. El recambio de gasas debe realizarse semanalmente, o cuando haya evidencia de exudado o sangrado (evidencia IB)23. La manipulación de las conexiones debe realizarse de forma aséptica (evidencia IA)23. Se recomienda realizar un lavado higiénico de manos, y utilizar campo y guantes estériles. Tanto el paciente como el personal sanitario deben utilizar mascarilla. Una vez conectado el CVC a las líneas del hemodializador, las conexiones deben cubrirse con una gasa estéril. La clorhexidina al 2% ha sido empleada eficazmente como antiséptico local en la zona de inserción del CVC y como desinfectante de las conexiones (evidencia IA)23.
Un adecuado ratio entre el número de enfermeras y pacientes y un control en la educación del personal sanitario responsable de la inserción y manipulación de los CVC tunelizados reducen significativamente el riesgo de BRC (evidencia IA)23.
Antibióticos/antisépticos en el punto de inserción
La asepsia de la piel, mediante desinfectantes, es necesaria antes de la inserción del acceso vascular, y durante su manipulación y limpieza (evidencia IA)23. Varios estudios han demostrado la eficacia de distintas soluciones como povidona yodada, pomada de triple antibióticos, alcohol y mupirocina, en la reducción de las tasas de infección del punto de inserción y BRC24-26. La clorhexidina al 2% se ha empleado de manera eficaz como antiséptico local en la zona de inserción del CVC (evidencia IA)23. El metanálisis de James, et al.27 demostró que el empleo de antibióticos tópicos redujo la incidencia de infección del punto de inserción del CVC y de la BRC. El empleo sistemático de antibióticos en el punto de inserción del CVC puede suponer un beneficio en la reducción de las tasas de infección a costa de la selección de microorganismos resistentes. Esta medida preventiva debería reservarse a aquellas unidades de diálisis con elevadas tasas de infección a pesar de cumplimentar las medidas básicas de asepsia en el procedimiento de inserción y manipulación del CVC.
Profilaxis mediante soluciones de sellado antibiótico o antiséptico
La profilaxis mediante soluciones de sellado consiste en la instilación de una solución antiséptica o antibiótica en cada una de las luces del CVC tunelizado, después de cada sesión de HD. Varios metanálisis confirman la efectividad de las soluciones de sellado con fines profilácticos27-29. Sin embargo, las guías K/DOQI30 no recomiendan el empleo sistemático de soluciones de sellado profiláctico.
La gentamicina (4-40 mg/ml) ha sido el antibiótico más utilizado, asociado con heparina o con citrato trisódico como solución anticoagulante31-35. Se han descrito efectos adversos, reversibles, como la ototoxicidad, a elevadas concentraciones de gentamicina31 y episodios de BRC causados por microorganismos resistentes a gentamicina35.
La vancomicina se ha empleado también como tratamiento profiláctico en pacientes portadores de CVC de larga duración32,36. Su empleo tiende a reservarse para evitar la selección de microorganismos resistentes y mantener así su utilidad como tratamiento sistémico de la BRC. Cefotaxima37 también se ha utilizado con éxito con este mismo objetivo.
Algunos estudios han evaluado la eficacia de la combinación de antibióticos como tratamiento profiláctico de amplio espectro: vancomicina/gentamicina/heparina33 y cefazolina/gentamicina38.
Las sustancias con actividad quelante y anticoagulante como el EDTA o el citrato trisódico han mostrado también su eficacia en la prevención y tratamiento de la BRC. Actúan quelando cationes metálicos, esenciales en la adherencia microbiana, en la formación de biocapas y en el crecimiento bacteriano. La eficacia del citrato trisódico como solución profiláctica ha sido evaluada en diferentes estudios, sola o combinada con otros antimicrobianos21,31,39,40. Su limitación fundamental es que puede producir hipocalcemia, arritmias ventriculares e incluso muerte súbita. La solución de EDTA ha sido empleada eficazmente como tratamiento in vitro sola o asociada con antibióticos21,41, y como tratamiento preventivo asociada con minociclina32,39,41. Las ventajas de la asociación minociclina/EDTA son el amplio espectro antimicrobiano y el efecto sinérgico de la combinación sin manifestaciones de toxicidad21.
La taurolidina es un agente anticoagulante y antimicrobiano de amplio espectro21,42 eficaz en la profilaxis de la BRC43. No se han descrito, hasta la fecha, resistencias.
Diferentes concentraciones de etanol (al 25, 60 y 70%) actúan como bactericidas y fungicidas de acción rápida y amplio espectro, debido a una actividad desnaturalizante de proteínas, previniendo de esta forma episodios de BRC44. Además, se ha descrito cierta actividad anticoagulante21. La combinación de etanol con antibióticos podría tener un efecto sinérgico. Se han descrito complicaciones asociadas con el paso de etanol a sangre periférica: colapso cardiovascular, embolismo pulmonar, intoxicación etílica, etc. Además, el etanol puede interaccionar con el material de los catéteres (p. ej., poliuretano).
Una de las principales ventajas que proporcionan los sellados con soluciones antisépticas, respecto a las soluciones antibióticas, es que los antisépticos no se emplean en el tratamiento de la BRC.
Varios autores23,28 recomiendan el empleo de soluciones de sellado profilácticas en aquellas unidades de HD con elevadas tasas de BRC a pesar de extremar las condiciones de asepsia en la inserción y manipulación de los CVC tunelizados, y en pacientes con factores de riesgo para el desarrollo de BRC.
Descolonización nasal
La incidencia de colonización nasal por S. aureus en pacientes en HD es elevada (30-60%). Esto contribuye a un aumento en la tasa de infección relacionada con catéter por S. aureus4,7-8. La eliminación del estado de portador nasal de S. aureus mediante mupirocina intranasal ha demostrado una disminución de las tasas de BRC por S. aureus45. La rifampicina oral también ha demostrado su eficacia en la descolonización nasal por S. aureus. El empleo sistemático de antibióticos para la descolonización nasal está limitado debido a la aparición de resistencias46. Además, en algunos casos al finalizar el tratamiento tópico se produce una recolonización temprana. La descontaminación realizada mediante un tratamiento local de corta duración, previa a la inserción del acceso vascular, está indicada, ya que reduce la tasa de infección relacionada con CVC de HD.
Monitorización de la colonización de catéteres venosos centrales tunelizados
Diferentes autores han desarrollado estudios microbiológicos de monitorización de la colonización endoluminal de los CVC para el diagnóstico precoz de la colonización significativa de catéter y BRC18,47-50. La utilidad de estos programas de monitorización depende, en parte, de la técnica de diagnóstico empleada. Hay pocos trabajos que evalúen la instauración de estrategias preventivas de BRC en los CVC colonizados18,47,49. Los tratamientos empleados en estos casos varían entre la retirada del CVC, antibioterapia sistémica y/o SA. A pesar de los buenos resultados obtenidos mediante la monitorización endoluminal, no existen recomendaciones sobre la necesidad de cultivos endoluminales de vigilancia.
1. El CVC tunelizado debe ser empleado como última opción de acceso vascular en pacientes con insuficiencia renal crónica en programas de HD.
2. La infección relacionada con CVC tunelizado es una de las principales causas de morbi-mortalidad en pacientes en HD.
3. La infección en este tipo de CVC de larga duración se produce por vía endoluminal.
4. Staphylococcus aureus y los estafilococos coagulasa negativos son los principales microorganismos implicados en estas infecciones.
5. El diagnóstico conservador de la BRC debe realizarse mediante la extracción de hemocultivos cuantitativos o convencionales, mediante el cálculo del tiempo diferencial, extrayendo sangre simultáneamente a través del CVC y mediante venopunción.
6. El tratamiento de la BRC dependerá de las manifestaciones clínicas del paciente y del microorganismo aislado. En el caso de aislarse estafilocos coagulasa negativos puede instaurarse un tratamiento conservador mediante tratamiento antibiótico sistémico y SA.
7. El cumplimiento estricto de las medidas de asepsia durante el procedimiento quirúrgico de inserción y manipulación de los CVC tunelizados es la medida preventiva fundamental de la BRC.
Figura 2a. Fundamento de las principales técnicas diagnósticas conservadoras para el diagnóstico de la bacteriemia relacionada con el catéter.
Figura 2b. Fundamento de las principales técnicas diagnósticas conservadoras para el diagnóstico de la bacteriemia relacionada con el catéter.
11016_18107_18466_es_11016_108_18466_es_11016_t1.doc
Tabla 1. Microorganismos aislados en episodios de bacteriemia relacionada con catéter en pacientes en programa regular de hemodiálisis
11016_18107_18468_es_11016_108_18468_es_11016_fig3.doc
Figura 3. Tratamiento de bacteriemia relacionada con catéter venoso central tunelizado en pacientes en hemodiálisis.
11016_18107_18472_es_11016_108_18472_es_jlpozofig1.ppt
Figura 1. Patogenia de la bacteriemia relacionada con catéter.