Describimos tres casos de pacientes sometidos a trasplantes renales y/o reno-pancreáticos que desarrollaron una Linfohistiocitosis Hemofagocítica (LHH) secundaria a infección por hongos o bacterias. A pesar de tratamiento específico contra el germen causante, la fiebre persistió junto con leucopenia y plaquetopenia progresiva sin mejoría hasta que se diagnosticó la LHH y se inició el tratamiento recomendado en esta entidad. Concluimos que la LHH, una rara entidad caracterizada por proliferación descontrolada e infiltración de diversos órganos de macrófagos y linfocitos T, debe ser sospechada ante todo paciente trasplantado con fiebre persistente y citopenias. El tratamiento con dosis altas de esteroides, inmunoglobulinas y ciclosporina puede modificar el pronóstico del cuadro cuya mortalidad es superior al 50% en esta población.
INTRODUCCIÓN
La linfohistiocitosis hemofagocítica (LHH), o síndrome hemofagocítico, es una rara entidad caracterizada por una hiperestimulación inefectiva del sistema inmune, cuyo pronóstico puede ser fatal si no se diagnostica y se trata apropiadamente. Los linfocitos estimulados e histiocitos que infiltran diferentes órganos segregando una gran cantidad de citoquinas son clave en la LLH. Se clasifica en dos grupos: «primaria o familiar» (LHHp), asociada con alteraciones genéticas y «secundaria o reactiva» (LHHs), asociada a infecciones o neoplasias. En ambos casos, el cuadro está desencadenado principalmente por un agente infeccioso y se caracteriza por fiebre, citopenia de, al menos, dos series hematológicas y alteraciones de las pruebas hepáticas; puede evolucionar hacia fallo multiorgánico y muerte, a pesar de tratamiento específico frente el agente desencadenante1-5.
La primera descripción, llevada a cabo por Risdall en 1979 en 19 pacientes, incluía a 13 pacientes sometidos a trasplante renal esplenectomizados6. Si bien en la publicación de Risdall se aconsejaba suprimir la inmunosupresión, un mejor conocimiento de esta entidad en la LHHp o LHHs en pacientes no sometidos a trasplante, indica que el tratamiento debe ir dirigido, además de al tratamiento específico frente al agente desencadenante, a suprimir la hiperrespuesta inflamatoria con agentes inmunosupresores o inmunomoduladores1-5,7.
El diagnóstico de la LHH no es fácil si el nefrólogo no es consciente de esta entidad, ya que las infecciones, la fiebre, las citopenias y las alteraciones de la analítica hepática son frecuentes tras el trasplante renal. Ante todo paciente sometido a un trasplante con fiebre no controlada a pesar de tratamiento específico, citopenia y disfunción multiorgánica, la LHH debe considerarse en el diagnóstico diferencial. A continuación presentamos tres casos diagnosticados en nuestro centro en los últimos años, el primero de los cuales ha sido publicado previamente8.
CASOS CLÍNICOS
Caso 1
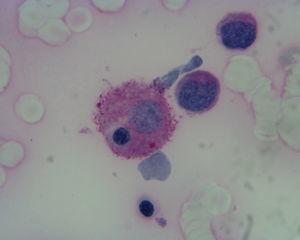
Paciente hombre de 41 años, diabético tipo 1 con insuficiencia renal crónica (IRC) y sometido a trasplante riñón-páncreas en abril de 2006. Recibió inmunosupresión con timoglobulina, tacrolimus, micofenolato mofetil (MMF) y prednisona y profilaxis infecciosa con vancomicina, cefotaxima, cotrimoxazol, valganciclovir y fluconazol. Once días después del alta reingresó por fiebre alta. En la analítica destacaban anemia moderada y neutrofilia. El sedimento urinario y la radiografía de tórax eran normales. La ecografía abdominal mostró una colección periinjerto pancreático. Se extrajeron hemocultivos y urocultivos y se inició tratamiento empírico con imipenem y fluconazol. En la punción eco-dirigida de la colección se detectó material purulento y se implantó un drenaje percutáneo, en el que creció Candida glabrata. Se sustituyó el fluconazol por caspofungina. Permaneció febril a pesar de que sus cultivos de sangre y orina eran negativos, de haberse descartado por diferentes métodos otras infecciones víricas (virus de las hepatitis C [VHC] y B [VHB], virus de la inmunodefiiencia humana [VIH], virus de Epstein-Barr [VEB], citomegalovirus [CMV], virus del herpes simple [VHS], virus varicela zóster [VVZ], herpes 6 y 8, parvovirus B19), y pruebas de imagen sin hallazgos patológicos. Las alteraciones analíticas (tabla 1) progresaron a pesar de suspenderse los fármacos (MMF, cotrimoxazol, valgaciclovir). Se mantuvo la inmunosupresión con prednisona (15 mg/día) y tacrolimus (10 mg/día), se añadió vancomicina y se sustituyó caspofungina por anfotericina B. En la tercera semana se detectó hiperferritinemia importante (22.280 ng/ml). Se realizó un aspirado de médula ósea en el que se apreció hemofagocitosis (figura 1). Ante la sospecha de HLH, el paciente fue tratado con dexametasona (40 mg/día, cinco días), así como con conversión de tacrolimus a ciclosporina A (8 mg/kg/día). A pesar de la bacteriemia por Pseudomonasaeruginosa que se trató según antibiograma, la fiebre desapareció a los tres días, con mejoría clínico-analítica progresiva y sin repercusión en la función de los injertos.
Caso 2
Paciente hombre de 33 años, diabético tipo 1 con IRC y sometido a trasplante de riñón-páncreas en octubre de 2006. Recibía tratamiento inmunosupresor y profilaxis infecciosa igual que los del caso 1. Al octavo día postrasplante presentó fiebre sin foco infeccioso evidente. Se realizaron radiografía de tórax y ecografía abdominal sin hallazgos significativos. Se extrajeron hemocultivos, urinocultivos y se inició tratamiento empírico con cefotaxima. Tras constatarse bacteriemia por P. aeruginosa se sustituyó la cefotaxima por imipenem según antibiograma. Los días siguientes presentó anemización y plaquetopenia, sin datos de sangrado, lo que se interpretó como secundario al imipenem, por lo que se sustituyó por ciprofloxacino. Tras cinco días sin fiebre, ésta apareció nuevamente con pruebas de imagen sin hallazgos patológicos, hemocultivos y urocultivos y pruebas diagnósticas de infección vírica (VHV, VHB y VIH, VEB, VHS, VVZ y CMV) negativos. Ante unos valores elevados de ferritina y triglicéridos (tabla 1), se realizó aspirado de médula ósea, en el que se observó hemofagocitosis. Se inició tratamiento con tres pulsos de metilprednisolona (posteriormente con prednisona a dosis de 60 mg/día), inmunoglobulinas intravenosas (0,5 mg/kg/día cuatro días) y se suspendió el MMF. A partir del tercer día de tratamiento, desapareció la distermia y mejoraron los parámetros analíticos (tabla 1). Hubo dos nuevos procesos infecciosos, sin alteraciones analíticas significativas, que respondieron a tratamiento específico. Fue dado de alta tras 40 días de ingreso, con buen estado clínico, normofunción de ambos injertos y con parámetros analíticos normalizándose.
Caso 3
Paciente hombre de 64 años de raza negra con IRC secundaria a poliquistosis renal, trasplantado de riñón en junio de 2009. Recibió inmunosupresión con timoglobulina, tacrolimus, MMF y prednisona. Evolucionó favorablemente con función inmediata del injerto. Se realizó profilaxis infecciosa con trimetoprima-sulfametoxazol y valganciclovir.
Un mes después del trasplante ingresó por fiebre, diarrea y síndrome confusional de 48 horas de evolución. En la analítica destacaban leucopenia con neutropenia, plaquetopenia, disfunción aguda del trasplante (creatinina: 3,1 mg/dl, basal: 1,3 mg/dl) y leve aumento de las enzimas hepáticas. La radiografía de tórax era normal y el sedimento urinario revelaba bacteriuria intensa y piuria. Ante los datos de sepsis, se disminuyó la dosis de tacrolimus y se comenzó tratamiento empírico con ciprofloxacino, cefepima y antifúngicos. Se supendieron MMF y trimetoprima-sulfametoxazol, además de administrarse factor estimulador de colonias de granulocitos (G-CSF). El tercer día postingreso, un hemocultivo fue positivo para Escherichia coli sensible a quinolonas, por lo que se suspendieron la cefalosporina y el antifúngico. El urinocultivo, el coprocultivo y la reacción en cadena de la polimerasa (PCR) del CMV fueron negativos. Una ecografía descartó el origen abdominal de la sepsis. En las 48-72 horas siguientes, las citopenias persistieron a pesar del control de la infección y de administrar nuevas dosis de G-CSF. Otros hallazgos analíticos significativos (tabla 1) fueron hipertrigliceridemia e hiperferritinemia. Al cuarto día se realizó un aspirado de médula ósea, en el que se constató la hemofagocitosis. Fue tratado con dexametasona (80 mg/día, cuatro días, y 40 mg/día, tres días) e inmunoglobulinas intravenosas (0,5 mg/Kg/día, siete días), sin conversión a ciclosporina. A las 24 horas se observó una recuperación significativa de la leucotrombopenia, con normalización progresiva de la analítica los días posteriores (tabla 1), incluida la función renal. Fue dado de alta tras 10 días de ingreso con evolución posterior sin incidencias.
DISCUSIÓN
Según nuestros conocimientos, ésta es la primera descripción de LHH en pacientes sometidos a trasplante renal adultos publicada en una revista de habla hispana. Si bien en los primeros 1.800 trasplantes realizados en nuestro centro, desde 1981 a 2006, no se diagnosticó ningún caso, en los trasplantes realizados en los últimos años la incidencia ha sido del 0,54%, muy similar a la descrita por Karras, et al., del 0,4%, en la serie más amplia publicada en varios centros de París9. Es muy posible, como se ha descrito previamente8-10, que la LHH esté infradiagnosticada y que algunas muertes por infección y fallo multiorgánico tras el trasplante renal se deban a este cuadro. Por otro lado, su aparición en pacientes en tratamiento con diálisis11, con enfermedades autoinmunes o inmunosuprimidos1,2,12, junto con la afectación renal que puede asociarse a la LHH, obliga a un mejor conocimiento del nefrólogo sobre esta entidad12.
Si bien la mayoría de los casos de LHH en el paciente sometido a trasplante renal se han asociado con infecciones víricas (CMV, adenovirus, VEB, virus del herpes humano 6-8, parvovirus B19 e incluso virus BK)10, toxoplasmosis, tuberculosis, lehismaniosis y procesos linfoproliferativos, también pueden desencadenarla9,10. En nuestra experiencia, el cuadro se debió a infección por hongos o bacterias, por lo que cualquier patógeno puede producirlo. La mortalidad en los casos publicados es superior al 50%, debido a sobreinfección por la neutropenia, como ocurrió en dos de nuestros pacientes y/o fallo multiorgánico10, por lo que es importante realizar un diagnóstico precoz.
Los criterios diagnósticos de la LHH, según la Histiocyte Society, se describen en la tabla 2, y se requieren al menos cinco de los ocho criterios para su confirmación7. Sin embargo, la mayoría de los autores están de acuerdo de iniciar tratamiento ante la sospecha del cuadro aún antes de completar el diagnóstico1-4. Por otro lado, la presencia de hemofagocitosis (igura 1) en el aspirado de médula ósea puede no observarse en las fases tempranas de la enfermedad, por lo que recientemente se han propuesto criterios más amplios para el diagnóstico de la LHH4 (tabla 3). Debe tenerse en cuenta que el cuadro puede remedar un gran número de situaciones en el trasplante renal como fiebre de origen desconocido, hepatitis, encefalitis, síndrome de distrés respiratorio del adulto, o fallo multiorgánico y anemia hemolítica microangiopática, entre otros8,10.
El tratamiento de la LHH en el paciente sometido a trasplante no está claramente definido. Mientras que algunos autores proponen un tratamiento intensivo frente al germen causante, junto con la administración de ciclosporina y dexametasona3, otros abogan por suprimir la inmunosupresión y administrar pulsos de metilprednisolona (500 mg durante tres días) seguidos de dosis de 60-80 mg varios días, junto con inmunoglobulinas intravenosas (0,4 mg/kg a días alternos, de tres a cinco dosis) y plasmaféresis o leucocitoféresis en los casos refractarios. Es lógico, en muchos cuadros infecciosos tras el trasplante renal, reducir la inmunosupresión, aun a riesgo de pérdida del injerto por rechazo. Sin embargo, teniendo en cuenta la etiopatogenia de la LHH, en la que se produce una proliferación desmesurada de histiocitos, macrófagos y linfocitos T activados que infiltran diversos órganos produciendo hipercitoquinemia, nosotros hemos utilizado dosis altas de esteroides (dexametasona o metilprenisolona), manteniendo el anticalcineurínico, suprimiendo el micofenolato mofetil y, en dos casos, asociando inmunoglobulinas. El empleo de dexametaona está indicado en pacientes con afectación del sistema nervioso central, dado que atraviesa la barrera hematoencefálica, lo que es frecuente en niños que desarrollan una LHH1-4,7. Por otro lado, las ventajas de la ciclosporina frente a tacrolimus se desconocen, y se emplea la primera en el caso 1 porque está indicada en el protocolo HLH-20043,7.
Aunque en nuestras experiencia la LHH se produjo en el primer mes postrasplante, puede producirse más tardíamente10. En el caso 1, fue la fiebre persistente, junto con cifras elevadas de ferritina, citopenia extrema y alteración progresiva de la analítica hepática, lo que nos puso en alerta, siendo diagnóstico el aspirado de médula ósea. A pesar de haberse resuelto el cuadro que lo desencadenó, el deterioro del paciente progresó, mostrando datos que se han asociado con la mortalidad, tanto en pacientes sometidos a trasplante como en inmunocompetentes9,12. La llamativa respuesta a la dexametasona y a la ciclosporina indica que, una vez iniciado el tratamiento específico del agente desencadenante, ésta puede ser una terapia adecuada en el trasplante renal con LHH. La utilización de inmunoglobulinas intravenosas parece una buena opción dada su actividad aditiva en el tratamiento de la sepsis13.
En conclusión, creemos que en todo paciente sometido a trasplante renal con fiebre persistente, citopenias y alteración de las pruebas hepáticas, debe considerarse la posibilidad de que exista una LHH mediante las pruebas diagnósticas necesarias. Una vez diagnosticado e iniciado el tratamiento específico del germen etiológico, la administración de dosis altas de esteroides e inmunoglobulinas puede ser el primer escalón del tratamiento seguido de conversión a ciclosporina y asociando plasmaféresis en casos refractarios.
Figura 1. Fenómeno de hemofagocitosis (fagocitosis de un eritroblasto) (PAS, x1.000)
10324_18107_2074_es_10324_18017_2074_es_tabla1.doc
Tabla 1. Alteraciones analíticas en el momento del diagnóstico y al alta de los tres pacientes con linfohistiocitosis hemofagocítica
10324_18107_2076_es_10324_18017_2076_es_tabla2_copy2.doc
Tabla 2. Criterios diagnósticos de linfohistiocitosis hemofagocítica
10324_18107_2078_es_10324_18017_2078_es_tabla3.doc
Tabla 3. Criterios propuestos para el diagnóstico de linfohistiocitosis hemofagocítica en 2009 (4)