La hipercaliemia (HK) es un hallazgo frecuente en la enfermedad renal crónica (ERC), sobre todo en sus estadios más avanzados. El mecanismo patogénico más común de esta alteración es la ingesta-absorción de potasio que sobrepasa la capacidad excretora renal. La investigación sobre el papel relativo de cada uno de los elementos patogénicos en el desarrollo de HK podría ayudar a su tratamiento.
ObjetivoAnalizar el manejo renal de potasio en pacientes con ERC avanzada prediálisis, y establecer qué diferencias existen entre los que presentan o no HK.
Material y métodosEstudio transversal de observación en pacientes adultos con ERC estadio 4-5 prediálisis. Entre los pacientes incidentes en la consulta ERCA se seleccionaron aquellos clínicamente estables con capacidad para recoger adecuadamente la orina de 24horas. Se midieron parámetros bioquímicos en sangre y orina que incluyeron las concentraciones de sodio y potasio (K). Se calculó la fracción de excreción de K (FEK) y la carga de K relativa al filtrado glomerular (Ko/FG). Se definió la HK como una concentración de K sérico ≥5,5mmol/l.
ResultadosSe incluyeron 212 pacientes (edad 65±14 años, 92 mujeres) con un FG 15,0±4,2ml/min/1,73m2. Sesenta y tres pacientes (30%) presentaban HK. Los pacientes con HK tenían un bicarbonato sérico más bajo (20,3±3,1 vs. 22,8±3,2mEq/l, p<0,0001), y un menor filtrado glomerular (14,1±3,3 vs. 15,4±4,4ml/min/1,73 m2, p=0,028), pero no mostraban diferencias en la excreción urinaria total de sodio o K. La FEK era inferior en los pacientes con HK con respecto a los que presentaban normocaliemia (32,1±12,1% vs. 36,4±14,3%, p=0,038), mientras que la Ko/FG fue mayor (4,2±1,5 vs. 3,7±1,4mmol por cada ml/min, p=0,049). Existía una fuerte correlación lineal entre Ko/FG y FEK (R2=0,74), y en regresiones parciales se observó que a igual carga de K, la FEK era inferior en los pacientes con HK. Mediante regresión lineal y regresión logística multivariable, tanto la FEK como la Ko/FG fueron los principales determinantes del K sérico y de la HK.
ConclusionesAunque la carga de K relativa a la función renal (Ko/FG) se asocia de forma relevante a la HK de la ERC, la principal característica asociada a esta alteración bioquímica es la incompleta excreción renal compensatoria de K, expresada como una menor FEK.
Hyperkalemia (HK) is a common electrolyte disorder in chronic kidney disease (CKD), mainly in the advanced stages. A positive potassium balance due to reduced renal excretory capacity is likely the main pathogenic mechanism of HK. Research into the relative role of each pathogenic element in the development of HK in CKD may help to implement more suitable therapies.
ObjectiveTo investigate renal potassium handling in advanced CKD patients, and to determine the differences between patients with or without HK.
Material and methodsCross-sectional observational study in adult patients with stage 4-5 CKD pre-dialysis. Selection criteria included clinically stable patients and the ability to collect a 24hour urine sample correctly. Blood and urinary biochemical parameters were analysed including sodium and potassium (K). Fractional excretion of K (FEK) and K load relative to glomerular filtration (Ku/GFR) were calculated. HK was defined as a serum K concentration ≥5.5mmol/l.
ResultsThe study group consisted of 212 patients (mean age 65±14 years, 92 females) with a mean GFR of 15.0±4.2ml/min/1.73m2. 63 patients (30%) had HK. Patients with HK had lower mean bicarbonate levels with respect to patients with normal K levels (NK) (20.3±3.1 vs. 22.8±3.2 mEq/l, P<.0001), but no differences were noted in total urinary sodium and K excretion. While mean FEK values were lower in patients with HK (32.1±12.1% vs. 36.4±14.3%, P=.038), Ku/GFR values were significantly greater with respect to the NK subgroup (4.2±1.5 vs. 3.7±1.4 mmol/ml/min, P=0,049). FEK showed a strong linear correlation with Ku/GFR (R2=0.74), and partial linear regressions demonstrated that at a similar Ku/GFR level, the FEK of patients with HK was lower than that of NK patients. By multivariate linear and logistic regression analyses, both FEK and Ku/GFR were shown to be the main determinants of K serum levels and HK.
ConclusionsAlthough the K load relative to glomerular filtration (Ku/GFR) is an important determinant of HK in advanced CKD, the most noteworthy characteristic associated with HK in these patients was the limitation of compensatory urinary K excretion, as indicated by lower FEK.
La hipercaliemia (HK) es una alteración electrolítica frecuente en la enfermedad renal crónica (ERC), sobre todo en sus estadios más avanzados1–5.
Los principales mecanismos patogénicos involucrados en el desarrollo de HK en la ERC son6–12: una ingesta-absorción de K que sobrepasa la capacidad de excreción renal, que a su vez puede estar limitada por interferencia en los mecanismos de compensación tubular, especialmente los relacionados con la concentración y/o acción de la aldosterona en el túbulo distal. Además, se puede añadir un componente de redistribución del K intracelular debido a acidosis metabólica, sobre todo la forma mineral —no la causada por ácidos orgánicos—13,14.
A pesar del cúmulo de factores predisponentes al desarrollo de HK, el riñón es capaz de mantener el balance de K hasta que el filtrado glomerular desciende por debajo de los 10-15ml/min8,9,11. Las adaptaciones para normalizar los niveles de K incluyen un aumento de la secreción tubular de K que eventualmente conduce a un nuevo estado de equilibrio de los niveles de K, que con frecuencia se mantienen más elevados de lo normal (HK crónica)6–12. También el incremento de la excreción intestinal de K es otro mecanismo adaptativo que se desarrolla de forma gradual en pacientes con ERC6,15,16.
La información sobre el manejo de K en la ERC procede principalmente de la traslación de los resultados de investigaciones experimentales6–12, pero que hacen difícil contestar preguntas que con frecuencia se plantean los clínicos en la práctica real, tales como: ¿la HK en la ERC es solo la consecuencia de una mayor carga (dietética) de K?, ¿cuánta es la carga diaria segura de K en relación con un determinado filtrado glomerular?, ¿qué niveles de compensación de excreción renal de K se pueden alcanzar en la ERC avanzada?, ¿cuáles son los principales factores determinantes de la HK crónica en estos pacientes? La investigación sobre estas cuestiones podría ser de utilidad en la estrategia de manejo de la HK en la ERC avanzada.
Con el objetivo de investigar el manejo del potasio en condiciones clínicas reales en pacientes con ERC avanzada se realizó este estudio de observación transversal, en el que además se analizan las principales diferencias entre aquellos que presentan o no HK.
Material y métodosEstudio transversal de observación en una cohorte de pacientes adultos con ERC estadio 4-5 prediálisis. Entre los pacientes incidentes en la consulta ERCA durante el periodo comprendido entre septiembre 2009 a mayo 2015 se seleccionaron aquellos con edad mayor de 18 años, filtrado glomerular estimado<30ml/min/1,73 m2, y tener capacidad para recoger correctamente la orina de 24horas (ver más adelante la definición de este criterio).
Se excluyeron pacientes con inestabilidad clínica (insuficiencia cardiaca, hepática, respiratoria, oncológicos, infecciosos activos, estados hipercatabólicos o alteraciones digestivas graves), fracaso renal agudo reciente, tratamiento con diuréticos ahorradores de K (espironolactona o eplerenona), corticoides, fludrocortisona o resinas de intercambio catiónico.
Incluidos en la rutina clínica de esta consulta ERCA, además de los parámetros bioquímicos convencionales en sangre —urea, creatinina, albúmina, sodio, cloro, potasio y bicarbonato— también se determinó en todos los pacientes las concentraciones de creatinina, urea, sodio y potasio en orina recogida durante las 24horas previas a la extracción de muestras de sangre.
Las determinaciones bioquímicas se realizaron por métodos de laboratorio convencionales (Advia Chemistry, Siemens Healthcare Diagnostics).
El filtrado glomerular fue estimado mediante la fórmula abreviada MDRD17.
La medición de la concentración de K fue en suero, no en plasma. Para detectar posibles interferencias y errores en la medición del K sérico se realizó revisión sistemática mediante índice hemolítico (IH), y todas las muestras con un valor considerado como de interferencia significativa (IH>40) fueron descartadas.
Para comprobar la fiabilidad de la recogida de orina de 24horas se comparó la excreción total de creatinina medida con la esperable según las características antropométricas de acuerdo a la fórmula de Ix et al.18. Como criterio de selección para la inclusión en el estudio, la creatinina total en orina no debía diferir de la creatinina estimada en ±20%.
Mediante la excreción urinaria total de nitrógeno ureico se calculó la tasa de catabolismo proteico por la fórmula de Maroni et al.19.
La cantidad de K recogida en la orina de 24horas fue tomada como carga total de K, haciendo referencia este parámetro al valor aproximado del K ingerido-absorbido, menos la cantidad excretada en el intestino, asumiendo como constantes en todos los pacientes tanto la cantidad excretada por el intestino como el balance endógeno.
Se calculó la fracción de excreción de K (FEK) según la fórmula:
FEK=K orina x Cr sangre/K sangre x Cr orina x 100, expresada en %,
y la carga de K relativa al filtrado glomerular (Ko/FG):
Ko/FG=K orina 24 h/filtrado glomerular, donde el filtrado glomerular se midió por la fórmula Brochner-Mortensen20:
FG=aclaramiento creatinina+aclarameiento urea/2, expresado en ml/min/1,73m2.
También se calculó la generación endógena neta de ácidos según la fórmula de Frassetto et al.21.
Se definió la HK como una concentración de K sérico≥5,5 mEq/l.
La inclusión de datos de los pacientes seleccionados se realizó en la primera visita a la consulta ERCA, previamente a que los pacientes estuvieran instruidos para realizar cualquier restricción en la dieta, aunque es reseñable la tendencia que tenían a restringir algunos alimentos ricos en K por conocimiento vulgar o por recomendaciones de sus médicos especialistas en nefrología o de atención primaria.
Diseño del estudio y análisis estadísticoEstudio de observación transversal en el que se analizaron los datos recogidos en los pacientes seleccionados, comparándose los parámetros de interés entre los que presentaban o no HK.
Para la comparación descriptiva de las variables continuas, y dependiendo de sus características, se emplearon pruebas paramétricas o no-paramétricas, y para las variables categóricas se utilizó la prueba Chi cuadrado. Para determinar si la distribución de una variable cuantitativa seguía un patrón normal se utilizó la prueba de Kolmogorov-Smirnov.
En el grupo total de estudio se analizaron los mejores determinantes de la existencia de HK mediante regresión logística multivariante. Para establecer la existencia de asociación entre variables continuas y representarla gráficamente se utilizó análisis de regresión lineal simple, y para investigar los mejores determinantes de la caliemia (como variable continua) se utilizó la regresión lineal múltiple. Para cuantificar la bondad de ajuste del modelo se calculó el coeficiente de determinación (R2). Para evitar el sobreajuste en los modelos multivariantes se forzó la entrada de las variables con al menos una significación de p≤0,01, con selección automática condicional hacia atrás. Se realizó examen de multicolinealidad calculando el factor de inflación de la varianza (FIV). Se consideró que alguna de las variables incluidas en los modelos multivariantes tenía colinealidad significativa si el FIV era>10.
Los datos se presentan como media±desviación estándar. Una p<0,05 indicó significación estadística. El análisis estadístico y los gráficos se realizaron con el programa SPSS versión 24.0 (IBM Corp. Armonk, EE. UU.).
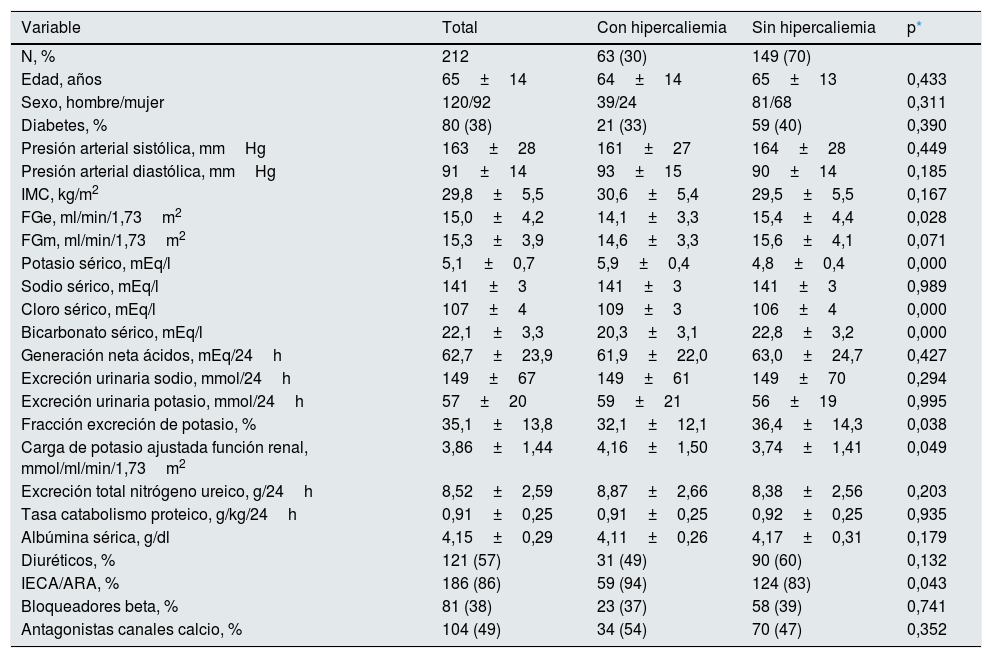
ResultadosDurante el periodo de inclusión fueron estudiados 608 pacientes incidentes en la consulta ERCA, de los que 54 fueron excluidos por presentar inestabilidad clínica o fracaso renal agudo reciente, 17 por muestras con alto índice hemolítico, 27 por tratamiento con resinas de intercambio catiónico, 10 por tratamiento con diuréticos ahorradores de K y 288 no fueron incluidos por incumplir los criterios de correcta recogida de la orina de 24horas. Así, los pacientes finalmente incluidos en el estudio fueron 212 con las características demográficas, clínicas y bioquímicas que se muestran en la tabla 1.
Características demográficas, clínicas y bioquímicas del grupo total de estudio, y según la presencia de hiperkaliemia
| Variable | Total | Con hipercaliemia | Sin hipercaliemia | p* |
|---|---|---|---|---|
| N, % | 212 | 63 (30) | 149 (70) | |
| Edad, años | 65±14 | 64±14 | 65±13 | 0,433 |
| Sexo, hombre/mujer | 120/92 | 39/24 | 81/68 | 0,311 |
| Diabetes, % | 80 (38) | 21 (33) | 59 (40) | 0,390 |
| Presión arterial sistólica, mmHg | 163±28 | 161±27 | 164±28 | 0,449 |
| Presión arterial diastólica, mmHg | 91±14 | 93±15 | 90±14 | 0,185 |
| IMC, kg/m2 | 29,8±5,5 | 30,6±5,4 | 29,5±5,5 | 0,167 |
| FGe, ml/min/1,73m2 | 15,0±4,2 | 14,1±3,3 | 15,4±4,4 | 0,028 |
| FGm, ml/min/1,73m2 | 15,3±3,9 | 14,6±3,3 | 15,6±4,1 | 0,071 |
| Potasio sérico, mEq/l | 5,1±0,7 | 5,9±0,4 | 4,8±0,4 | 0,000 |
| Sodio sérico, mEq/l | 141±3 | 141±3 | 141±3 | 0,989 |
| Cloro sérico, mEq/l | 107±4 | 109±3 | 106±4 | 0,000 |
| Bicarbonato sérico, mEq/l | 22,1±3,3 | 20,3±3,1 | 22,8±3,2 | 0,000 |
| Generación neta ácidos, mEq/24h | 62,7±23,9 | 61,9±22,0 | 63,0±24,7 | 0,427 |
| Excreción urinaria sodio, mmol/24h | 149±67 | 149±61 | 149±70 | 0,294 |
| Excreción urinaria potasio, mmol/24h | 57±20 | 59±21 | 56±19 | 0,995 |
| Fracción excreción de potasio, % | 35,1±13,8 | 32,1±12,1 | 36,4±14,3 | 0,038 |
| Carga de potasio ajustada función renal, mmol/ml/min/1,73m2 | 3,86±1,44 | 4,16±1,50 | 3,74±1,41 | 0,049 |
| Excreción total nitrógeno ureico, g/24h | 8,52±2,59 | 8,87±2,66 | 8,38±2,56 | 0,203 |
| Tasa catabolismo proteico, g/kg/24h | 0,91±0,25 | 0,91±0,25 | 0,92±0,25 | 0,935 |
| Albúmina sérica, g/dl | 4,15±0,29 | 4,11±0,26 | 4,17±0,31 | 0,179 |
| Diuréticos, % | 121 (57) | 31 (49) | 90 (60) | 0,132 |
| IECA/ARA, % | 186 (86) | 59 (94) | 124 (83) | 0,043 |
| Bloqueadores beta, % | 81 (38) | 23 (37) | 58 (39) | 0,741 |
| Antagonistas canales calcio, % | 104 (49) | 34 (54) | 70 (47) | 0,352 |
FGe: filtrado glomerular estimado (MDRD); FGm: filtrado glomerular medido (ecuación Bröchner-Mortensen).
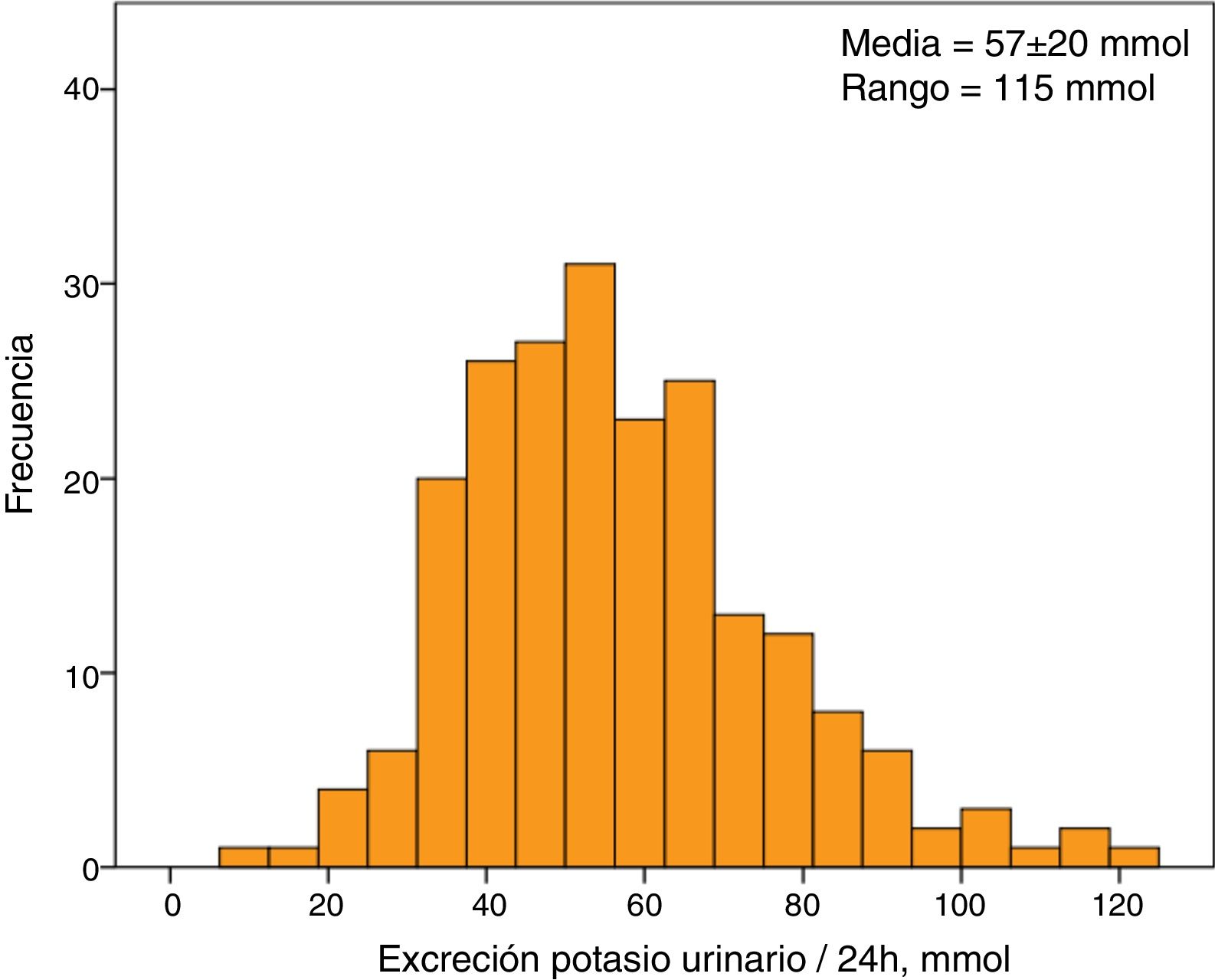
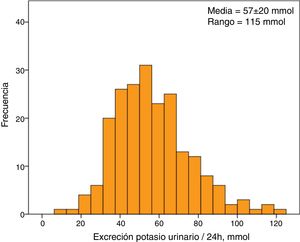
La caliemia media del grupo estudiado fue de 5,1±0,7mmol/l. Un 30% de ellos (63 pacientes) mostraba HK. La excreción media de K en orina de 24horas fue de 57±20mmol, con un valor mínimo de 8mmol y uno máximo de 123mmol. La distribución de los valores de excreción de K en orina siguió una distribución normal (fig. 1).
Los pacientes del sexo masculino mostraron una significativa mayor excreción urinaria tanto de K (62±20 vs. 49±17 mmol/24h, p<0,0001) como de sodio (168±71 vs. 123±53mmol/24h, p<0,0001) con respecto a las mujeres.
Las principales diferencias entre los que mostraban o no HK fueron: una función renal ligeramente más reducida, con más acidosis metabólica y más frecuentemente tratados con inhibidores del sistema renina-angiotensina (IECA/ARA 2).
No se observaron diferencias en la excreción urinaria absoluta de K y de sodio entre aquellos pacientes con o sin HK. Sin embargo, al ajustar la cantidad total de K que se recogía en orina al grado de insuficiencia renal, es decir, la carga de K por cada ml/min/1,73m2 de filtrado glomerular (Ko/FG), sí se observaban diferencias significativas, siendo la media de este parámetro más elevada en los pacientes con HK con respecto a los que presentaban cifras normales de K (tabla 1).
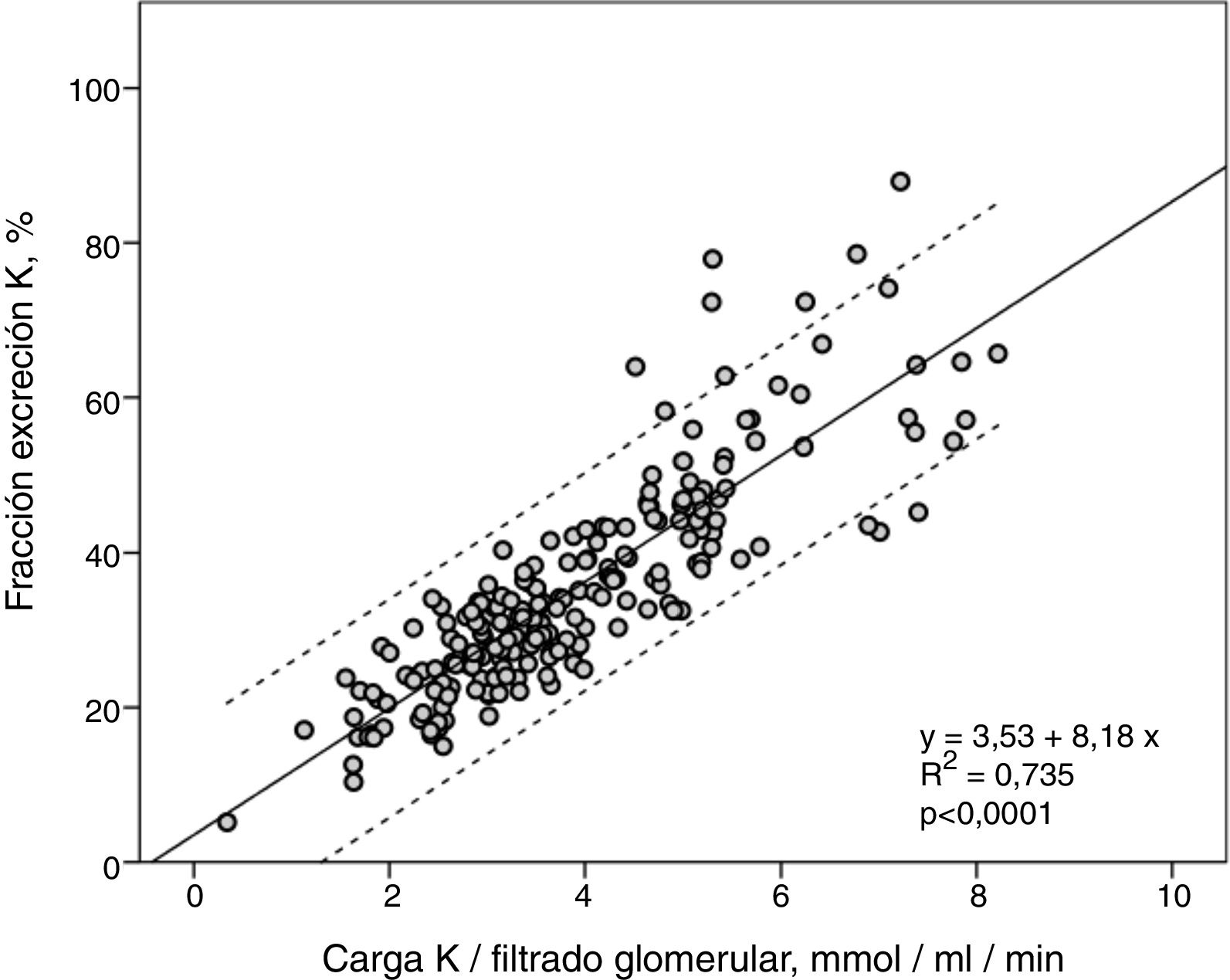
La fracción de excreción de K (FEK) mostró una gran amplitud en la distribución de sus cifras oscilantes entre un mínimo del 5% y un máximo del 88%. La FEK media fue significativamente inferior en los pacientes con HK (tabla 1).
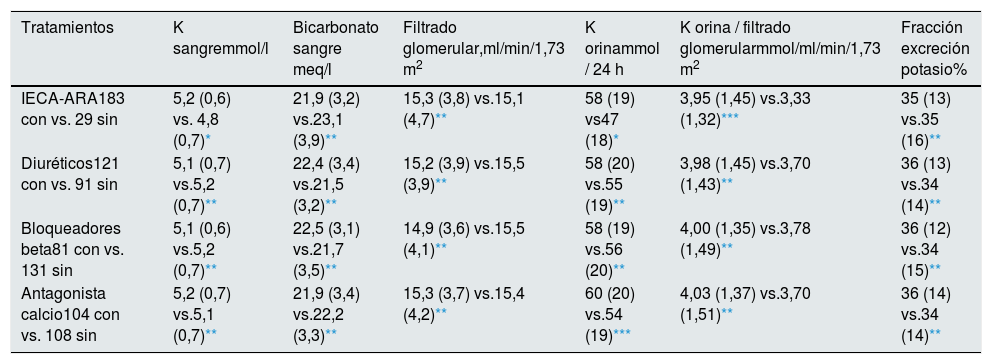
Las diferencias en los principales parámetros de estudio según la medicación prescrita se muestran en la tabla 2.
Diferencias en los principales parámetros de estudio según la medicación prescrita a los pacientes
| Tratamientos | K sangremmol/l | Bicarbonato sangre meq/l | Filtrado glomerular,ml/min/1,73 m2 | K orinammol / 24 h | K orina / filtrado glomerularmmol/ml/min/1,73 m2 | Fracción excreción potasio% |
|---|---|---|---|---|---|---|
| IECA-ARA183 con vs. 29 sin | 5,2 (0,6) vs. 4,8 (0,7)* | 21,9 (3,2) vs.23,1 (3,9)** | 15,3 (3,8) vs.15,1 (4,7)** | 58 (19) vs47 (18)* | 3,95 (1,45) vs.3,33 (1,32)*** | 35 (13) vs.35 (16)** |
| Diuréticos121 con vs. 91 sin | 5,1 (0,7) vs.5,2 (0,7)** | 22,4 (3,4) vs.21,5 (3,2)** | 15,2 (3,9) vs.15,5 (3,9)** | 58 (20) vs.55 (19)** | 3,98 (1,45) vs.3,70 (1,43)** | 36 (13) vs.34 (14)** |
| Bloqueadores beta81 con vs. 131 sin | 5,1 (0,6) vs.5,2 (0,7)** | 22,5 (3,1) vs.21,7 (3,5)** | 14,9 (3,6) vs.15,5 (4,1)** | 58 (19) vs.56 (20)** | 4,00 (1,35) vs.3,78 (1,49)** | 36 (12) vs.34 (15)** |
| Antagonista calcio104 con vs. 108 sin | 5,2 (0,7) vs.5,1 (0,7)** | 21,9 (3,4) vs.22,2 (3,3)** | 15,3 (3,7) vs.15,4 (4,2)** | 60 (20) vs.54 (19)*** | 4,03 (1,37) vs.3,70 (1,51)** | 36 (14) vs.34 (14)** |
Con vs. sin: número pacientes en tratamiento con o sin el fármaco en estudio.
Niveles de significación estadística:
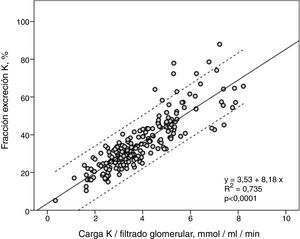
La FEK y la Ko/FG mostraron una fuerte correlación lineal (R2=0,74) (fig. 2), de tal forma que, a mayor carga de K por unidad de función renal más elevada era la FEK.
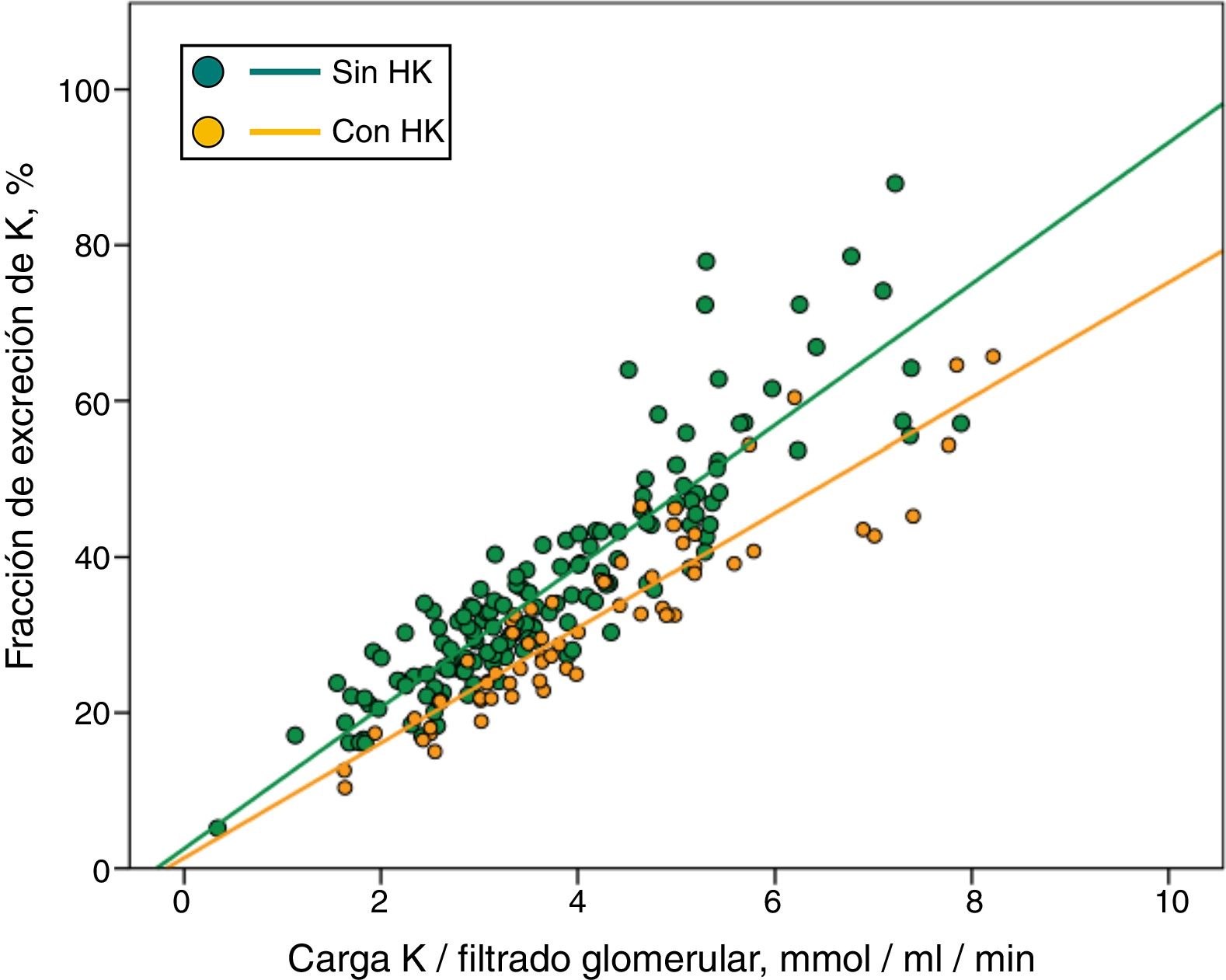
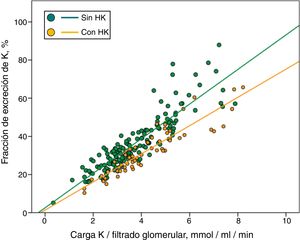
Cuando en regresiones parciales se dividieron los pacientes con o sin HK (fig. 3), se observó que a igual carga de Ko/FG, la FEK era inferior en los que mostraba HK.
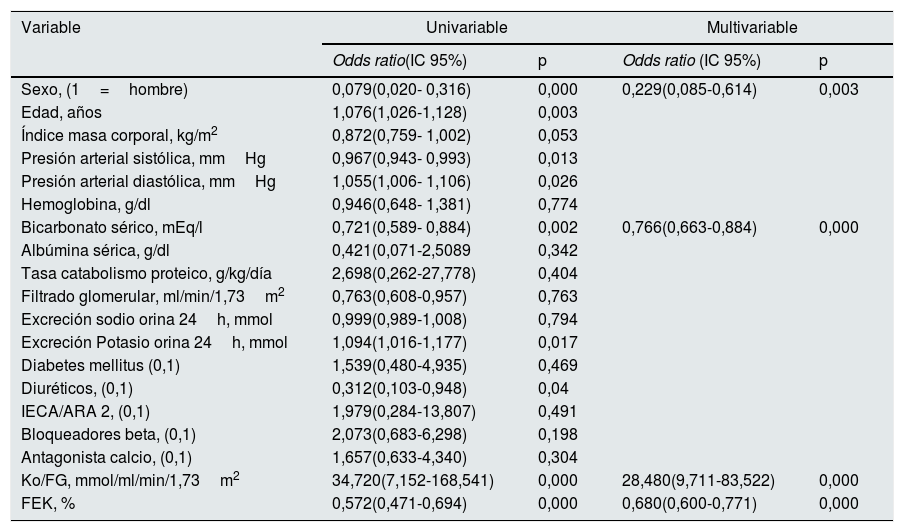
Por regresión logística multivariable los principales determinantes de la presencia de HK en este grupo de pacientes fueron (tabla 3): el sexo (los hombres mostrarían una menor probabilidad para el desarrollo de HK si se tienen en cuenta el resto de las variables), el bicarbonato sérico (relación inversa con el riesgo de HK), pero sobre todo la carga de K por unidad de función renal (Ko/FG) y la FEK.
Regresión logística sobre los determinantes de la presencia de hipercaliemia en el grupo de estudio
| Variable | Univariable | Multivariable | ||
|---|---|---|---|---|
| Odds ratio(IC 95%) | p | Odds ratio (IC 95%) | p | |
| Sexo, (1=hombre) | 0,079(0,020- 0,316) | 0,000 | 0,229(0,085-0,614) | 0,003 |
| Edad, años | 1,076(1,026-1,128) | 0,003 | ||
| Índice masa corporal, kg/m2 | 0,872(0,759- 1,002) | 0,053 | ||
| Presión arterial sistólica, mmHg | 0,967(0,943- 0,993) | 0,013 | ||
| Presión arterial diastólica, mmHg | 1,055(1,006- 1,106) | 0,026 | ||
| Hemoglobina, g/dl | 0,946(0,648- 1,381) | 0,774 | ||
| Bicarbonato sérico, mEq/l | 0,721(0,589- 0,884) | 0,002 | 0,766(0,663-0,884) | 0,000 |
| Albúmina sérica, g/dl | 0,421(0,071-2,5089 | 0,342 | ||
| Tasa catabolismo proteico, g/kg/día | 2,698(0,262-27,778) | 0,404 | ||
| Filtrado glomerular, ml/min/1,73m2 | 0,763(0,608-0,957) | 0,763 | ||
| Excreción sodio orina 24h, mmol | 0,999(0,989-1,008) | 0,794 | ||
| Excreción Potasio orina 24h, mmol | 1,094(1,016-1,177) | 0,017 | ||
| Diabetes mellitus (0,1) | 1,539(0,480-4,935) | 0,469 | ||
| Diuréticos, (0,1) | 0,312(0,103-0,948) | 0,04 | ||
| IECA/ARA 2, (0,1) | 1,979(0,284-13,807) | 0,491 | ||
| Bloqueadores beta, (0,1) | 2,073(0,683-6,298) | 0,198 | ||
| Antagonista calcio, (0,1) | 1,657(0,633-4,340) | 0,304 | ||
| Ko/FG, mmol/ml/min/1,73m2 | 34,720(7,152-168,541) | 0,000 | 28,480(9,711-83,522) | 0,000 |
| FEK, % | 0,572(0,471-0,694) | 0,000 | 0,680(0,600-0,771) | 0,000 |
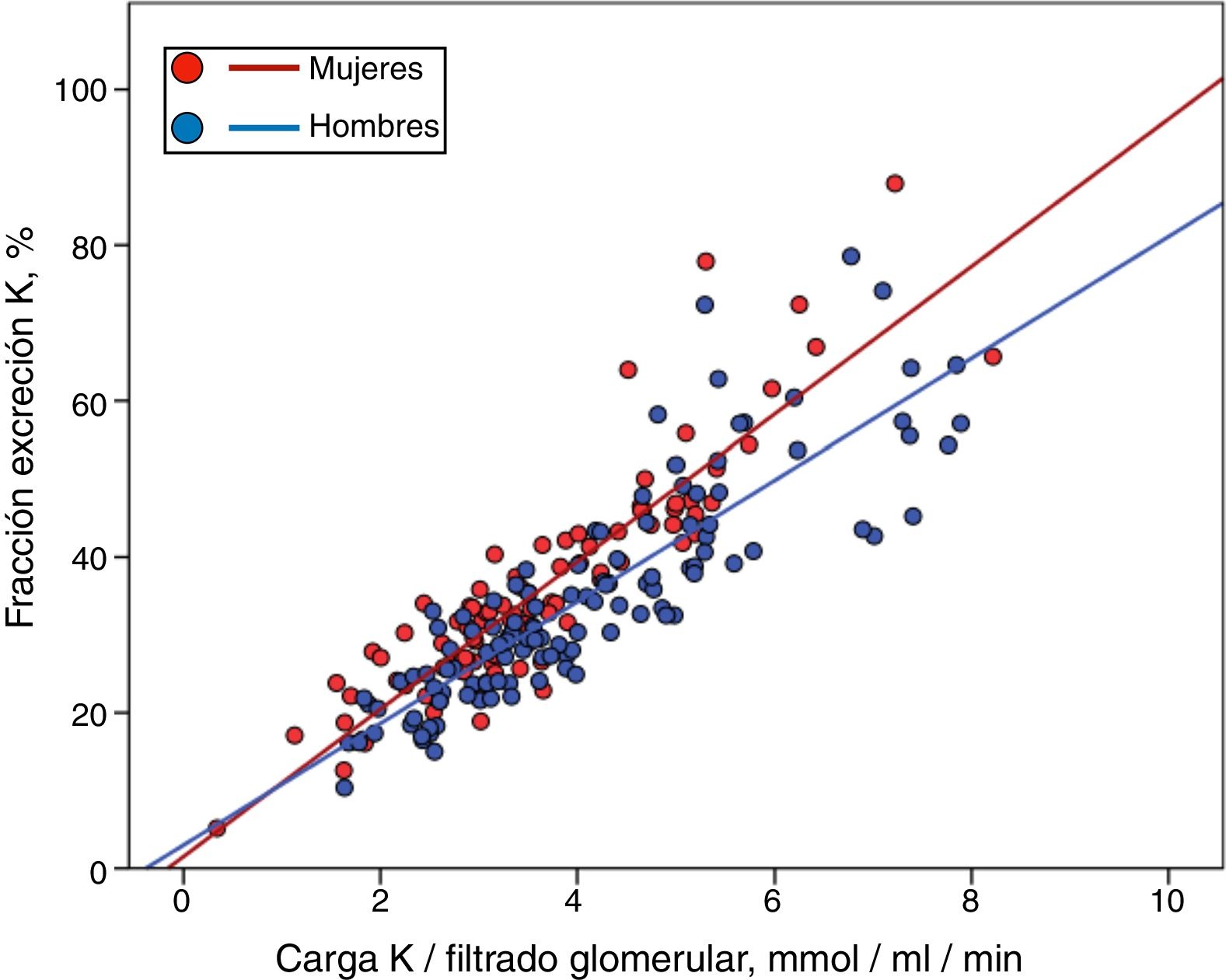
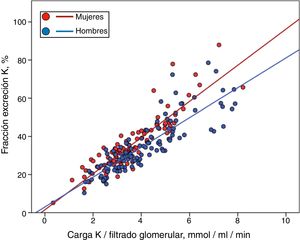
Aunque los hombres mostraron un porcentaje más elevado, pero no significativo, de HK que las mujeres (33% vs. 26%), estos presentaban también una mayor carga de K por unidad de función renal (Ko/FG 4,06±1,51 vs. 3,61±1,33mmol/ml/min/1,73m2; p=0,027), pero no una mayor FEK (34,7±13,6% vs. 35,7±14,1%, p=0,581). De este modo, cuando se representó de forma separada la relación entre la Ko/FG y la FEK según el sexo, se observó que los hombres tenían una menor pendiente de compensación ante una determinada carga de K (fig. 4) (para una más extensa explicación de este hallazgo ver apartado «Discusión»).
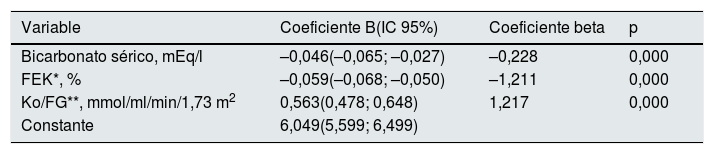
Mediante regresión lineal múltiple, los principales determinantes de las cifras de K sérico fueron (tabla 4): el bicarbonato sérico, la Ko/FG y la FEK.
Regresión lineal múltiple: mejores determinantes de los valores de K sérico
| Variable | Coeficiente B(IC 95%) | Coeficiente beta | p |
|---|---|---|---|
| Bicarbonato sérico, mEq/l | –0,046(–0,065; –0,027) | –0,228 | 0,000 |
| FEK*, % | –0,059(–0,068; –0,050) | –1,211 | 0,000 |
| Ko/FG**, mmol/ml/min/1,73 m2 | 0,563(0,478; 0,648) | 1,217 | 0,000 |
| Constante | 6,049(5,599; 6,499) |
Variables fuera de la mejor ecuación predicción: edad, IMC, TAS, TAD, hemoglobina, albúmina, tasa de catabolismo proteico, FG, excreción total de sodio en orina, excreción total de K en orina, diabetes, diuréticos, IECA/ARA, bloqueadores beta, antagonistas del calcio.
R2 modelo=0,542. El factor de inflación de la varianza de la variable bicarbonato sérico en el modelo fue de 1,056; FEK de 3,987 y Ko/FG de 3,937.
FEK: fracción excreción potasio; Ko/FG: carga de potasio por unidad de función renal.
A pesar de la fuerte correlación entre Ko/FG y FEK se descartó la multicolinealidad en este modelo de regresión lineal múltiple mediante análisis del factor de inflación de la varianza (tabla 4).
DiscusiónEn este estudio sobre el manejo renal de K en situaciones clínicas reales de pacientes con ERC avanzada prediálisis se demuestra que los principales determinantes del mantenimiento de los niveles séricos de K son: la carga de K (ingesta-absorción menos excreción extrarrenal) relativa a la función renal, y la FEK, esta última como expresión del grado de compensación adaptativa. Además, el bicarbonato sérico también se mostró como un determinante independiente de la HK y de los niveles séricos de K en los pacientes estudiados.
La cantidad total de K que se excreta por la orina durante un periodo de 24horas refleja, en una situación clínica estable, la cantidad que se ingiere y absorbe por la dieta menos la cantidad excretada por vía extrarrenal, principalmente intestinal7–9,11. Asumiendo un balance de K endógeno en equilibrio (i.e. K liberado por lisis celular igual al utilizado por nuevas células), y una excreción intestinal constante, el K urinario (Ko) podría tomarse como una aproximación del K ingerido en la dieta.
Este parámetro, aquí denominado como carga de K, presentó una distribución normal con un rango de distribución amplio. Teniendo en cuenta que la absorción del K ingerido es del 90%, y que la excreción intestinal en pacientes con ERC es de aproximadamente unos 15mmol/día, se puede estimar que la ingesta media de K en este grupo de pacientes fue de unos 78mEq/día (3,04g).
Aunque las recomendaciones sobre el contenido de K que debe tener una dieta saludable son unos 4,7g/día22, las mediciones de algunos estudios en población general señalan una ingesta media diaria de aproximadamente 3g23, similar a la estimada en nuestros pacientes. De este modo, la incidencia de HK, que fue del 30%, se observó asumiendo que en este grupo de pacientes con ERC avanzada no realizaban una restricción intencionada de K en la dieta ni tomaban ningún tipo de captor intestinal de K. Sin embargo, la HK no se relacionaba estrictamente con la carga absoluta de K, sino con la carga de K relativa a su filtrado glomerular (Ko/FG).
Los pacientes varones mostraron una significativa mayor carga tanto de K como de sodio con respecto a las mujeres. Este dato es consistente con lo observado en otros estudios en los que se atribuye la mayor incidencia de HK en varones a una ingesta dietética más elevada de este elemento23–25.
A pesar de esta mayor carga absoluta de K y de una significativa mayor carga de K relativa a la función renal (Ko/FG), la incidencia de HK fue ligeramente superior en los hombres al de las mujeres, aunque la diferencia no resultó significativa. Pero, lo que realmente resultó paradójico es que los hombres presentaban una FEK inferior a la esperable por su Ko/FG. Estos resultados podrían explicar la inclusión del sexo masculino como variable independiente y determinante significativa de la HK en el modelo de regresión logística, y desde un punto de vista de interpretación biológica podría indicar un manejo extrarrenal del potasio más eficaz en los hombres que en las mujeres.
La fuerte correlación lineal entre la carga de K relativa a la función renal (Ko/FG) y la FEK permitió descubrir una de las principales características de los pacientes que presentan HK, como fue la menor pendiente de esta recta que podría indicar la limitación del proceso fisiológico de compensación de excreción renal en este grupo caracterizado por sus niveles más elevados de K sérico. Aun así, en este grupo con HK la correlación de compensación de la FEK ante cargas elevadas de K se mantenía, apuntando este hallazgo a que los factores determinantes de una limitación en la excreción renal de K (e. g. inhibidores angiotensina, hipoaldosteronismo, etc.) actúan solo de forma incompleta promoviendo un umbral más elevado de la caliemia (HK crónica), por encima del cual todavía existe capacidad de incrementar la excreción renal de K y evitar niveles más extremos. Este hallazgo es consistente con los mecanismos fisiológicos de manejo tubular10,11,26, que pueden mantener una excreción eficaz de K incluso en situaciones de bloqueo de la aldosterona, y que a pesar de promover el desarrollo de HK crónica, los niveles de K sérico rara vez alcanzan niveles extremos.
Los niveles de bicarbonato sérico fue otro de los principales determinantes de la HK. Esta estrecha asociación es, sin embargo, un tanto sorprendente debido a que el mecanismo fisiopatológico directo entre la HK y la acidosis metabólica es por redistribución de K intracelular13,14. Tal situación ocurre en casos de retención de ácidos no orgánicos (acidosis mineral). Una posible explicación de este hallazgo podría ser la relación bidireccional entre HK y acidosis, es decir, la acidosis podría causar cierto grado de redistribución del K, pero al mismo tiempo la HK también podría condicionar una limitación en los mecanismos de acidificación renal (amoniogénesis)27. Más aún, los inhibidores del sistema renina-angiotensina, o el hipoaldosteronismo hiporreninémico podrían también influir en la limitación de la excreción de K y en el desarrollo de acidosis tubular13,14.
Este estudio tiene limitaciones. Debido al diseño transversal y retrospectivo no se pueden establecer relaciones causales firmes, y la interpretación de estos datos estáticos se extrapolan a teóricas respuestas dinámicas individuales. Los criterios de inclusión de pacientes se realizaron con el objetivo de obtener muestras fiables de orina. Es posible que debido a estos criterios se seleccionaran pacientes más cumplidores y rigurosos con las indicaciones y prescripciones, lo que podría causar un sesgo de selección. No obstante, la incidencia de HK fue semejante a la que observamos en nuestra población ERCA.
Las asunciones del balance de K endógeno y excreción intestinal de K constantes en cada uno de los participantes en este estudio podrían no ser reales, aunque la no inclusión de pacientes con factores que predisponen a un desequilibrio en estos procesos de manejo de K, hace más improbable que esta incertidumbre pudiera alterar los resultados y estimaciones finales del estudio.
En conclusión, aunque la carga de K relativa al filtrado glomerular (Ko/FG) es determinante de la probabilidad de desarrollo de HK en pacientes con ERC avanzada, la limitación de una excreción renal compensatoria de K expresada como una menor FEK caracteriza esta alteración electrolítica. No obstante, en estos pacientes podrían intervenir de forma eficaz mecanismos extraordinarios de excreción de K que impiden que se alcancen niveles séricos extremos.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.