INTRODUCCIÓN
La biopsia renal es una herramienta imprescindible en la monitorización del injerto tras el trasplante renal, ya que nos permite diagnosticar y establecer un tratamiento y un pronóstico ante los episodios de disfunción del injerto. Durante los últimos 25 años se ha llevado a cabo un extenso trabajo con el objetivo de estandarizar la evaluación histológica de las alteraciones del injerto renal. Desde la primera reunión del grupo de Banff, celebrada en 19911, se han mantenido reuniones con periodicidad bianual y tras cada reunión se ha realizado una publicación en las revistas de la especialidad donde se ha revisado de forma constante la clasificación con el objetivo de poder incorporar rápidamente las novedades derivadas de los trabajos de distintos grupos de investigación. En el documento que recogió las conclusiones de la reunión de 19972, se describe la representación de glomérulos y de arterias que debe contener la muestra (un mínimo de 10 glomérulos y dos arterias para muestras adecuadas y un mínimo de siete glomérulos y una arteria para muestras marginales), así como el método de procesamiento de la misma (tres laminillas con hematoxilina y eosina [H&E], tres laminillas con ácido peryódico de Schiff [PAS] o plata y una laminilla con tricrómico). Posteriormente, en la reunión de 2001, se incorporó la tinción específica para el componente C4d del complemento en tejido congelado o parafinado3 y, en la actualidad, la última revisión de la clasificación que se halla disponible es la realizada en la reunión de 20134. La evaluación de las lesiones crónicas (fibrosis intersticial, atrofia tubular, hialinosis arteriolar, engrosamiento intimal arterial) es una tarea compleja, ya que estas lesiones también se asocian al envejecimiento, a la hipertensión arterial o a la diabetes. Dado que actualmente se están utilizando injertos renales procedentes de donantes añosos (hasta 80-90 años) y con comorbilidades (hipertensión arterial, diabetes mellitus), se recomienda disponer de una biopsia preimplante para poder realizar una valoración adecuada de la progresión de las mismas.
Desde finales de la década de los ochenta del siglo pasado, distintos grupos de investigación se han dedicado a estudiar la presencia de lesiones agudas y crónicas en los injertos renales con función estable mediante la realización de biopsias, con el objetivo de caracterizar la presencia de lesiones subclínicas (a estas biopsias se las ha llamado biopsias «de protocolo» o «de seguimiento»). El objetivo de la presente revisión es analizar las evidencias disponibles en la actualidad que apoyan esta monitorización histológica del injerto renal, es decir, la realización de biopsias renales en injertos con función estable.
MATERIAL Y MÉTODOS
La selección de artículos que se van a revisar ha sido realizada por uno de los autores (F. M.) con el objetivo de intentar dar respuesta a las siguientes preguntas:
1. ¿Es necesario realizar una biopsia renal preimplante? ¿Se debe utilizar la biopsia preimplante para decidir si el riñón es apto para trasplante, especialmente en los donantes con criterios expandidos? ¿Cuándo realizar trasplante renal dual?
2. ¿Es necesaria la monitorización histológica mediante biopsias de protocolo en todos los trasplantes? ¿O solo es necesaria la monitorización histológica en los trasplantes de alto riesgo inmunológico? ¿O nunca es necesaria?
3. ¿Debe tratarse el rechazo (celular o humoral) subclínico?
4. ¿Es necesaria la monitorización histológica para asegurar que los episodios de rechazo agudo (celular o humoral) han sido adecuadamente revertidos?
5. ¿Deben realizarse biopsias de protocolo antes o después de realizar cambios en la inmunosupresión?
6. ¿Es útil la monitorización histológica para el manejo de la recidiva de la enfermedad renal primaria?
7. ¿Es útil la monitorización histológica para el manejo de la nefropatía por el virus del polioma BK?
8. ¿Son útiles los inhibidores de la enzima convertidora de la angiotensina (IECA) o los antagonistas de los receptores de la angiotensina II (ARAII) para frenar la progresión de la fibrosis?
BIOPSIA RENAL PREIMPLANTE
Durante las últimas décadas se ha producido un progresivo aumento de la edad y de la comorbilidad de los donantes para trasplante renal. Según datos de la Organización Nacional de Trasplantes (ONT)5, en el año 2014 más del 50% de los donantes cadáver tenían una edad superior a los 60 años y más de un 25% tenían una edad superior a los 70 años. La causa de muerte más frecuente fue el accidente cerebrovascular (63%) y, además, la presencia de hipertensión arterial (50,4%), diabetes mellitus (21,7%) o disfunción renal en el momento de la donación (creatinina sérica > 1,5 mg/dl; 8%) fue muy elevada. Estas características de los donantes se asocian a una elevada tasa de no utilización de los órganos obtenidos, de tal manera que de los 2.986 órganos renales extraídos, 722 (24,8%) fueron rechazados para trasplante. Es destacable que 512 riñones fueran rechazados por las características de los injertos y que en 250 casos lo fueran por obtener un índice histológico elevado que desaconsejaba el trasplante. Incluso en los donantes vivos renales, la edad media es de 51 años y se han aceptado órganos procedentes de donantes de hasta 79 años. Estos riñones procedentes de donantes con criterios expandidos ofrecen peores resultados a medio y largo plazo, debido a la presencia de lesiones preexistentes a las que, en general, nos referimos como «senescencia renal». La senescencia renal se caracteriza por un mayor número de glomérulos esclerosados, glomerulopenia con hipertrofia compensadora de los glomérulos remanentes, expansión del intersticio renal y hialinosis arteriolar. Estos cambios morfológicos se acompañan de una menor función renal e hiperfiltración de los glomérulos patentes. En un estudio reciente6, se demuestra que los órganos obtenidos de donantes añosos (edad media de 59 años, un 64% de ellos con antecedentes de hipertensión arterial), presentan, en comparación con un grupo de donantes estándar (46 años de edad media, un 10% con antecedentes de hipertensión arterial), más glomérulos esclerosados (16,8% frente a 1,6%), un menor número de glomérulos patentes (3 × 105 frente a 8,5 × 105), un mayor volumen glomerular medio (3,4 × 106 m3 frente a 2,7 × 106 m3), un mayor coeficiente de ultrafiltración por glomérulo (11,2 frente a 8,3 nl/[min × mmHg]) y una mayor expansión del intersticio renal (18 frente a 12%). Con este tipo de donantes, los receptores alcanzan un filtrado glomerular renal un 30% inferior (48 frente a 69 ml/min/1,73 m2) y, en una parte de ellos (> 50%), el filtrado glomerular fue inferior a 40 ml/ min/1,73 m2. Todos estos datos sugieren que los órganos procedentes de donantes añosos presentan procesos de adaptación como los del riñón remanente, lo cual podría explicar su peor supervivencia a medio plazo.
Dadas las limitaciones de los resultados alcanzados con los injertos obtenidos de donantes expandidos, se han desarrollado diversos índices para evaluar la viabilidad del injerto. Algunos de ellos solo contienen datos clínicos (edad, hipertensión arterial, causa de la muerte, creatinina sérica preextracción); otros, solo datos histológicos y algunos han combinado datos de ambas fuentes. Se ha demostrado que una valoración conjunta en el donante de los datos clínicos (hipertensión arterial, creatinina sérica > 150 µmol/l, muerte por ictus) e histológicos (glomerulosclerosis global > 10%, fibrosis intersticial > 5%) supone una buena predicción (área bajo la curva = 0,81-0,84) de presentar función renal subóptima al año del trasplante (filtrado glomerular [FG] estimado < 25 ml/min/1,73 m2) o de fracaso del injerto a 5 años7,8. Sin embargo, ninguno de ellos ha sido validado para decidir qué órganos no son adecuados para trasplante.
Por otra parte, los índices complejos (Maryland aggregate pathology index), que valoran lesiones en los diversos compartimentos renales (glomérulos, túbulo-intersticio, arteriolas y arterias) se relacionan con la supervivencia del injerto renal, pero son difíciles de realizar por patólogos no entrenados9. En nuestro ámbito, se ha publicado un documento de consenso para la evaluación de la biopsia del donante10. En dicho documento se enfatiza la importancia de disponer de una muestra representativa (> 50 glomérulos entre ambos riñones) y de realizar una valoración conjunta de ambos órganos. Además, se propone un índice que valora la esclerosis glomerular (0 = 0%; 1 = 1-10%; 2 = 11-20%; 3 > 20%) y las lesiones de fibrosis intersticial, atrofia tubular, hialinosis arteriolar y engrosamiento intimal arterial según los criterios de Banff. Esta evaluación permite generar un índice entre 0 y 15, y, según el documento de consenso, se recomienda descartar los riñones con un índice > 7. Recientemente, se ha documentado que este índice adolece de una baja reproducibilidad entre observadores (índice kappa = 0,41) cuando la evaluación de las biopsias se realiza por patólogos no experimentados en patología del trasplante renal11.
Finalmente, con el objetivo de mejorar los resultados a largo plazo de los riñones obtenidos de donantes con criterios expandidos, algunos grupos han propuesto la realización de un trasplante renal dual (ambos riñones implantados en el mismo receptor) en función de los hallazgos histológicos en la biopsia del donante. El estudio realizado por un grupo italiano demostró que la valoración histológica de los órganos obtenidos de donantes con criterios expandidos permite clasificar los riñones como aptos para trasplante renal simple, dual o no implantarlos, asegurando unos resultados a medio plazo no distintos a los de los órganos procedentes de donantes estándar12. Sin embargo, los umbrales para realizar el trasplante renal simple o dual y para descartar los órganos no han sido suficientemente validados13. De todas maneras, en la actualidad, la práctica de este tipo de trasplante en nuestro país es excepcional (cinco casos en 2014), ya que estos órganos se utilizan para trasplante renal simple o son descartados.
BIOPSIAS DE PROTOCOLO Y RIESGO INMUNOLÓGICO
Para monitorizar desde el punto de vista histológico el injerto renal, algunos grupos incluyen en el seguimiento de los pacientes la realización de biopsias renales de protocolo con el objetivo de diagnosticar la presencia de rechazo agudo subclínico (celular o humoral) y valorar la progresión de las lesiones crónicas (glomerulosclerosis, fibrosis intersticial/atrofia tubular, hialinosis arteriolar, vasculopatía del injerto). Además, estas biopsias se han utilizado en diversos ensayos clínicos como variables de eficacia primaria o secundaria con el objetivo de evaluar los cambios morfológicos en trasplantes renales bajo distintas pautas de inmunosupresión14-16. Cabe destacar que la realización de biopsias de protocolo se ha revelado como un procedimiento seguro cuando se realiza en centros experimentados y que, además, se puede realizar de forma ambulatoria15,17,18.
Desde principios de la década de los noventa, se describió la presencia de lesiones de rechazo agudo celular en las biopsias de protocolo realizadas en injertos con función estable. A esta alteración se la denominó «rechazo agudo subclínico». Las características inmunológicas del receptor, tales como el grado de sensibilización, el retrasplante, el número de incompatibilidades en los antígenos leucocitarios humanos (HLA por sus siglas en inglés, human leukocyte antigen) o la presencia de episodios previos de rechazo agudo, así como el tratamiento inmunosupresor, se asocian con la presencia de rechazo agudo subclínico. Estas alteraciones son más frecuentes durante los primeros meses postrasplante y su prevalencia disminuye de forma progresiva a partir del sexto mes. En cambio, la presencia de lesiones crónicas aumenta rápidamente durante el primer año para hacerlo más lentamente a partir de entonces19. Durante los últimos años, la llegada de nuevas técnicas para determinar la presencia de anticuerpos anti-HLA (Luminex) ha permitido describir patrones morfológicos distintos en pacientes sin anticuerpos anti-HLA donante específicos (bajo riesgo inmunológico) y en pacientes con anticuerpos anti-HLA donante específicos (alto riesgo inmunológico). Los pacientes con anticuerpos anti-HLA no donante específicos parecen comportarse, desde el punto de vista de los hallazgos histológicos, de forma parecida a los pacientes sin anticuerpos anti-HLA, aunque, en estos, el riesgo de desarrollar anticuerpos anti-HLA donante específicos parece ser mayor.
Biopsias de protocolo en pacientes de bajo riesgo inmunológico
En los pacientes de bajo riesgo inmunológico, se ha descrito la presencia de rechazo agudo subclínico celular en proporciones variables, así como la progresión de las lesiones crónicas. El impacto que tienen estas lesiones sobre la evolución del injerto también ha sido motivo de distintos trabajos de investigación. A continuación revisaremos las evidencias en cada uno de estos aspectos de forma aislada.
Rechazo subclínico. En los pacientes sin anticuerpos anti-HLA donante específicos en el momento de la biopsia, la lesión aguda predominante es la del rechazo celular mediado por células T. Desde el punto de vista morfológico, se caracteriza por la presencia de inflamación intersticial (i) asociada a distintos grados de tubulitis (t). En 2/3 de los casos, se alcanza el diagnóstico de cambios borderline (≥ i1t1, pero < i2t2), mientras que en 1/3 de los casos se alcanza el diagnóstico de rechazo agudo celular (≥ i2t2). En cambio, la presencia de rechazo agudo subclínico con endotelialitis (v ≥ 1) es excepcional16.
La frecuencia y la gravedad de estas lesiones se correlacionan de forma estrecha con el tratamiento inmunosupresor de mantenimiento. Durante las últimas décadas, con la llegada de pautas de inmunosupresión más potentes, la prevalencia de esta lesión ha disminuido de forma progresiva. Cuando se realizaba tratamiento de mantenimiento con ciclosporina y azatioprina, estas alteraciones estaban presentes en más del 50% de los injertos durante los primeros meses postrasplante. Posteriormente, con las pautas basadas en ciclosporina A en microemulsión asociada con micofenolato de mofetilo (MMF), se redujo al 30% y, finalmente, las pautas de tratamiento actuales basadas en la combinación de tacrolimus con MMF o inhibidores de la diana de la rapamicina en mamíferos (m-TOR por sus siglas en inglés, mammalian target of rapamycin), los im-TOR, presentan tasas de rechazo agudo subclínico, durante el primer año, inferiores al 15% (revisión en las referencias 14 y 16).
La información disponible con pautas de tratamiento libres de anticalcineurínicos es menor. En un grupo de pacientes que recibieron tratamiento de mantenimiento con MMF y corticoides, la prevalencia fue superior al 50%20. Los estudios realizados con im-TOR sin anticalcineurínicos han arrojado resultados contradictorios, probablemente en relación con la reducción progresiva de los niveles diana. En un estudio prospectivo y aleatorizado, que comparaba una pauta basada en tacrolimus, MMF y corticoides (n = 84) con una pauta basada en sirolimus, MMF y corticoides (n = 81), la prevalencia de episodios de rechazo agudo clínico y subclínico durante el primer año no fue distinta (14 frente a 18%) entre ambas ramas de tratamiento21. En cambio, en un subestudio del ensayo clínico CONCEPT (los pacientes fueron aleatorizados a los 3 meses a una pauta basada en sirolimus, MMF y corticoides o a seguir con ciclosporina, MMF y corticoides), las biopsias de protocolo al año mostraron una mayor prevalencia de cambios borderline (16,2 frente a 5,1%) y de rechazo subclínico (29 frente a 10,2%) en los pacientes convertidos a sirolimus22. Sin embargo, el inmunofenotipo de este infiltrado intersticial es diferente bajo distintas pautas de tratamiento y se ha postulado que, en los pacientes tratados con sirolimus, los infiltrados intersticiales ricos en células T reguladoras pueden tener un efecto protector sobre la disfunción crónica del injerto23.
Progresión de la fibrosis intersticial/atrofia tubular.
Durante el primer año postrasplante se produce un aumento progresivo de las lesiones crónicas, especialmente de la fibrosis intersticial/atrofia tubular (FI/AT), mientras que la progresión de la glomerulosclerosis y las lesiones vasculares es más lenta y tardía19. Ha sido motivo de distintos trabajos evaluar la contribución de la respuesta inmune y la nefrotoxicidad por anticalcineurínicos en la progresión de estas lesiones crónicas. En un estudio que incluyó a 256 pacientes tratados con tacrolimus, MMF y retirada rápida de corticoides, se demuestra, en las biopsias realizadas durante los primeros 4 meses, que la presencia de cambios borderline y de rechazo agudo subclínico (50 y 19 casos, respectivamente) se asocia con una mayor proporción de cambios de FI/TA moderada en la biopsia de protocolo al año (15% en los casos sin rechazo subclínico, 34% en los casos con cambios borderline y 53% en los casos con rechazo subclínico)24. Sin embargo, a la progresión de las lesiones de la FI/AT también contribuye de forma significativa el tratamiento con anti-calcineurínicos. Se ha demostrado en diversos ensayos clínicos que las pautas de tratamiento libres de anticalcineurínicos, bien sea basadas en im-TOR o en belatacept, se asocian a una menor progresión de la FI/AT que las pautas basadas en ciclosporina25-27. En cambio, este beneficio no se pudo demostrar en un ensayo clínico que comparó pacientes tratados con tacrolimus, MMF y corticoides con pacientes tratados con sirolimus, MMF y corticoides, en el que tan solo se observó una menor progresión del engrosamiento vascular intimal en los pacientes tratados con sirolimus21. A pesar de estos resultados, que sugieren una menor nefrotoxicidad del tacrolimus que de la ciclosporina, la progresión de las lesiones de la FI/AT al año del trasplante no fue distinta en un ensayo clínico que comparó pacientes tratados con tacrolimus (n = 97) y con ciclosporina (n = 94), aunque la prevalencia de rechazo subclínico a los 6 meses se redujo a la mitad con el tacrolimus (38,8 frente a 15,2%)28. Por otra parte, en un estudio con biopsias seriadas realizadas durante el primer año, se demuestra que los pacientes que se han mantenido con niveles más elevados de tacrolimus (> 12 ng/ml) presentan una menor progresión de las lesiones crónicas29, lo que sugiere que un buen control de la respuesta inmune reduce la progresión de las lesiones de la FI/AT. Finalmente, en otro ensayo clínico, se mostró que la combinación de tacrolimus con sirolimus (n = 50) es más potente que la de tacrolimus con MMF (n = 50) o ciclosporina con sirolimus (n = 50) o MMF (n = 50), ya que se asocia a la menor prevalencia de rechazo subclínico durante el primer año (< 10%) y a una menor prevalencia de lesiones crónicas a los 5 años30. Además, se ha descrito que existe una interacción entre las lesiones preexistentes en el donante y el régimen de tratamiento. Así, en los injertos sin lesiones preexistentes, la combinación de tacrolimus, sirolimus y corticoides se acompaña de una menor progresión de la FI/AT; pero, en cambio, en injertos con lesiones preexistentes, la combinación de tacrolimus, MMF y corticoides se asocia a una menor progresión31. Así pues, el impacto que tiene el tratamiento con anticalcineurínicos en la progresión de las lesiones crónicas es difícil de interpretar. En un estudio con biopsias de protocolo a los 3, 24 y 120 meses, se observó que los pacientes tratados con ciclosporina (n = 48) presentaban una mayor progresión de las lesiones crónicas (glomerulosclerosis, fibrosis intersticial, atrofia tubular, engrosamiento intimal y hialinosis arteriolar) que los pacientes sin anticalcineurínicos (n =
93); aunque ninguna de estas lesiones es específica32, ni tan solo los depósitos hialinos en la capa muscular de las arteriolas (68% en los tratados con ciclosporina frente a 28% en los no tratados).
Por lo tanto, podemos concluir que, durante el primer año, distintos insultos contribuyen a la progresión de la FI/AT, tanto el rechazo subclínico como el tratamiento con anti-calcineurínicos, y hoy en día todavía no sabemos qué pauta de tratamiento es mejor debido a la interacción entre las distintas variables. Sin embargo, debe destacarse que, en pacientes de bajo riesgo inmunológico, la progresión de la FI/AT entre el primer y quinto año postrasplante es leve con las pautas de inmunosupresión actuales basadas en tacrolimus o im-TOR33.
Monitorización histológica y evolución del injerto. Se han llevado a cabo distintos trabajos con largas series de casos con seguimiento superior a los 10 años para evaluar si existe alguna relación entre los hallazgos en las biopsias de protocolo realizadas durante el primer año y el pronóstico del injerto. Estos estudios tienen diversas limitaciones, entre las que cabe destacar los cambios en las pautas de tratamiento a lo largo del tiempo, así como los cambios introducidos en el seguimiento postrasplante, especialmente la introducción de las nuevas técnicas para detectar anticuerpos anti-HLA.
En general, se puede afirmar que la presencia de episodios de rechazo agudo celular subclínico se ha asociado con la aparición de anticuerpos anti-HLA donante específicos de novo, con el desarrollo de rechazo crónico mediado por anticuerpos y con el fracaso tardío del injerto32,33. En un estudio que incluyó a 315 pacientes sin anticuerpos anti-HLA pretrasplante, 47 desarrollaron anticuerpos anti-HLA donante específicos (ADE) a los 4,6 años y la aparición de ADE se asoció con el número de incompatibilidades HLA, especialmente de clase II, con los episodios de rechazo clínico y subclínico, y con la no adherencia al tratamiento inmunosupresor34. Los pacientes con ADE presentaron una supervivencia a los 10 años muy inferior a los que no desarrollaron ADE (95 frente a 50%). En otro estudio35, se revisaron más de 500 pacientes con una biopsia de protocolo durante los primeros 6 meses postrasplante y en 109 de ellos se disponía de una biopsia tardía por disfunción realizada a los 7 años del trasplante. En los pacientes que presentaban rechazo crónico mediado por anticuerpos en la biopsia tardía (n = 44), la presencia de rechazo subclínico en la biopsia de protocolo fue el doble de frecuente que en los pacientes que presentaban FI/AT (n = 42) en la biopsia tardía (52,3 frente a 28,6%). En este estudio, los pacientes con rechazo crónico presentaron una supervivencia del injerto inferior que los pacientes con FI/ AT (58 frente a 21% a los 20 años del trasplante).
La presencia de lesiones crónicas (FI/AT) se ha relacionado con el fracaso tardío del injerto, especialmente cuando se asocia con lesiones de rechazo subclínico (revisión en 14-16). Una de las series más amplias en cuanto al número de casos (n = 435) y con un seguimiento de 9 años de media20, mostró que los pacientes que en la biopsia de protocolo presentaban rechazo subclínico asociado a FI/AT (n = 65) tenían casi el doble de riesgo de presentar fracaso del injerto que los pacientes que presentaban una biopsia normal (n = 186), una biopsia con rechazo subclínico aislado (n = 74) o con FI/AT aislada (n = 110).
Biopsias de protocolo en pacientes de alto riesgo inmunológico
En los pacientes con ADE en el momento de la biopsia, la lesión predominante en las biopsias de protocolo precoces es la presencia de inflamación de la microcirculación (glomerulitis y capilaritis peritubular) asociada en alrededor del 50% de los casos a depósitos de C4d en los capilares peritubulares. Las biopsias realizadas al año del trasplante muestran la persistencia de inflamación de la microcirculación, la aparición de glomerulopatía del trasplante y una aceleración en la progresión de la vasculopatía del injerto15,36-38. La presencia de depósitos de C4d es variable entre los distintos estudios: 57% en las 157 biopsias realizadas a los 3 y 12 meses en 80 pacientes por parte del grupo de París36 y entre el 20-30% en las 200 biopsias realizadas a 50 pacientes con prueba cruzada positiva sometidos a tratamiento desensibilizador por el grupo de Baltimore39,40. En los pacientes sometidos a tratamiento desensibilizador se ha mostrado que, en las biopsias tomadas tras la reperfusión del injerto, la presencia de depósitos de C4d en los capilares peritubulares es el mejor predictor del posterior desarrollo de rechazo mediado por anticuerpos41. A pesar de que la inflamación de la microcirculación muestra una mejor asociación con la presencia de ADE y el posterior desarrollo de glomerulopatía del trasplante que los depósitos de C4d36, no debe obviarse que la presencia de C4d como marcador de activación del complemento se ha mostrado como una variable altamente específica del fracaso tardío del injerto en biopsias por indicación42.
Los trabajos del grupo de París43 llevados a cabo durante los últimos años han mostrado que la presencia de ADE en el momento de realizar la biopsia de protocolo al año del trasplante se asocia con una peor supervivencia del injerto a 9 años, 90% en los pacientes sin rechazo en la biopsia (n = 727) y 56% en los pacientes con rechazo subclínico mediado por anticuerpos (n = 142). La mayor parte de pacientes con rechazo subclínico mediado por anticuerpos presentaban ADE preformados y una pequeña proporción, ADE de novo (111 frente a 31). En esta serie, los pacientes con rechazo subclínico mediado por células T (n = 132) presentan una supervivencia similar a los pacientes sin rechazo (88%). Cabe destacar que los pacientes con rechazo subclínico mediado por anticuerpos y rechazo subclínico mediado por células T presentan una mayor tendencia a desarrollar glomerulopatía del trasplante a largo plazo que los pacientes con una biopsia sin rechazo (54, 22 y 12%, respectivamente). Los pacientes con rechazo subclínico mediado por células T que desarrollarán glomerulopatía del trasplante son aquellos que presentan ADE de novo en el momento de la biopsia (17 de 132).
Biopsias de protocolo en trasplante ABO incompatible. La práctica del trasplante de donante vivo ABO incompatible tras completar tratamiento desensibilizador se introdujo hace unas cuantas décadas en Japón. Durante los últimos años, este tipo de trasplante se ha extendido a los países occidentales y hoy en día diversas unidades de nuestro país realizan este tipo de trasplante, aunque la implantación del programa nacional de trasplante renal cruzado ha frenado su expansión. Según datos de la ONT, en 2011, el 4,3% de los trasplantes de donante vivo (13 de 312) fueron ABO incompatibles y el 2,2% (7 de 312) fueron cruzados; en cambio, en 2014, el 10,4% fueron cruzados (44 de 423), mientras que el 4,4% fueron ABO incompatibles (19 de 423).
Las experiencias llevadas a cabo en diversos centros muestran que los pacientes que reciben injertos ABO incompatibles presentan con elevada frecuencia (> 80%) depósitos de C4d en los capilares peritubulares sin cambios asociados de rechazo mediado por anticuerpos. Cabe destacar que en las series publicadas, a pesar de que el tratamiento es más intensivo que en los pacientes que reciben injertos ABO compatibles, la presencia de rechazo subclínico mediado por células T es más elevada44-47.
TRATAMIENTO DEL RECHAZO SUBCLÍNICO
Durante la década de los noventa, la introducción del diagnóstico de rechazo subclínico y sus potenciales efectos deletéreos a largo plazo condujo a que se realizara el primer ensayo clínico, prospectivo y aleatorizado para evaluar si el diagnóstico y tratamiento del rechazo subclínico durante los primeros meses postrasplante contribuía a disminuir la progresión de las lesiones crónicas y la disfunción del injerto. Un grupo de 36 pacientes aleatorizados a ser biopsiados a los 0, 1, 2, 3 y 6 meses postrasplante y a recibir tratamiento con pulsos de corticoides si presentaban rechazo subclínico se comparó con un grupo de 36 pacientes al que solo se biopsió a los 0 y a los 6 meses. Los pacientes del grupo experimental presentaron una menor progresión de las lesiones crónicas en la biopsia a los 6 meses y una mejor función renal a los 2 años48. En este estudio, los pacientes recibieron tratamiento de mantenimiento con ciclosporina, azatioprina y corticoides, y la prevalencia de rechazo subclínico fue superior al 30% durante los primeros meses. Posteriormente, el mismo grupo lideró un ensayo clínico similar en pacientes tratados con tacrolimus, MMF y corticoides. En este caso, un grupo de 121 pacientes fue aleatorizado a biopsia a los 0, 1, 2, 3 y 6 meses y recibió tratamiento con pulsos de corticoides si presentaban rechazo subclínico, y se comparó con un grupo de 119 pacientes biopsiados a los 0 y 6 meses. En este estudio, la prevalencia de rechazo subclínico en el grupo experimental fue muy baja (4,6%) y no se pudo demostrar ningún beneficio a los 6 meses en la biopsia renal ni en la función renal en el grupo experimental49. Posteriormente, se publicaron los resultados de otro ensayo clínico en el que 52 pacientes fueron aleatorizados a ser biopsiados al mes y a los 3 meses, y 50 pacientes actuaron como grupo control50. En este estudio, los pacientes recibieron tratamiento de mantenimiento con ciclosporina asociada a MMF o azatioprina y, por lo tanto, la prevalencia de rechazo subclínico fue más elevada (cambios borderline = 11,5 y 14% y rechazo subclínico = 17,3 y 12%, al mes y a los 3 meses, respectivamente). En este ensayo clínico, el tratamiento con pulsos de corticoides a los pacientes con rechazo subclínico y el ajuste de los niveles de ciclosporina a los pacientes con cambios borderline se asociaron a una mejor función renal a los 12 meses (creatinina sérica = 1,20 ± 0,33 frente a 1,52 ± 0,41 mg/dl).
Algunos autores han sugerido que la monitorización del injerto durante los primeros meses postrasplante para detectar o descartar la presencia de rechazo subclínico puede contribuir a individualizar el manejo de los pacientes. Así, a los pacientes a los que se diagnostica y trata de episodios de rechazo subclínico, habría que monitorizarlos con biopsias más seguidas y, en cambio, los pacientes con biopsias sin rechazo se podrían beneficiar de reducciones de la inmunosupresión realizando biopsias más espaciadamente51. Parece evidente que para incluir estos conceptos en la práctica clínica harían falta ensayos clínicos de difícil diseño.
Existe consenso en la literatura en que el rechazo subclínico mediado por anticuerpos se asocia a un efecto deletéreo sobre la supervivencia del injerto. Sin embargo, hasta la actualidad no se han publicado resultados de ensayos clínicos prospectivos y aleatorizados para evaluar los potenciales beneficios de su tratamiento. Los tratamientos disponibles hasta la actualidad para el rechazo agudo mediado por anticuerpos o para desensibilizar a los pacientes con anticuerpos preformados (eliminación de anticuerpos mediante plasmaféresis o inmunoadsorción, inmunoglobulinas intravenosas, anticuerpos antilinfocitos B, inhibidores del proteasoma como el bortezomib o inhibidores del complemento como el eculizumab) no han sido testados en ensayos clínicos. En la página web clinical.trials.gov consta registrado el ensayo clínico titulado «Eculizumab therapy for subclinical antibody-mediated rejection in kidney transplantation (TAMARCIN)» (NCT02113891), que fue finalizado antes de iniciar el reclutamiento. Por lo tanto, dado que muchos pacientes con ADE, especialmente con anticuerpos anti-HLA de clase II, van a desarrollar rechazo crónico activo mediado por anticuerpos, parece lógico intentar pautas de tratamiento para eliminar dichos anticuerpos y mejorar la supervivencia del injerto40. Sin embargo, las combinaciones de tratamiento y el momento de su instauración están todavía por definir.
MONITORIZACIÓN HISTOLÓGICA DEL RECHAZO AGUDO
La presencia de episodios de rechazo celular o humoral agudo se asocia a una peor supervivencia del injerto. Tras completar el tratamiento se evalúa la respuesta clínica mediante la evolución de la función renal. Pocos trabajos han evaluado si, tras el tratamiento, se produce una normalización de la histología del injerto. En un estudio que incluyó casi 800 trasplantes de bajo riesgo inmunológico y en el que el 15% de los pacientes presentaron episodios de rechazo celular agudo clínico o subclínico durante el primer año, se objetivó que la presencia de inflamación con fibrosis en la biopsia de protocolo al año (22 frente a 6%), la presencia de glomerulopatía del trasplante (8 frente a 1%) y el desarrollo de ADE de clase II de novo (21 frente 11%) eran más frecuentes en los pacientes con episodios de rechazo celular agudo que en los que no los habían presentado52. Este patrón de inflamación con fibrosis se ha asociado, en diversos estudios, con una peor supervivencia del injerto20,24, aunque no disponemos de estudios para evaluar si los cambios en la inmunosupresión pueden modificarlo.
BIOPSIAS DE PROTOCOLO Y CAMBIOS EN LA INMUNOSUPRESIÓN
A lo largo del seguimiento tras el trasplante renal se plantea la necesidad de realizar cambios en el tratamiento inmunosupresor, bien por la aparición de nuevas patologías (neoplasias, infecciones virales) o para disminuir la toxicidad de los fármacos administrados en la prevención del rechazo agudo (corticoides, anticalcineurínicos).
Suspensión de los corticoides
Existen en la literatura múltiples ensayos clínicos y metaanálisis que demuestran que la suspensión de los corticoides con las terapias actuales es segura y, aunque se acompaña de un pequeño aumento de los episodios de rechazo agudo, no parece modificar la supervivencia del injerto a medio plazo53. Hasta la actualidad, en un estudio de reducido tamaño muestral (n = 5), se mostró que en los pacientes sin inflamación en la biopsia de protocolo al año, se pueden retirar los esteroides con seguridad54. En la actualidad, en nuestro país, se está llevando a cabo un ensayo clínico para evaluar si en los pacientes sin rechazo subclínico en la biopsia de protocolo, a los 3 meses, se pueden retirar los corticoides de forma segura, con la monitorización de la aparición de ADE de novo y la evaluación del injerto con una nueva biopsia de protocolo a los 24 meses («Steroid withdrawal and donor-specific anti-HLA antibodies in renal transplant patients»; NCT02284464).
Suspensión de los anticalcineurínicos
Los anticalcineurínicos, la ciclosporina y el tacrolimus, forman parte del tratamiento de mantenimiento de la mayor parte de injertos renales. Aunque su toxicidad, especialmente su nefrotoxicidad, ha sido ampliamente revisada en la literatura, existen pocos ensayos clínicos que hayan conseguido eliminarlos con éxito dada la elevada prevalencia de episodios de rechazo agudo. Recientemente, se han publicado los resultados de un ensayo clínico en el que receptores de bajo riesgo (donante vivo, ADE negativos pretrasplante) fueron aleatorizados a suspender tacrolimus a los 6 meses del trasplante tras objetivar que en la biopsia de protocolo no había inflamación y los ADE persistían negativos55. El ensayo finalizó prematuramente, ya que en la rama experimental se observó una elevada incidencia de rechazo agudo (4 de 14) y de aparición de ADE de novo (5 de 14). Previamente se habían publicado resultados similares en un grupo de pacientes que presentaban signos histológicos de nefrotoxicidad y en los que se suspendió la ciclosporina al año del trasplante54. Sin embargo, en otro estudio prospectivo, 108 pacientes que recibieron tratamiento con ciclosporina, MMF y corticoides fueron aleatorizados a los 3 meses del trasplante, tras realizar una biopsia de protocolo, a eliminar la ciclosporina o el MMF56. Tras la eliminación de la ciclosporina, la aparición de episodios de rechazo agudo fue mayor que tras la suspensión del MMF (22 frente a 5%) y el porcentaje de biopsias al año con depósitos de C4d también fue mayor.
Tomados en su conjunto, estos datos sugieren que la suspensión de los anticalcineurínicos durante el primer año en injertos renales inmunológicamente quiescentes no es segura.
Cambio de anticalcineurínicos por inhibidores de la m-TOR
Existen en la literatura múltiples ensayos clínicos que han evaluado la utilidad de los im-TOR como inmunosupresores en la pauta de mantenimiento de los pacientes trasplantados renales libres de anticalcineurínicos. Se han desarrollado diversas estrategias a lo largo de los años: im-TOR de novo sin anticalcineurínicos, con anti-calcineurínicos de novo y suspensión de estos precozmente (entre 3 y 6 meses) o conversiones precoces de anticalcineurínicos a im-TOR. En dos ensayos clínicos recientes que han utilizado la biopsia de protocolo antes y después del cambio de tratamiento, uno con sirolimus y otro con everolimus, se muestra que la conversión precoz (entre 1 y 3 meses) se acompaña de más episodios de rechazo agudo y no disminuye la progresión de la FI/AT en los injertos que no han presentado episodios de rechazo agudo57,58. No se ha evaluado si los hallazgos histológicos en la biopsia preconversión permiten discriminar a los pacientes con mayor riesgo de desarrollar episodios de rechazo agudo posteriormente.
BIOPSIAS DE PROTOCOLO Y RECIDIVA DE LA ENFERMEDAD DE BASE
La recidiva de la enfermedad de base es una de las causas que también contribuyen al fracaso del injerto. Se han realizado diversos estudios que muestran que la recidiva de la patología de base se puede diagnosticar mediante biopsias de protocolo. En una serie de 65 pacientes con nefropatía por inmunoglobulina A (IgA) de base, en la que se disponía de una biopsia de protocolo durante los primeros 2 años, se demostró que la nefropatía IgA recurre de forma subclínica en el 32% de los casos59. La recurrencia es menor en los pacientes que reciben un injerto con dos compatibilidades en el locus DR y en los pacientes tratados con ciclosporina. Dado que la tasa de pérdida del injerto por esta causa es muy baja (3%), no se ha podido evaluar si distintas pautas de tratamiento en los pacientes con recurrencia mejoran la supervivencia.
La glomerulonefritis membranosa recurre en el 42% de los injertos60. La biopsia de protocolo permite un diagnóstico precoz y la instauración de un tratamiento específico (rituximab), con los que se alcanza la remisión completa o parcial en el 75% de los casos. Los autores sugieren que es necesario realizar un ensayo clínico para evaluar si esta terapia es superior al tratamiento estándar. De todas formas, durante los últimos años, disponemos de nuevas herramientas para evaluar la actividad de la nefropatía membranosa, como la cuantificación de los anticuerpos frente al receptor de la fosfolipasa A2. Son necesarios nuevos estudios para evaluar qué pueden aportar ambas herramientas en la monitorización de la recidiva de esta enfermedad postrasplante y tomar decisiones sobre su tratamiento precoz.
BIOPSIAS DE PROTOCOLO Y NEFROPATÍA POR EL VIRUS DEL POLIOMA BK
Desde su descripción hace más de una década, la nefropatía por el virus del polioma BK afecta entre el 2 y el 10% de los injertos en función de las características de los donantes y de los receptores, y de la pauta de tratamiento inmunosupresor. Esta nefropatía se ha asociado con el tratamiento con anticuerpos antilinfocitarios, tacrolimus, MMF y corticoides, que son ampliamente utilizados en la actualidad. Desde hace unos años, disponemos de herramientas no invasivas, como la monitorización de la reacción en cadena de la polimerasa (PCR) del virus en sangre, que muestra una estrecha correlación con la presencia de nefropatía. En una serie de más de 600 pacientes61 con monitorización de la viremia por BK y biopsias de protocolo o diagnósticas (93% de los casos), no se observó ningún caso de nefropatía BK en los pacientes sin viremia a lo largo del seguimiento (n = 446) o con viremias inferiores a 10.000 copias/ml (n = 88). En cambio, de los 75 pacientes con viremias BK > 10.000 copias/ml, solo en 8 casos (1,3% del total de la serie) se demostró nefropatía BK en la biopsia de protocolo y la presencia de una viremia > 185.000 copias/ml presentó una elevada sensibilidad (75%) y especificidad (95%) para el diagnóstico de nefropatía BK. Es decir, la monitorización de la viremia permite conocer de forma bastante precisa qué pacientes pueden presentar nefropatía BK y realizar los tratamientos más adecuados para controlar la infección. En aquellos pacientes con viremias intermedias, la realización de una biopsia de protocolo puede contribuir a mejorar su tratamiento.
BIOPSIAS DE PROTOCOLO Y CONTROL DE LA PROGRESIÓN DE LA FIBROSIS
En la disfunción crónica del injerto, se observa una fibrosis intersticial progresiva con expansión del intersticio renal, que se puede cuantificar como la fracción de volumen intersticial cortical renal mediante técnicas de morfometría o análisis de imágenes. En la nefropatía diabética se ha demostrado que el tratamiento con inhibidores de la enzima de conversión contribuye a frenar la progresión de la fibrosis. En cambio, aproximaciones similares han sido poco frecuentes en el campo del trasplante renal. En un ensayo clínico prospectivo 153 pacientes fueron aleatorizados para determinar si el tratamiento con losartán de 100 mg/día contribuye a reducir la progresión de la FI/ AT62, para lo que se evaluó la fracción de volumen intersticial cortical renal en la biopsia basal y a los 5 años. Aunque el objetivo primario (doblar la fracción de volumen intersticial o fracaso del injerto por FI/AT) no alcanzó significación estadística, uno de los objetivos secundarios (doblar la fracción de volumen intersticial o fracaso del injerto por cualquier causa) mostró que el tratamiento con losartán puede contribuir a frenar la progresión de la fibrosis en el trasplante renal. Dado que la progresión de la fibrosis fue menor de la esperada, tal como han mostrado otros estudios33, el ensayo clínico no disponía de suficiente potencia estadística para evaluar los potenciales beneficios de la intervención.
CONCLUSIONES
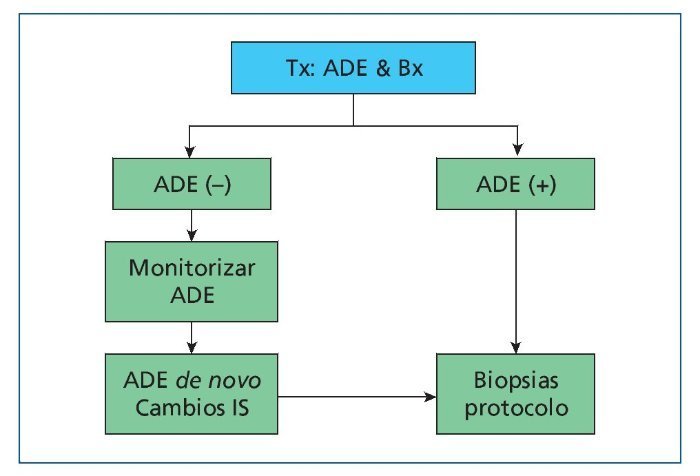
Durante las últimas décadas, muchos grupos han introducido la monitorización histológica con biopsias de protocolo realizadas en injertos renales estables en el seguimiento de los pacientes trasplantados renales. Dado que el procedimiento es seguro y de bajo coste, puede contribuir a un mejor manejo de los pacientes. Sin embargo, las evidencias existentes hoy en día no permiten en muchas ocasiones una toma de decisiones en función de los hallazgos histológicos. Dada la baja prevalencia de rechazo subclínico en los pacientes de bajo riesgo inmunológico tratados con tacrolimus y MMF, la realización de las biopsias solo puede contribuir de forma marginal a mejorar el pronóstico del injerto. No obstante, en aquellos casos en que se requiera modificar o minimizar el tratamiento inmunosupresor, la biopsia de protocolo puede contribuir a un mejor manejo de los pacientes. En los pacientes de alto riesgo inmunológico, la realización de las biopsias de protocolo permite caracterizar la presencia y evolución del rechazo subclínico mediado por anticuerpos y puede contribuir a la toma de decisiones para instaurar tratamientos específicos. Así pues, dada la utilidad de la monitorización inmunológica (anticuerpos anti-HLA) en el seguimiento de los pacientes, proponemos en la figura 1 un esquema de monitorización que combina la determinación de anticuerpos y la realización de biopsias.
Figura 1. Monitorización inmunológica e histológica de los pacientes trasplantados renales. En el momento del trasplante, se recomienda realizar una determinación de anticuerpos anti-HLA y una biopsia preimplante. En los pacientes sin anticuerpos donante específicos, la monitorización de los mismos puede ser suficiente y solo recomendamos la realización de una biopsia en los pacientes que presenten ADE de novo o antes de realizar cambios sustanciales en la inmunosupresión. En los pacientes con anticuerpos donante específicos, la monitorización histológica contribuirá a instaurar los tratamientos específicos necesarios. ADE: anticuerpos donante específicos; Bx: biopsia; IS: inmunosupresión; Tx: trasplante.
En resumen, a la espera de nuevos biomarcadores en sangre u orina, la monitorización histológica contribuye a instaurar una inmunosupresión personalizada en los receptores de trasplante renal y es, sin lugar a dudas, una herramienta imprescindible en la investigación clínica14,15.
RECOMENDACIONES DEL GRUPO
Recomendamos disponer de una biopsia preimplante para evaluar lesiones preexistentes, especialmente en donantes con criterios expandidos (nivel de evidencia moderado). El índice propuesto por el grupo español basado en los criterios de Banff es una herramienta útil para evaluar las lesiones preexistentes, pero no se ha validado el umbral propuesto (descartar órganos con índice > 7).
No recomendamos la monitorización histológica en pacientes de bajo riesgo inmunológico tratados con pautas basadas en tacrolimus combinado con derivados del ácido micofenólico, ya que, hasta la actualidad, no se ha demostrado que aporte beneficios (nivel de evidencia alto).
Recomendamos la monitorización histológica en pacientes con anticuerpos donante específicos preformados (nivel de evidencia moderado), aunque se desconoce si puede contribuir a mejorar el pronóstico del injerto a largo plazo.
Los potenciales beneficios del tratamiento de los episodios de rechazo celular o humoral subclínico no han sido bien establecidos.
Los cambios significativos en el tratamiento inmunosupresor, como la suspensión de los corticoides o el cambio de un anticalcineurínico por un inhibidor de la m-TOR, se asocian a un mayor riesgo de presentar episodios de rechazo agudo. La monitorización histológica antes de la modificación puede contribuir a individualizar el riesgo (nivel de evidencia bajo).
En algunas glomerulopatías primarias, como la nefropatía por IgA o la glomerulonefritis membranosa, la monitorización histológica permite diagnosticar la presencia de recidiva subclínica (nivel de evidencia alto). Sin embargo, su utilidad para instaurar tratamientos específicos no ha sido establecida.
No recomendamos la monitorización histológica para el diagnóstico precoz de la nefropatía por el virus del polioma BK, ya que la monitorización de la viremia es mucho más útil (nivel de evidencia alto).
La monitorización histológica sigue siendo una herramienta imprescindible en la investigación clínica en trasplante renal.
Conflicto de intereses
Los autores declaran que no tienen conflictos de intereses potenciales relacionados con los contenidos de este artículo.
Correspondencia:
Francesc Moreso
Servicio de Nefrología. Hospital Universitari Vall d’Hebron, Barcelona.
fjmoreso@vhebron.net