Antecedentes: La isquemia-reperfusión es causa fundamental de complicaciones renales. La lesión más frecuente es la necrosis tubular aguda (NTA). En modelos de isquemia-reperfusión se ha demostrado que el precondicionamiento oxidativo con ozono ejerce un efecto modulador del estado redox de las células renales, al estimular los mecanismos antioxidantes endógenos. Trabajos más recientes, que han empleado el postcondicionamiento isquémico, han obtenido resultados similares. Objetivos: Evaluar el efecto del poscondicionamiento oxidativo con ozono sobre la morfología y la función renal en un modelo de isquemia-reperfusión en ratas. Métodos: Se utilizaron 40 ratas Wistar hembras con un peso entre 150 y 200 g, divididas al azar en cuatro grupos (control negativo, control positivo, oxígeno y ozono). Los grupos control positivo, oxígeno y ozono fueron sometidos a 60 minutos de isquemia y 10 días de reperfusión. Durante la reperfusión al grupo oxígeno se le administraron 26 mg/kg de peso corporal de oxígeno y al grupo ozono, 0,5 mg/kg de peso corporal de ozono, por vía rectal. Al final del experimento se tomaron muestras de orina y de sangre para las pruebas de función renal y se extrajeron los riñones para el estudio histológico. Resultados: El grupo ozono no mostró diferencias significativas en los valores de fracción de filtración y proteinuria con respecto al grupo control negativo. Los valores de intensidad de filtrado glomerular, flujo plasmático renal y creatinina mostraron una mejoría ligera en comparación con los grupos oxígeno y control positivo. El grupo ozono mostró de forma significativa un menor daño histológico global que los grupos control positivo y oxígeno. Conclusiones: El poscondicionamiento con ozono tuvo un efecto protector en la preservación de la función y de la morfología renal.
Background: Ischaemia-reperfusion is one of the main causes of kidney complications. The most frequent lesion is acute tubular necrosis. Ozone oxidative preconditioning exerts a modulatory effect of redox state of renal cells in models of ischaemia-reperfusion, by stimulating endogenous antioxidant mechanisms. Similar results have been obtained in more recent studies using ischaemic postconditioning. Objectives: To evaluate the effect of ozone oxidative postconditioning on renal function and morphology in an ischaemia-reperfusion rat model. Methods: We used forty female Wistar rats weighing between 150g-200g randomly divided into 4 groups (negative control, positive control, oxygen and ozone). The groups: positive control, oxygen and ozone were subjected to 60 minutes of ischaemia and 10 days of reperfusion. During reperfusion, the oxygen group was given 26mg/kg body weight of oxygen, and the ozone group 0.5mg/kg body weight of ozone, rectally. At the end of the experiment urine and blood samples were taken for renal function tests and kidneys were removed for histological study. Results: The ozone group showed no significant differences for filtration fraction and proteinuria compared to the negative control group. The glomerular filtrate rate, renal plasma flow and creatinine showed a slight improvement in comparison with oxygen and positive control groups. The ozone group showed significantly less overall histological damage than the positive control and oxygen groups. Conclusions: Ozone postconditioning showed to have a protective effect in preserving renal function and morphology.
INTRODUCCIÓN
La isquemia-reperfusión renal (I/R) puede observarse en múltiples patologías en las que exista compromiso del riego sanguíneo de la arteria renal1. La I/R es causa fundamental de complicaciones renales2. La lesión más frecuente es la necrosis tubular aguda (NTA), que se incrementa cuando los tiempos de isquemia sobrepasan los 30 minutos, reflejando que éstos son determinantes en la viabilidad del riñón una vez restablecida la reoxigenación3-6.
La isquemia contribuye a la disfunción endotelial7, lo que crea un desequilibrio entre los agentes vasodilatadores y los agentes vasoconstrictores, desplazándose el equilibrio hacia la producción de estos últimos, lo que culmina con una vasoconstricción no controlada3-5, principalmente de las arteriolas aferentes y de los capilares glomerulares, lo que disminuye el área de filtración y afecta, en el mismo sentido, a la intensidad de filtración glomerular3. El aumento de la resistencia vascular en las arteriolas aferentes y eferentes produce una afectación del flujo sanguíneo renal (FSR) y reduce aún más la intensidad de filtrado glomerular (IFG). Durante la reperfusión se crea un flujo sanguíneo turbulento, capaz de dañar las paredes del endotelio por fuerzas de cizallamiento sobre la íntima vascular, lo que provoca una agudización de los eventos anteriormente planteados en el riñón postisquémico1,8.
La disfunción tubular aparece como consecuencia de la disminución del adenosín trisfosfato (ATP) y la deprivación de oxígeno altera el equilibrio celular8, se produce apoptosis y autofagia, lo que irrevocablemente compromete la función del órgano y la vida del sujeto.
Las alteraciones en el epitelio tubular provocan un proceso inflamatorio que se extiende a nivel sistémico y que conduce al deterioro de la circulación sanguínea y del órgano. Además, con la descamación de la células epiteliales, se produce la obstrucción de los túbulos y, en consecuencia, el incremento de la presión hidrostática de la cápsula de Bowman, que culmina con el descenso de la IFG1,7,9.
En la I/R tiene un papel protagónico la producción de especies reactivas del oxígeno (ERO), que originan un desequilibrio entre la actividad de sistemas prooxidantes y antioxidantes, con predominio de la actividad de los primeros, lo que se conoce como estrés oxidativo10.
Se ha demostrado que el precondicionamiento oxidativo con ozono ejerce un efecto modulador del estado redox de las células tubulares, al estimular los mecanismos antioxidantes endógenos5,11. Trabajos más recientes han obtenido resultados similares mediante el uso de poscondicionamiento con ozono12,13 y poscondicionamiento isquémico14,15.
El objetivo de este trabajo ha sido evaluar el efecto del poscondicionamiento oxidativo con ozono sobre la función y la morfología renal en un modelo de I/R en ratas.
MATERIALES Y MÉTODOS
Se emplearon 40 ratas Wistar hembras jóvenes, con un peso de 150-200 g. Los procedimientos se realizaron según lo aprobado por los comités internacionales para el cuidado de los animales, de acuerdo con las regulaciones ya establecidas para la experimentación animal (ICILAS, 2000).
Las ratas fueron distribuidas en cuatro grupos: control negativo (sham), control positivo (sometido a I/R), oxígeno (sometido a I/R con tratamiento con oxígeno) y ozono (sometido a I/R con tratamiento con ozono).
Todos los animales de todos los grupos fueron anestesiados con pentobarbital sódico por vía intraperitoneal a la dosis de 30 mg/kg de peso corporal y se les administraron 50 U/100 g de peso corporal de heparina por la misma vía. Se les realizó la laparotomía por incisión longitudinal en la línea media hasta llegar a la cavidad peritoneal. Una vez localizado el riñón, se disecaron y expusieron los paquetes vasculares renales y se colocaron clanes hemostáticos durante 60 min con el objetivo de realizar una isquemia renal a todos los animales, excepto a los del grupo control negativo. Posteriormente se procedió a realizar la rafia de la herida y se dejaron evolucionar durante 10 días.
A los animales del grupo oxígeno se les administró una aplicación diaria de 26 mg/kg de peso de oxígeno y a los del grupo ozono se les administró una aplicación diaria de 0,5 mg/kg de peso de ozono. Estos tratamientos se realizaron mediante una cánula rectal, de forma ininterrumpida durante diez días. El ozono se produjo mediante el equipo generador de ozono de uso médico Ozomed, fabricado en el Centro de Investigaciones del Ozono de La Habana, Cuba. El ozono se obtuvo a partir de oxígeno de uso terapéutico y se utilizó inmediatamente después de ser generado5,12,13.
Los tratamientos se comenzaron 12 horas después de realizadas las intervenciones quirúrgicas para evitar posibles interacciones medicamentosas entre el anéstesico y el ozono o el oxígeno. Concluida la última aplicación, los animales fueron colocados durante 24 horas en jaulas metabólicas y se tomaron muestras de orina para las posteriores determinaciones. Se les realizó aclaramiento plasmático compartimental de ácido para-amino hipúrico (PAH) e inulina para determinar el flujo plasmático renal (FPR) e IFG.
Se extrajo sangre por punción intracardiaca para determinar la concentración de creatinina plasmática y a continuación se realizó una laparotomía xifopubiana y se colocó un separador abdominal, se localizaron los riñones y se realizó nefrectomía bilateral para estudio histológico.
Pruebas de función renal
Procedimiento para la realización de aclaramiento plasmático compartimental
A las ratas se les administraron 100 U/100 g de peso corporal de heparina y fueron anestesiadas con 30 mg/kg de peso corporal de pentobarbital sódico por vía intraperitoneal. Se rasuraron ambas regiones inguinales y se realizó una incisión oblicua. Se disecaron ambos paquetes vasculonerviosos y se canuló la vena femoral izquierda. Se administraron 0,8 ml de una solución de 12 mg/ml de PAH e igual volumen de una solución de 2 mg/ml de inulina, para alcanzar niveles plasmáticos adecuados de esas sustancias. Posteriormente, se disecó y canuló la arteria femoral del lado contrario. Con la primera administración de los bolos se definió el tiempo cero y se comenzaron a extraer 0,2 ml de sangre cada 10 minutos hasta completar 10 muestras13,16.
Técnicas para la determinación de las concentraciones de ácido para-amino hipúrico e inulina en plasma
Para la determinación de PAH e inulina, se obtuvo el plasma y se sometió a un proceso de desproteinización mediante sulfato de cadmio.
Para la determinación de PAH se siguió la técnica fotocolorimétrica de Bratton y Marshall17, modificada por Smith18. La inulina se determinó por el método fotocolorimétrico directo del resorcinol17 sin tratamiento alcalino.
Estos aclaramientos se calcularon mediante el análisis de descomposición multicompartimental de las curvas de desaparición respectivas de dichas sustancias en plasma, utilizando para ello un software matemático MATLAB versión 6.5 para Windows15,16.
Técnica microanálitica para la determinación de la concentración de creatinina en plasma
Se obtuvo el plasma y se desproteinizó por el método de tungstato de sodio, modificado por Brot y Sirata19, mediante técnica fotocolorimétrica20.
Determinación de concentración de proteínas
Las concentraciones de las proteínas se determinaron por la técnica fotocolorimétrica de Biuret21.
Estudio histopatológico
Procesamiento histológico
Se seccionaron los riñones mediante un corte sagital a través del hilio. La fijación se realizó en una solución de formol neutro tamponado al 10% (tampón fosfato de sodio 0,01 mM/l, pH 7,4 y se procedió según método convencional de inclusión en parafina. Se realizaron cortes de 3 µm de grosor y se utilizaron dos coloraciones convencionales: hematoxilina y eosina y ácido periódico de Schiff (PAS). Se realizaron estudios por microscopia de luz en un microscopio Nikon 50i, utilizando el lente de aceite de inmersión (1.000 X). Las imágenes se obtuvieron mediante una cámara digital de alta resolución DS-5M-U1 acoplada al microscopio.
Análisis morfológico y morfométrico
Para la valoración del daño histológico global se estudió un corte histológico de la hemisección vertical del riñón derecho de cada animal.
En cada corte se evaluaron 10 campos de la zona córtico-medular, que abarcaron desde el polo superior hasta el inferior de cada riñón, se estudiaron un promedio de 30 a 35 túbulos proximales por animal para un total de 150 a 165 túbulos por grupo de estudio. Se analizaron solamente los túbulos que aparecieron cortados transversalmente y en ellos se determinó la presencia o ausencia de: vacuolización celular; núcleos apoptóticos, balonados o picnóticos; necrosis celular; discontinuidad de la membrana basal tubular (MBT); denudación de la MBT; descamación celular; ribete en cepillo; cilindros en la luz y células inflamatorias peritubulares.
Para la cuantificación de estas variables se utilizó un programa desarrollado para la plataforma .Net, empleando el ambiente de desarrollo Visual Studio 2008, lenguaje c#, en el cual se consideró 0 la estructura histológica normal y 1 las condiciones patológicas de cada variable22.
Para la valoración del daño histológico global se le asignaron diferentes valores a las variables, según su contribución al daño tubular (4, necrosis celular, descamación celular y denudación de la MBT; 3, pérdida del ribete en cepillo y vacuolización celular; 2, cilindros en la luz, células inflamatorias peritubulares y discontinuidad de la MBT; 1, núcleos apoptóticos, balonados o picnóticos). Se estableció un valor límite de daño en ocho, considerada la suma mínima de daño irreversible. Mediante el programa se calculó el porcentaje de túbulos dañados por campo y se obtuvieron 10 valores de daño histológico global para cada animal.
Para el procesamiento estadístico se empleó el programa Graph Pad Prism versión 5.0 para Windows. En todos los casos se determinaron los valores de media y desviación estándar mediante estadística descriptiva. Se realizaron comparaciones entre grupos en cuanto al porciento de túbulos dañados por campo. Para el análisis de las diferencias entre grupos se realizaron las pruebas no paramétricas Kruskal-Wallis y la prueba de comparaciones múltiples de Dunn.
RESULTADOS
Pruebas de función renal
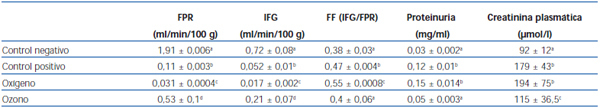
El grupo control positivo tuvo una disminución significativa en relación al control negativo en los valores de FPR e IFG, respectivamente. Entre los grupos control positivo y oxígeno no hubo diferencias estadísticamente significativas. En el grupo ozono el FPR no disminuyó como en los grupos control positivo y oxígeno (tabla 1).
Los grupos control positivo y oxígeno tuvieron un aumento de la FF, y se encontraron los mayores valores en el grupo oxígeno. El poscondicionamiento con ozono no alteró el valor de la FF con respecto al grupo control negativo (tabla 1).
En los resultados analizados no hubo diferencias significativas entre los grupos control negativo y ozono en cuanto a la proteinuria, pero sí con respecto a los otros grupos (tabla 1).
En cuanto al comportamiento de la creatinina, se observaron diferencias significativas en todos los grupos con respecto al control negativo, aunque en el grupo ozono hubo una mejoría que no llegó a los valores normales. Entre los grupos control positivo y oxígeno no hubo diferencias estadísticamente significativas (tabla 1).
Estudio histopatológico
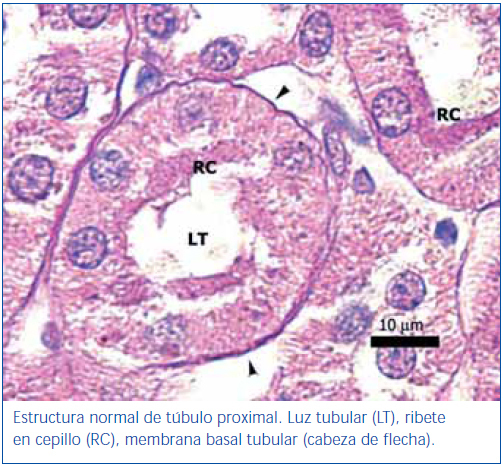
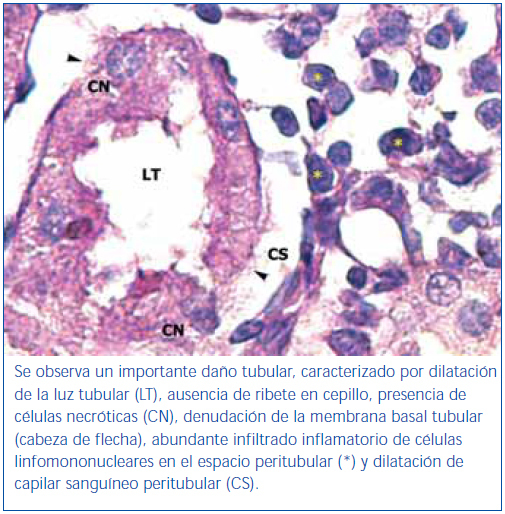
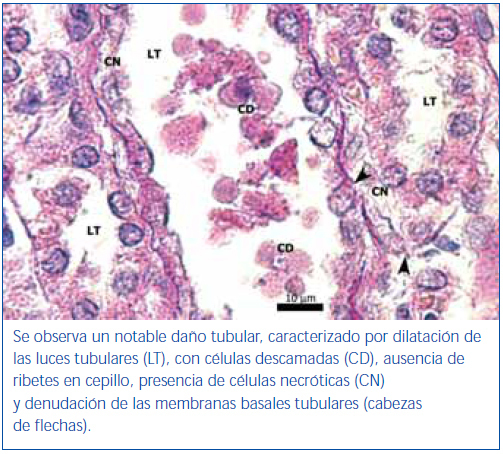
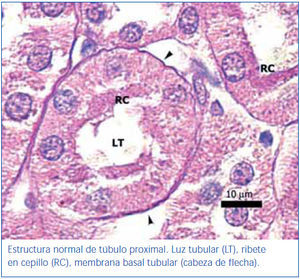
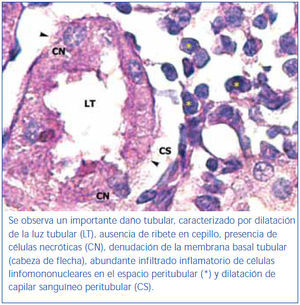
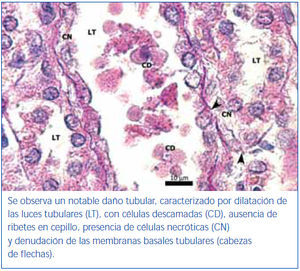
En los animales del grupo control negativo se apreció la estructura normal de los túbulos proximales (figura 1). Los riñones pertenecientes al control positivo y al grupo oxígeno tuvieron un daño importante de la estructura de los túbulos proximales, lo que se evidenció en pérdida del ribete en cepillo, dilatación tubular, necrosis de las células epiteliales, formación de cilindros en la luz tubular, interrupción y/o borramiento de las MBT (figura 2 y figura 3).
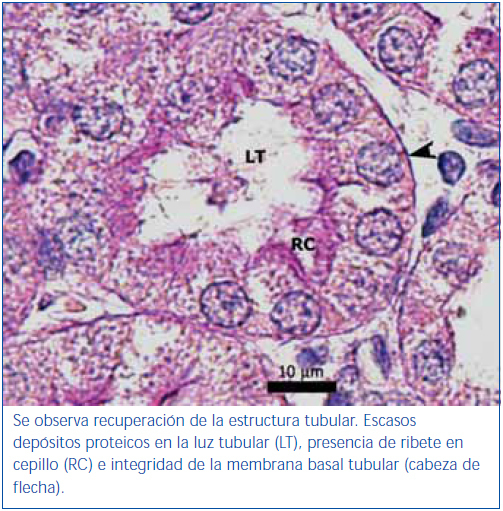
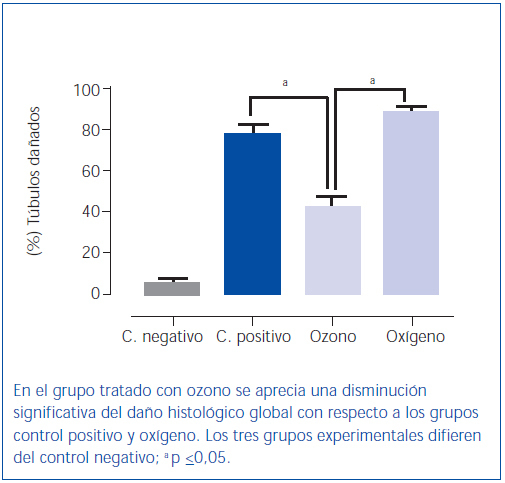
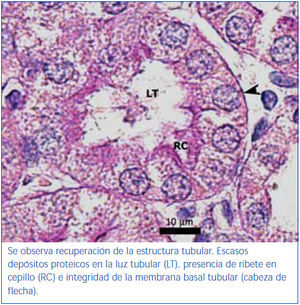
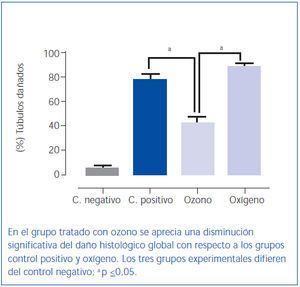
El poscondicionamiento con ozono indujo una recuperación de la morfología tubular. Se observó una mejor preservación del ribete en cepillo y demás estructuras de las células de los túbulos proximales (figura 4). Los animales del grupo ozono mostraron de forma significativa un menor daño histológico global que los grupos control positivo y oxígeno (figura 5).
DISCUSIÓN
Pruebas de función renal
La disminución significativa en los valores de FPR e IFG en el grupo control positivo en relación con el control negativo se debe posiblemente al daño endotelial ocasionado por la isquemia12,13, el cual está agudizado por el aumento de las fuerzas de cizallamiento, que incrementa aún más la disfunción del endotelio y la formación de ERO3.
La isquemia ocasiona un aumento de liberación de renina y, por tanto, de formación de angiotensina; todos estos efectos sumados hacen que el FSR se mantenga disminuido después de la reperfusión y que, por tanto, disminuya el FG23, a lo cual contribuye también la angiotensina por su efecto de disminuir el coeficiente de filtración al actuar sobre las células mesangiales1,3. Además, las ERO alteran la integridad de la barrera de filtración10,22, ya que atacan a muchos de sus componentes como colágeno tipo IV, proteoglicanos y sialoproteínas24-26.
Entre los grupos control positivo y oxígeno no hubo diferencias estadísticamente significativas, lo que demostró que el oxígeno no influyó en la recuperación de la función renal, ya que el oxígeno agudiza la formación de ERO12.
En el grupo ozono se produjo un aclaramiento de PAH e inulina, con valores significativamente más altos que en los grupos control positivo y oxígeno. Este efecto pudiera estar causado por la influencia directa del ozono sobre la oxigenación de los tejidos, ya que mejora la reología de los eritrocitos, aumentando su flexibilidad y carga eléctrica7, con lo que disminuyen la viscosidad de la sangre y la agregación plaquetaria, lo cual mejora el FPR en el riñón sometido a isquemia6,12,14.
En el grupo ozono el FPR no disminuyó como en los grupos control positivo y oxígeno; se filtró una menor fracción de plasma. Este efecto causa una elevación de la presión coloidosmótica del plasma en los capilares glomerulares, menos notoria que en el grupo control positivo y oxígeno y, por tanto, un menor efecto inhibidor sobre la IFG7,23.
La proteinuria es signo de daño renal; la no significación con respecto al control demuestra la protección antioxidante del ozono, disminuyendo las interleucinas proinflamatorias, que se manifiestan en la inflamación que producen las ERO23. Cuando se produce esta inflamación en el glomérulo ocurre una pérdida de la discriminación del tamaño de las moléculas que se filtran25-27 y, en consecuencia, en el producto filtrado aparecen globulinas de elevado peso molecular y albúmina en cantidades que se aproximan a las existentes en el plasma, lo que se observó en el control positivo y en el grupo oxígeno4,23,28.
La creatinina es una sustancia que depende del FG para su aclaramiento24. El grupo ozono presentó una recuperación del índice de filtrado glomerular, en contraste con los otros grupos, lo que se evidencia en el comportamiento de la excreción de creatinina y por tanto en su concentración en el plasma. El oxígeno no influyó en la recuperación de la función.
Estudio histopatológico
La pérdida del ribete en cepillo, la dilatación tubular, la necrosis de las células epiteliales, la formación de cilindros en la luz tubular y la interrupción y/o borramiento de las MBT encontrados en el grupo control positivo constituyen marcadores morfológicos de daño renal inducidos por I/R27,29.
El poscondicionamiento con ozono indujo una recuperación de la morfología tubular y, como consecuencia, en este grupo se constató una mejor conservación de la función renal. Se considera que en el grupo ozono el tejido renal soportó mejor el evento de I/R bajo nuestras condiciones experimentales, debido a las características antioxidantes del ozono que preserva los niveles tisulares de productos avanzados de la glicosilación, lo cual se corrobora con los resultados de Calunga, et al.12.
En cuanto a los resultados histológicos, los nuestros coinciden con los ya enunciados en la literatura, sobre el efecto del poscondicionamiento isquémico en órganos sometidos a I/R12,14.
CONCLUSIONES
El poscondicionamiento con ozono mostró un efecto protector en la preservación de la función renal y la disminución del daño histológico global de los túbulos proximales inducido por I/R.
La efectividad del poscondicionamiento con ozono permitiría su aplicación ante el daño renal por I/R. Este tipo de tratamiento tiene la ventaja respecto a los precondicionantes de que puede ser aplicado en situaciones clínicas no previstas.
Fuente de financiación
Instituto de Ciencias Básicas y Preclínicas Victoria de Girón, Departamento de Fisiología, Laboratorio de Fisiología Renal.
Tabla 1. Efecto del poscondicionamiento oxidativo con ozono sobre las pruebas de función renal
Figura 1. Túbulo proximal de región córtico-medular de animal control negativo. Coloración de PAS.
Figura 2. Túbulo proximal de región córtico-medular de animal control positivo. Coloración de PAS.
Figura 3. Túbulo proximal de región córtico-medular de animal tratado con ozono. Coloración de PAS.
Figura 4. Segmentos de túbulos proximales de región córtico-medular de animal tratado con oxígeno. Coloración de PAS.
Figura 5. Daño histológico global.