El trasplante renal de donante vivo ABO incompatible era considerado una contraindicación absoluta. Desde hace años, se realiza con buenos resultados.
ObjetivoNuestro objetivo es mostrar los resultados de este tipo de trasplante realizado en nuestro hospital.
MétodosEstudiamos 48 pacientes con una edad media de 50,9±10,9 años. Seguimiento 44,6±30,9 meses. Acondicionamiento: rituximab 375mg/m2, tacrolimus, micofenolato mofetilo o micofenolato sódico, prednisona, plasmaféresis/inmunoadsorción e inmunoglobulina intravenosa. Títulos de isoaglutininas aceptados para trasplantar: IgG e IgM inferiores a 1:8.
ResultadosIsoaglutininas preproceso: IgG 1:124±1:140, IgM 1:77±1:55.Tras 6±3 sesiones, la IgG descendió a<1:8 en 47 pacientes, a<1:16 en uno; la IgM fue<1:8 en todos. Veinticuatro pacientes (50%) presentaron hematoma, 7 reintervención (14,6%) y 29 (60%) necesitaron transfusión. Al quinto año presentaron rechazo agudo 5 pacientes (8,7%), CMV 9 (19,7%), viremia BK 5 (12,4%), diabetes postrasplante 10 (23,4%), linfocele 3 (6,4%). La supervivencia del paciente fue del 97,1% al quinto año y la del injerto, del 95,7% al año y del 93% al quinto año. Pérdida de injerto: trombosis (n=1), rechazo mixto (n=1) y exitus (n=2). La creatinina al año y a los 3 años fue de 1,4±0,4mg/dl y de 1,3±0.3mg/dl al quinto año. La proteinuria al año, a los 3 y a los 5 fue de 0,2±0,2g/24h.
ConclusionesEl trasplante renal de donante vivo ABO incompatible tras acondicionamiento con rituximab, plasmaféresis/inmunoadsorción e inmunoglobulinas es una opción válida y ofrece excelentes resultados de supervivencia, con una baja incidencia de rechazo agudo sin aumento de complicaciones infecciosas. Se evidencia una mayor tendencia al sangrado postoperatorio.
ABO-incompatible living-donor kidney transplantation was regarded as an absolute contraindication. However, it has been carried out for years with good outcomes.
ObjectiveOur aim was to show the results obtained with this technique in our hospital.
MethodsForty-eight patients with a mean age of 50.9±10.9 years were included. Follow-up was 44.6±30.9 months. Conditioning: rituximab 375mg/m2, tacrolimus, mycophenolate mofetil or mycophenolate sodium, prednisone, plasmapheresis/immunoadsorption and intravenous immunoglobulin. Accepted IgG and IgM titres for transplantation:<1:8.
ResultsPre-process IgG titre 1:124±1:140, IgM titre 1:77±1:55. After 6±3 sessions, IgG decreased to<1:8 in 47 patients and to<1:16 in one. IgM was<1:8 in all cases. Twenty-four patients (50%) had haematoma, 7 re-intervention (14.6%), 29 (60%) required transfusion. At 5 years, acute rejection had occurred in 5 cases (8.7%), CMV infection in 9 (19.7%), BK viraemia in 5 (12.4%), post-transplant diabetes in 10 (23.4%) and lymphocele in 3 (6.4%). Patient survival was 97.1% at 5 years and graft survival 95.7% at one year and 93% at 5 years. Causes of graft loss: thrombosis (n=1); mixed rejection (n=1); and death (n=2). Serum creatinine levels were 1.4±0.4mg/dl at one and 3 years and 1.3±0.3mg/dl at 5 years. Proteinuria was 0.2±0.2g/24h at one, 3 and 5 years.
ConclusionsABO-incompatible living-donor kidney transplantation after conditioning with rituximab, plasmapheresis/immunoadsorption and immunoglobulins is a valid option offering excellent outcomes. There is a low incidence of acute rejection and no increase in infectious complications. An increased tendency for postoperative bleeding was found.
La incompatibilidad ABO fue considerada como una contraindicación absoluta para el trasplante renal en las guías EDTA en 20001. Desde 1987, primero en Japón, debido a la escasez de donantes fallecidos, y posteriormente en Europa, Estados Unidos y últimamente en Corea, Australia y España, el trasplante renal de donante vivo ABO incompatible (TRDV ABOi) es una técnica comúnmente empleada para paliar el déficit de donantes. Estos resultados han hecho modificar las guías, que excluyen el TRDV ABOi como una contraindicación absoluta2.
Existen diversos protocolos de acondicionamiento que varían en pautas, dosis de medicación o en los métodos de depuración de anticuerpos3 y que, por tanto, hacen difícil extraer conclusiones con un alto nivel de evidencia y aconsejar cuál es el mejor esquema4. En general, el acondicionamiento se basa en deplecionar anticuerpos (isoaglutininas), ya sea por la retirada de los mismos mediante plasmaféresis (PFS) o inmunoadsorción (IA), o por el uso de agentes deplecionantes de linfocitos B como rituximab (RTX), que sustituye a la esplenectomía. Los resultados demuestran porcentajes muy elevados de supervivencia tanto del paciente como del injerto, siendo más variable la tasa de complicaciones, tanto de rechazo agudo como de infecciones o neoplasias.
El objetivo del estudio es analizar el pronóstico de los pacientes que recibieron un TRDV ABOi en nuestro hospital desde 2008 hasta 2018 y comparar los resultados con otras series.
MétodosEl Hospital Universitario de A Coruña ha realizado, desde enero de 1981 hasta junio de 2018, 3.180 trasplantes renales; 273 fueron de donante vivo, de los que 48 fueron realizados con un donante ABO incompatible y 23 con un donante HLA incompatible.
En el estudio fueron incluidos todos los pacientes que recibieron un TRDV ABOi, y 3 pacientes que, además de ABOi, eran HLA incompatibles. Los pacientes previamente aceptaron y firmaron el protocolo de TRDV ABOi después de recibir información por parte de los servicios involucrados en el trasplante renal.
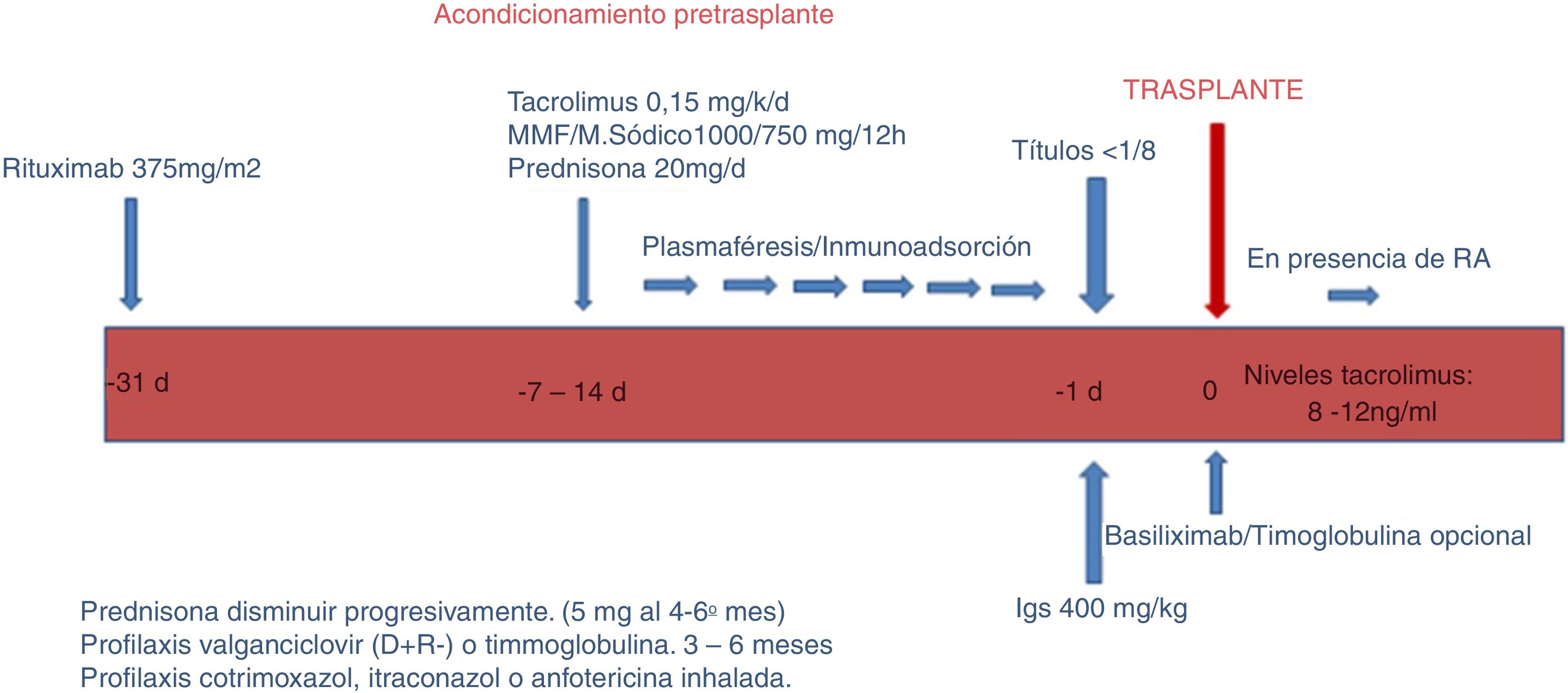
El protocolo empleado en nuestro hospital consta de 3 fases: fase de acondicionamiento, trasplante renal propiamente dicho y seguimiento.
- a)
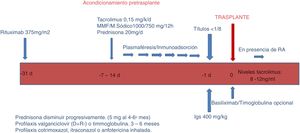
Fase de acondicionamiento (fig. 1).
En esta fase, el objetivo es reducir los anticuerpos ABO (isoaglutininas) hasta un alcanzar un título igual o inferior a 1:8, empleando RTX, aféresis, inmunosupresión e inmunoglobulinas.
- 1.
RTX. Un mes antes del trasplante, los pacientes reciben una única dosis de RTX 375mg/m2 (MabThera®; Roche, Grenzach-Wyhlen, Alemania).
- 2.
Aféresis. Se realizaron sesiones de PFS, IA o ambos, dependiendo del título de isoaglutininas pretrasplante. Para la PFS se emplearon filtros de separación plasmática convencionales; para la IA, columnas Glycosorb®-ABO (Glycorex Transplantation, Lund, Suecia). Dos de 3 pacientes, que además estaban sensibilizados frente a HLA, realizaron IA con columnas TheraSorb® (Miltenyi Biotec, Bergisch Gladbach, Alemania).
En la titulación de isoaglutininas se emplearon, para IgM, técnica salina en microtarjeta de gel (tarjetas Reverse Diluent, Ortho-Clinical Diagnostics, Raritan, NJ, EE. UU.). Para IgG se estimó mediante una técnica de antiglobulina en microtarjeta de gel (Anti-C3d, Polyspecific, Ortho-Clinical Diagnostics). Se analizaron los títulos de isoaglutininas (IgG e IgM) antes y después de cada proceso de aféresis. Se incrementaba el volumen de plasma o se cambiaba la técnica de aféresis (de PFS a IA) en función del descenso de las titulaciones.
- 3.
Inmunosupresión. Dependiendo de la duración de la aféresis, los pacientes inician tratamiento inmunosupresor una o 2 semanas antes del trasplante con tacrolimus de liberación rápida o retrasada (0,15mg/kg) para alcanzar unos niveles de 8-12ng/ml, micofenolato mofetilo (CellCept®, Roche, Grenzacch-Wyhlen, Alemania) o micofenolato sódico (Myfortic®, Novartis, Barcelona, España) en dosis 2g o 1.440mg/día, respectivamente, y prednisona en dosis inicial 20mg/día.
- 4.
Inmunoglobulinas. El día previo al trasplante se administraba una sola dosis de inmunoglobulinas (Flebogamma® 5%, Instituto Grifols, Barcelona, España) de 400mg/kg. En 3 pacientes HLA incompatibles, empleamos gammaglobulina anti-CMV específica (Cytotect®, Biotest Pharma GmbH, Alemania; 100mg/kg) tras cada sesión de aféresis.
- b)
Fase de trasplante renal propiamente dicho.
Con respecto a la inducción, desde 2015 utilizamos basiliximab (Simulect®) en pacientes con mayor incompatibilidad HLA, o niveles de tacrolimus inadecuadamente bajos. Actualmente forma parte de nuestro protocolo de inducción en TRDV. Utilizamos 2 dosis de 20mg administradas el día del trasplante y el cuarto día.
La técnica quirúrgica en el donante fue nefrectomía laparoscópica y en el receptor, trasplante renal mediante incisión en la fosa ilíaca derecha con técnica habitual y dejando sonda de doble J tras la reconstrucción ureteral.
En el postoperatorio inmediato realizamos controles hemodinámicos y función renal, vigilancia de la herida quirúrgica y de complicaciones postoperatorias. Se realiza un eco-doppler renal en las primeras 12h postrasplante. Los títulos de isoaglutininas se determinan una vez en la primera semana o cuando aparece un deterioro de la función renal.
Se ajusta la inmunosupresión según niveles de tacrolimus (8-12ng/ml el primer mes, entre 8 y 10ng/ml entre el primer y el tercer mes y entre 6 y 8ng/ml a partir del tercer-sexto mes) y everolimus (3 y 8ng/ml). Las dosis de micofenolato sódico son 720mg cada 12h y de micofenolato mofetilo 1.000mg cada 12h el primer mes. Tras una dosis de inducción de 250mg de metilprednisolona (cuando se emplea basiliximab), se continúa con 20mg diarios, que se reducen progresivamente hasta 5mg/día a partir del quinto-sexto mes. No se suspenden esteroides por protocolo. Los pacientes reciben profilaxis con cotrimoxazol durante 6 meses e itraconazol durante 4-5 meses (últimamente la anfotericina B inhalada sustituye al itraconazol). Los pacientes con serología CMV D+/R− reciben profilaxis con valganciclovir oral durante al menos 3 meses. Si se presenta función retrasada del injerto, se realiza una biopsia renal.
- c)
Seguimiento.
Los pacientes son revisados cada semana durante el primer mes, cada 2 semanas los 2 primeros meses, mensualmente hasta los 6 meses y luego cada 2-3 meses hasta cumplir un año. Las revisiones posteriores se realizan cada 3 meses. La retirada de la doble J se realiza ambulatoriamente por el servicio de urología al mes postrasplante.
En las revisiones se monitorizan las constantes vitales, la función renal y la inmunosupresión. Se realiza un control de prevención de enfermedad cardiovascular, neoplasias, infecciones oportunistas, medidas dietéticas y estudio de metabolismo calcio-fósforo. Ante un deterioro de la función renal se realiza un eco-doppler renal, ajuste de la inmunosupresión y biopsia renal si no es identificada la causa de dicho deterioro.
Las variables estudiadas fueron: demográficas (edad, sexo, modalidad y tiempo en diálisis, parentesco, grupo sanguíneo, presencia de anticuerpos HLA); derivadas de la técnica (clase de aféresis: PFS, IA, ambas; título de isoaglutininas [IgG e IgM] y descenso en relación con la técnica, número de sesiones empleadas y volumen plasmático depurado por sesión, coagulación pretrasplante según la técnica: plaquetas preproceso y pretrasplante, tiempo de protrombina, tiempo parcial de tromboplastina activada, niveles de fibrinógeno). Se estudió la supervivencia renal y del paciente; la función renal se midió según creatinina en mg/dl y proteinuria en g/24h; complicaciones quirúrgicas: trombosis, hematoma-hemorragia, necesidad de reintervención; complicaciones infecciosas: CMV y BK (PCR>700 copias). Función retrasada del injerto (necesidad de diálisis o no descenso de la creatinina en la primera semana postrasplante), rechazo agudo demostrado por biopsia según la clasificación de Banff 20175, rebote de isoaglutininas mediante el título en la primera semana postrasplante.
Análisis estadísticoSe utilizaron la t de Student y el ANOVA para comparar las variables cuantitativas; la prueba de Mann-Whitney y la de Kruskal-Wallis cuando la distribución no era normal; la Chi cuadrado y el test de Fisher para variables cualitativas. Se calculó la supervivencia según Kaplan-Meier y log rank test. Estudio multivariado: regresión de Cox. Programa SPSS (versión 15.0.1, SPSS, Inc., Chicago, IL, Estados Unidos).
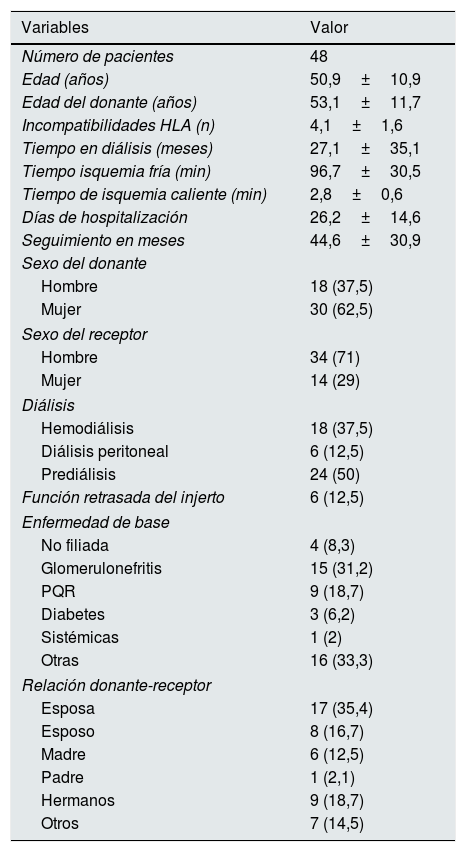
ResultadosEstudiamos 48 pacientes (34 varones) con una edad media de 50,9±10,9 años, 18 en hemodiálisis, 6 en diálisis peritoneal y 24 en prediálisis (tiempo en diálisis: 27,1±35,1 meses). La incompatibilidad de grupos fue: A-0 (n=35), B-0 (n=6), AB-0 (n=2), AB-B (n=2), A-B (n=2), B-A (n=1). El grado de parentesco más frecuente entre donante y receptor fue entre esposos (n=25; 52,1%). El período de seguimiento fue de 44,6 meses (3-117), con una mediana de 30,97. Otras características basales y demográficas se reflejan en la tabla 1.
Datos demográficos
| Variables | Valor |
|---|---|
| Número de pacientes | 48 |
| Edad (años) | 50,9±10,9 |
| Edad del donante (años) | 53,1±11,7 |
| Incompatibilidades HLA (n) | 4,1±1,6 |
| Tiempo en diálisis (meses) | 27,1±35,1 |
| Tiempo isquemia fría (min) | 96,7±30,5 |
| Tiempo de isquemia caliente (min) | 2,8±0,6 |
| Días de hospitalización | 26,2±14,6 |
| Seguimiento en meses | 44,6±30,9 |
| Sexo del donante | |
| Hombre | 18 (37,5) |
| Mujer | 30 (62,5) |
| Sexo del receptor | |
| Hombre | 34 (71) |
| Mujer | 14 (29) |
| Diálisis | |
| Hemodiálisis | 18 (37,5) |
| Diálisis peritoneal | 6 (12,5) |
| Prediálisis | 24 (50) |
| Función retrasada del injerto | 6 (12,5) |
| Enfermedad de base | |
| No filiada | 4 (8,3) |
| Glomerulonefritis | 15 (31,2) |
| PQR | 9 (18,7) |
| Diabetes | 3 (6,2) |
| Sistémicas | 1 (2) |
| Otras | 16 (33,3) |
| Relación donante-receptor | |
| Esposa | 17 (35,4) |
| Esposo | 8 (16,7) |
| Madre | 6 (12,5) |
| Padre | 1 (2,1) |
| Hermanos | 9 (18,7) |
| Otros | 7 (14,5) |
Los datos se expresan como media±desviacion estándar o n (%).
No se registraron efectos adversos tras la administración de RTX. La PFS fue la técnica de aféresis mayormente empleada: 32 pacientes recibieron PFS, 10 recibieron IA y 6, ambos procedimientos. Los títulos IgG preproceso eran: 1:0 (n=2), 1:2 (n=1), 1:8 (n=4), 1:16 (n=2), 1:32 (n=6), 1:64 (n=13), 1:128 (n=10), 1:256 (n=6), 1:512 (n=4). Los títulos IgM preproceso eran: 1:0 (n=2), 1:2 (n=1), 1:4 (n=1), 1:8 (n=4), 1:16 (n=9), 1:32 (n=14), 1:64 (n=8), 1:128 (n=4), 1:256 (n=4), 1:1.024 (n=1).
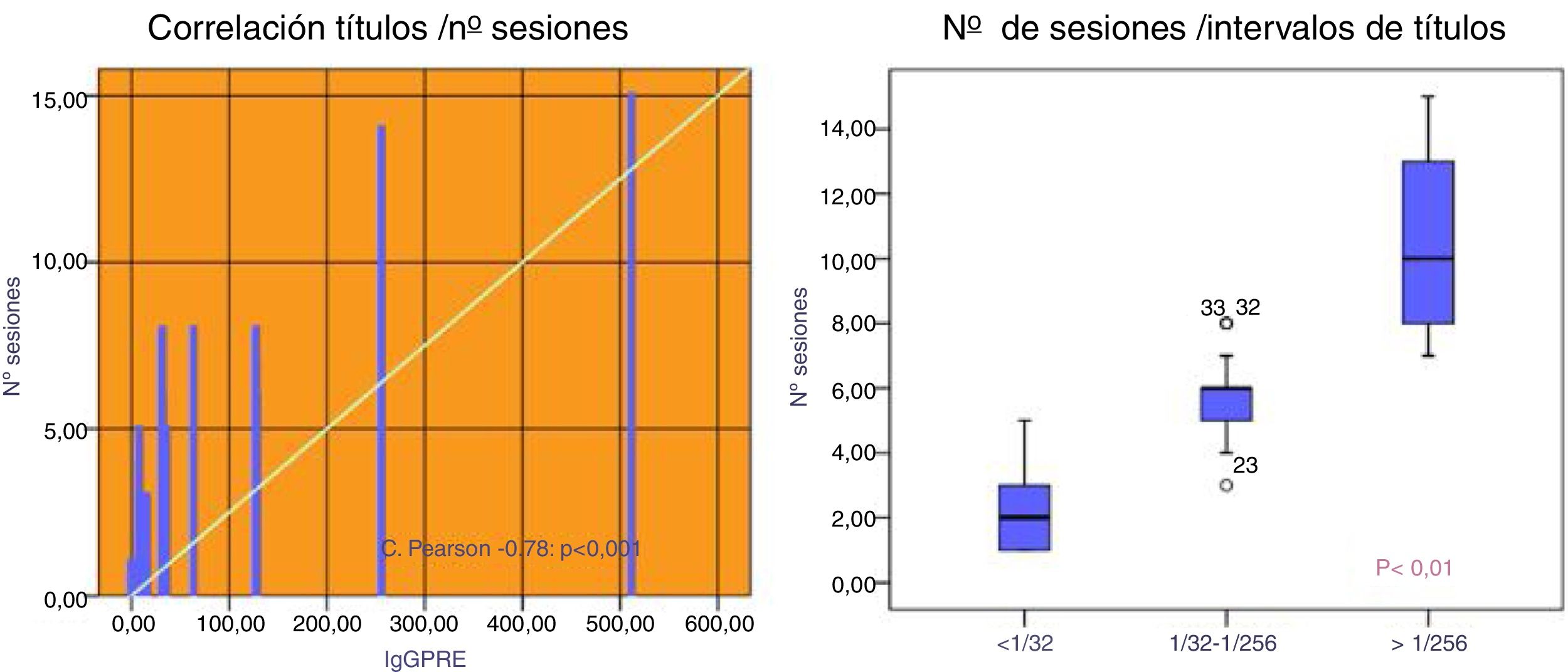
Tras 6±3 sesiones se redujo el título de IgG a<1:8: en 47 pacientes y a<1:16 en un paciente que presentó un título 1:16 la mañana del trasplante, siendo de 1:8 el día anterior. Conociendo la variación del título y la experiencia de otros grupos en aceptar hasta 1:32, se procedió al trasplante. El título de IgM fue<1:8 en los 48 pacientes.
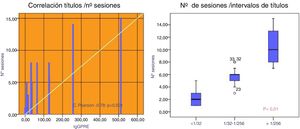
Los pacientes con un título inicial de IgG<1:32 necesitaron 2,3±1,5 sesiones y mayormente PFS (86%). Aquellos con un título 1:32-1:256 necesitaron 5,6±1,2 sesiones, siendo utilizada la PFS en el 65% de ellas. Los pacientes que presentaban títulos iniciales mayores de 1:256 necesitaron 10,3±2,9 sesiones, utilizándose IA en el 100% de los casos (75%de forma aislada y 25% conjuntamente con PFS), p<0,001 (fig. 2).
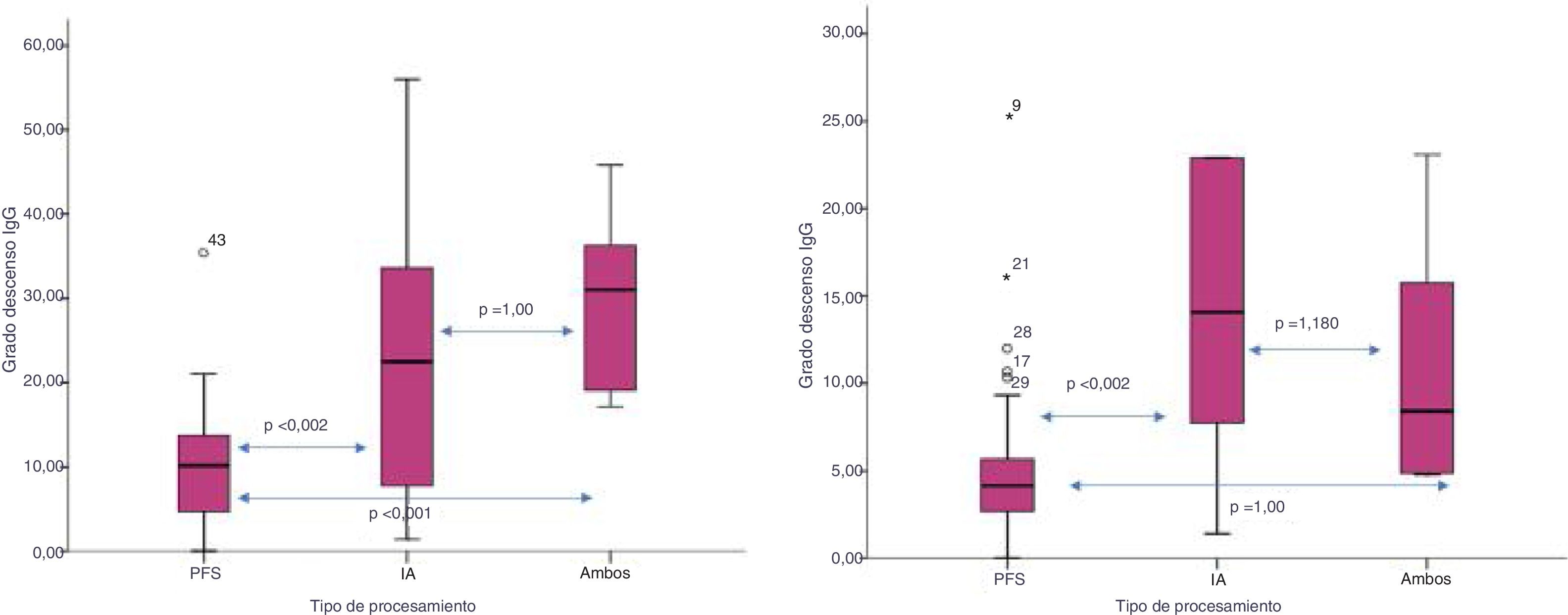
El grado de descenso de isoaglutininas IgG (IgG pre-IgG post/número de sesiones) fue mayor cuando empleamos IA o ambas técnicas frente a PFS: 24,9±17 vs. 30±10,7 vs. 10,6±7,6, respectivamente (p<0,002). Este descenso también fue mayor para IgM empleando IA frente a ambas técnicas o PFS: 27,2±35 vs. 18,8±7 vs. 5,3±5, respectivamente (p=0,002) (fig. 3).
Tres pacientes estaban sensibilizados frente a HLA. Dos presentaban una MFI frente a clase i de 9.100 y 5.300 y una MFI frente a clase ii de 15.600 y 2.500, respectivamente. Otra paciente presentaba sensibilización solo frente a clase i, con una MFI de 3.900. Los títulos de isoaglutininas IgG en los 2 primeros pacientes eran de 1:64 y 1:128, respectivamente, y los de IgM, de 1:32. La tercera paciente presentaba IgG 1:128 e IgM 1:256. Dos pacientes recibieron IA con columnas TheraSorb® y un paciente recibió PFS. Los títulos de isoaglutininas IgG descendieron a 1:4, 1:8 y 1:2, respectivamente, y los de IgM, a 1:2 en todas. Las MFI postrasplante fueron<1.000 (150-600) tanto para la clase i como para la clase ii.
El número de sesiones de PFS postrasplante fue de 1,4±0,38, aunque desde 2013 no realizamos aféresis postrasplante.
No hubo rebote de isoaglutininas postrasplante, siendo el título de IgG postrasplante de 1:3,6±1:4 (0-16) y el título de IgM, de 1:2,3±1:4,8 (0-32). El título postrasplante era mayor en función de los títulos preacondicionamiento, no estadísticamente significativa para IgG, pero sí para IgM: 1:10±1:14 para IgM>1:256 vs. 1:2,5±1:2,6 para 1:32-1:256 vs. 1:1±1:1,3 para<1:32 (p=0,008).
El tiempo transcurrido desde la última sesión de aféresis hasta el trasplante fue de 29,8h. El tiempo era inferior cuando empleábamos IA: 12,2±11,6h frente a 34,6±12,6h cuando empleábamos PFS (p=0,001), o 33,6±18,9h cuando empleábamos ambas técnicas (p=0,01).
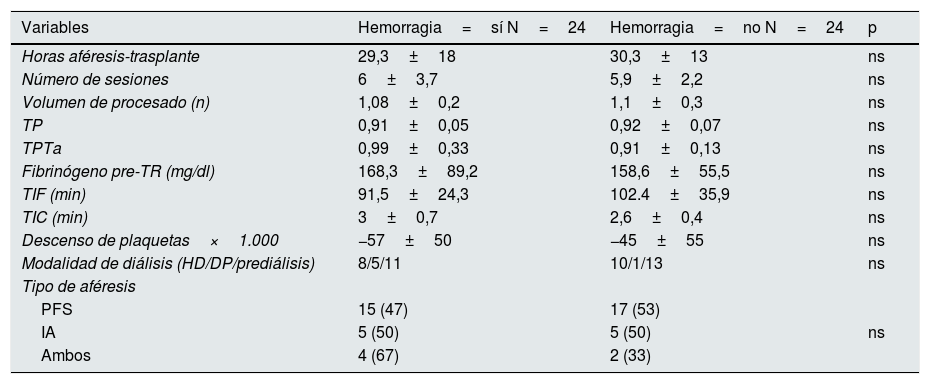
El tiempo de isquemia fría fue de 96,7±3min y el tiempo de isquemia caliente, de 2,8±0,6min. Veinticuatro pacientes (50%) presentaron hematoma/sangrado postoperatorio –de los que 7 (14,6%) tuvieron que ser reintervenidos– y 29 (60,4%) necesitaron transfusión. La reintervención se realizó en 6 pacientes que habían recibido PFS y en un paciente con ambas técnicas. La necesidad de transfundir se dio en 19 pacientes que habían recibido PFS, en 6 con IA y en 4 con ambas técnicas. La presencia de hematoma se produjo en 15 pacientes que recibieron PFS, en 5 con IA y en 4 con ambas técnicas (sin significación estadística). No encontramos diferencias en el número de plaquetas, TP, TPTa, fibrinógeno, tipo de aféresis, número de sesiones, tiempo en diálisis o tiempo desde la última sesión de aféresis hasta la intervención. Según la técnica de aféresis empleada, la IA presentaba mayor trombocitopenia pretrasplante: 104±23 vs. 170±45×103 (p<0,001) que la PFS o 149±13×103 con ambas técnicas (p=0,09) y unos niveles de fibrinógeno más altos pretrasplante: 210±80 vs. 156±73 que PFS o 141±27 con ambas técnicas (sin significación estadística). La suma de trombocitopenia asociada a IA e hipofibrinogenemia asociada a PFS podría explicar la incidencia de hematoma, aunque no resultó estadísticamente significativa (tabla 2). La incidencia de hematoma/sangrado es similar a la observada en el trasplante renal HLA incompatible pero superior a la de los pacientes que reciben un trasplante renal de donante vivo ABO compatible, que en nuestro grupo es de un 8%.
Hemorragia postoperatoria
| Variables | Hemorragia=sí N=24 | Hemorragia=no N=24 | p |
|---|---|---|---|
| Horas aféresis-trasplante | 29,3±18 | 30,3±13 | ns |
| Número de sesiones | 6±3,7 | 5,9±2,2 | ns |
| Volumen de procesado (n) | 1,08±0,2 | 1,1±0,3 | ns |
| TP | 0,91±0,05 | 0,92±0,07 | ns |
| TPTa | 0,99±0,33 | 0,91±0,13 | ns |
| Fibrinógeno pre-TR (mg/dl) | 168,3±89,2 | 158,6±55,5 | ns |
| TIF (min) | 91,5±24,3 | 102.4±35,9 | ns |
| TIC (min) | 3±0,7 | 2,6±0,4 | ns |
| Descenso de plaquetas×1.000 | −57±50 | −45±55 | ns |
| Modalidad de diálisis (HD/DP/prediálisis) | 8/5/11 | 10/1/13 | ns |
| Tipo de aféresis | |||
| PFS | 15 (47) | 17 (53) | |
| IA | 5 (50) | 5 (50) | ns |
| Ambos | 4 (67) | 2 (33) | |
Los datos se expresan como media±desviacion estándar o n (%).
Los pacientes recibieron tacrolimus de liberación rápida (n=38) y tacrolimus de liberación retrasada (n=10), micofenolato mofetilo (n=23), micofenolato sódico (n=23) y everolimus (n=2). Todos recibieron esteroides desde el inicio. Durante el seguimiento, 15 pacientes modificaron su inmunosupresión por toxicidad (n=6), neoplasias (n=2), infección (n=2) y otras (n=5). El cambio de anticalcineurínico a i-mTOR se realizó suspendiendo los anticalcineurínicos una vez que el i-mTOR alcanzaba niveles en rango terapéutico (3-8ng/ml), generalmente al cuarto día de su inicio. El cambio de derivados del ácido micofenólico por otro o por i-mTOR se realizó de forma inmediata. La retirada de esteroides se realizó en 9 pacientes por efectos adversos. No se registraron reacciones adversas en la administración de inmunoglobulinas.
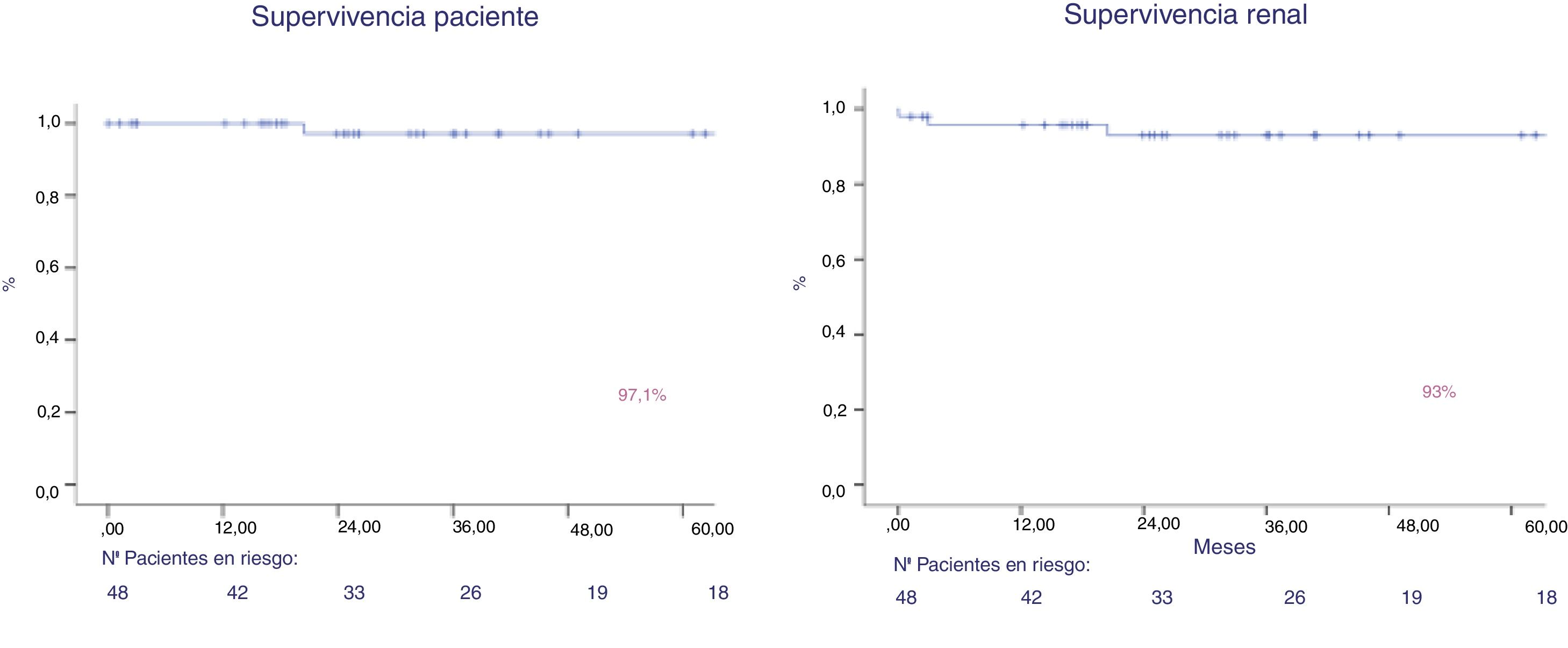
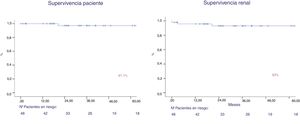
Tras un seguimiento de 44,6 meses, la supervivencia del paciente es del 97% y la supervivencia del injerto (muerte no censurada) es del 93% al año y a los 5 años (fig. 4). Dos pacientes perdieron el injerto, por trombosis venosa y por rechazo mixto. Dos pacientes perdieron su injerto por fallecimiento. Ambas mantenían la función del injerto previo al deceso.
Cinco pacientes presentaron rechazo agudo (8,7% al quinto año): 2 borderline, 2 1A, tratados con esteroides y uno mixto (mediado por anticuerpos y células T) que no respondíó al tratamiento con esteroides, timoglobulina, PFS, inmunoglobulinas y eculizumab (paciente doblemente sensibilizada HLA y ABO). A pesar de que la tinción C4d fue positiva en 3 de los 4 pacientes, que presentaron rechazo mediado por células T, no consideramos la positividad C4d un marcador de rechazo, ya que su presencia, en el trasplante ABOi, suele asociarse a un proceso de acomodación. Además, no encontramos aumento de isoaglutininas ni otros signos histológicos de rechazo mediado por anticuerpos (BANF 2017). La paciente que presentó un rechazo mixto (mediado por células y por anticuerpos HLA) mostraba un incremento de los anticuerpos anti-HLA (sin aumento del título de isoaglutininas) y datos histológicos de rechazo mediado por anticuerpos.
Se asoció la presencia de rechazo a la edad del donante: 66,6±11,7 vs. 51,7±10,7años (p=0,01), un menor número de sesiones de aféresis: 3,4±2,8 vs. 6,3±2,9 (p=0,04), una función retrasada del injerto: 50 vs. 4,8% (p=0,01) y grado de descenso de IgG: 4,9±4,5 vs. 17,3±13,1 (p=0,04). En los pacientes que sufrieron rechazo agudo, el título de IgG postrasplante fue 1:2±3,4 vs. 1:3,8±4 (sin significación estadística). El número menor de sesiones de aféresis y del descenso de IgG se relaciona con un título menor de isoaglutininas preacondicionamiento y, por tanto, con un menor número de sesiones necesarias para conseguir títulos<1:8. En el análisis de Cox, la ausencia de función retrasada del injerto se considera un factor para no presentar rechazo: Exp(B) 0,11 (IC 95% 0,01-0,78) y edad del donante un factor de riesgo: Expo(B) 1,11 (IC 95% 1.007-1,239). Probablemente el tamaño muestral sea bajo para extraer estas conclusiones.
Complicaciones infecciosas postrasplante: viremia CMV=9 (16,7% al quinto año), viremia BK=5 (12,4% al quinto año). De los factores de riesgo analizados, los pacientes que presentaron CMV tenían una edad de 57,7±9,8 frente a 49,3±10,7 años los que no (p=0,03), y la replicación BK era más frecuente en diabéticos postrasplante (30 vs. 5%; p=0,05) o en los que presentaban rechazo agudo (40 vs. 6,5%; p=0,07). En el análisis de Cox no había significación. No encontramos asociación de complicaciones infecciosas con mortalidad.
Otras complicaciones: diabetes postrasplante 10 (23,4% al quinto año), linfocele 3 (6,3%), estenosis arteria renal 2 (4,2%), neoplasias: un carcinoma de células claras en el riñón nativo al séptimo año postrasplante (3%) y un carcinoma epidermoide cutáneo (tabla 3).
Complicaciones del postrasplante ABO incompatible
| Complicaciones | % |
|---|---|
| Función retrasada del injerto | 12,5 |
| Rechazo agudo al quinto año | 8,7 |
| Viremia CMV al quinto año | 19,7 |
| Viremia BK al quinto año | 12,4 |
| Diabetes postrasplante al quinto año | 23,4 |
| Linfocele al quinto año | 6,4 |
| Estenosis de la arteria renal al quinto año | 4 |
| Neoplasias al quinto año | 4 |
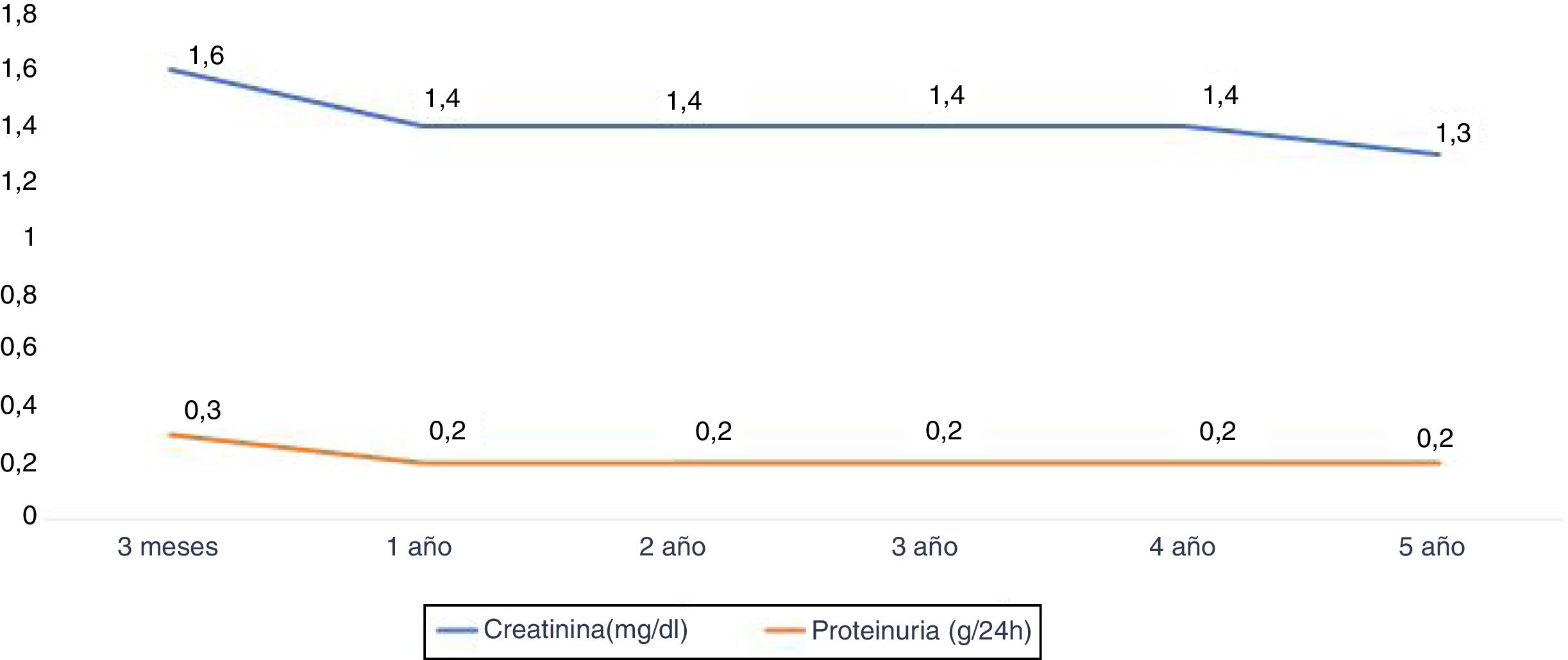
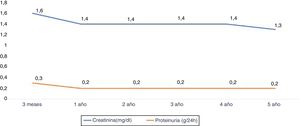
La función renal medida según la creatinina al año y a los 2, 3, 4 y 5 años fue de 1,4±0,5, 1,4±0,4, 1,4±0,4, 1,4±0,4 y 1,3±0,5mg/dl, respectivamente. La proteinuria al año y a los 3 y 5 años fue de 0,2±0,2g/24h (fig. 5).
DiscusiónEn un metaanálisis, Lo et al.4 analizan 4.810 trasplantes renales ABOi realizados bajo distintos protocolos de acondicionamiento hasta 2015, demostrando excelentes resultados, por lo que la contraindicación de este tipo de trasplante, recomendada inicialmente en las guías europeas en 20001, ha sido modificada2.
En nuestro hospital se inició el TRDV ABOi en el año 2008 y desde entonces hemos realizado 48. La supervivencia del paciente en este estudio es del 97%. En la mayor parte de las series supera el 90%. Las diferencias suelen estar relacionadas con el tiempo de seguimiento, los protocolos de acondicionamiento, el período de estudio y las complicaciones infecciosas4,6–10, aunque en una revisión actual de 930 trasplantes ABOi vs. 89.713 ABO compatibles, Mustian et al.11 encuentran un aumento del riesgo de muerte al año de 1,81 (1,26-2,6) y al tercer año de 1,55 (1,21-1,98) relacionado con la edad>50 años y la presencia de rechazo agudo.
Se ha asociado la mortalidad de causa infecciosa con el uso de RXT, aunque esta afirmación resulta controvertida. Koo y Yang reflejan la existencia de una importante heterogeneidad en el uso de RXT tanto en el número de dosis como en la cantidad de dosis empleada3. En Japón se ha demostrado la mejoría en la supervivencia con el uso de RTX frente a esplenectomía, y el empleo de 2 dosis o más de RXT de 375/m2 se ha relacionado con un aumento de la mortalidad de causa infecciosa en el trasplante renal ABO compatible12. Grim et al. comunican un aumento de infecciones en 35 pacientes ABO y HLA incompatibles tratados con RXT y timoglobulina, sin aumento en la mortalidad13. Lee et al. no encuentran una mayor incidencia de infecciones entre diferentes dosis de RTX; en cambio, sí encuentran una mayor incidencia de rechazo asociado con dosis menores14.
Dos de nuestros pacientes fallecieron, uno en el postoperatorio de un recambio valvular aórtico y otra por muerte súbita, con una edad de 68 y 73 años, respectivamente, y con injerto funcionante. La escasa mortalidad observada en el presente estudio podría justificarse por la utilización de una única dosis de RTX, administración de inmunoglobulinas, baja incidencia de rechazo agudo, bajo número de complicaciones infecciosas y un período de seguimiento de 44 meses.
La supervivencia del injerto en nuestra serie es del 93% al quinto año, similar a otras series. Esta supervivencia depende del tiempo de seguimiento, el acondicionamiento empleado o el período de tiempo estudiado4,6–8,10,15–18. Becker et al., usando columnas de IA TheraSorb®, comunican un 95% al tercer año19, y Galliford et al., usando un protocolo libre de esteroides desde la primera semana, el 100% al primer año20. Recientemente, Mustian et al. encuentran un descenso de la supervivencia renal censurada para muerte en pacientes ABOi de 2,34 (1,85-2,96), asociada a una edad del paciente>50 años 11.
La frecuencia de rechazo agudo en nuestra serie es del 8,7% al quinto año. En un reciente metaanálisis4, la frecuencia de rechazo agudo es del 32,9% (2,9-52,3%). La frecuencia es variable según el acondicionamiento, el tipo de rechazo (mediado por anticuerpos o por células T) o a la presencia de incompatibilidad HLA añadida, oscilando entre un 4 y un 44,5%10,15–19,21. Datos del registro americano11 encuentran una incidencia de rechazo agudo del 19,4%, con un incremento de riesgo de 1,78 respecto a los ABO compatibles. Aunque no hace referencia al tipo de rechazo, existe una fuerte correlación con un mayor grado de incompatibilidad HLA y un mayor porcentaje de PRA. En nuestro grupo encontramos una asociación del rechazo con una mayor edad del donante, con un menor grado de descenso del título de isoaglutininas y con una mayor frecuencia de función retrasada el injerto, aunque en el estudio multivariado la ausencia de función retrasada del injerto no fue un factor asociado a la presencia rechazo y la mayor edad del donante suponía un factor de riesgo. Estos resultados deben ser interpretados en el contexto de un número escaso de pacientes y de rechazos, para que esta significación estadística pueda tener algún significado clínico.
Detectamos viremia por CMV en 9 pacientes (19,5%). Existe también mucha disparidad en las series, que varían según el período analizado y el tipo de inmunosupresión, oscilando entre el 3,3% comunicado por Melexopoulou et al.22 y el 62,7% de Kwon et al.10, aunque las cifras más comunes se sitúan alrededor del 21%9,15. Melexopoulou et al. utilizan en su protocolo everolimus de novo, fármaco que impide la replicación viral y que puede ser el responsable de esa baja incidencia, como en otras series23. El estudio TRANSFORM demostró recientemente que la asociación de everolimus de novo con dosis bajas de anticalcineurínicos disminuye la incidencia de infecciones víricas CMV y BK frente a MMF y dosis estándar de anticalcineurínicos24. Höcker et al. demostraron una importante disminución de la replicación viral en pacientes inmunosuprimidos con everolimus y dosis bajas de ciclosporina o tacrolimus25. La incidencia de viremia CMV es similar a la de nuestra población de desensibilización HLA y ligeramente superior a la de la población trasplantada de donante vivo (15%). Los pacientes que recibieron everolimus de novo en nuestra serie no mostraron replicación CMV.
Cinco pacientes presentaron viremia BK en nuestra serie (12,4% al quinto año) sin evidencia de nefropatía. Otros autores encuentran incidencias similares, oscilando entre un 9,3 y un 37%9,10,16,19,26. Melexopoulou et al. encuentran un 16,7% de viremia BK, y 4 de los 5 pacientes presentan nefropatía BK. Desconocemos el momento en el que presentan esas viremias, si era cuando recibían everolimus o tras la conversión a micofenolato, ya que los i-MTOR han demostrado una menor incidencia de BK en otras series no ABOi24,27, impidiendo la multiplicación del virus en fases tempranas23. Belliere et al. demostraron la disminución de la carga viral en pacientes TRDV ABOi convertidos por viremia BK de MMF a everolimus28. En nuestra serie, un paciente tratado con everolimus de novo desarrolló viremia BK a los 4,2 meses postrasplante; los otros pacientes inmunosuprimidos con tacrolimus de liberación rápida y micofenolato mofetilo desarrollaron replicación BK a los 3, 4, 7 y 32 meses. La incidencia es ligeramente superior a la de nuestra población general de trasplante renal de donante vivo ABO compatible (4%) y difiere poco de otras series.
Toyoda et al.29 estudiaron a un grupo de pacientes desensibilizados HLA y no encontraron una mayor incidencia de infecciones, especialmente víricas, donde utilizan RTX e inmunoglobulinas. Muestran que la depleción de células T y secundariamente a macrófagos y células asesinas naturales haría desaparecer un posible reservorio viral y las inmunoglobulinas actuarían como tratamiento frente a partículas virales. Muramatsu et al.30 encuentran una gran diversidad de datos sobre la incidencia de infecciones, tanto CMV como BK, en estos pacientes y que varía según la dosis de RTX, la incidencia de rechazo y el tiempo de publicación de las series.
El número excesivo de complicaciones quirúrgicas observadas es elevado: 50% hematoma/hemorragia, 14,6% necesidad de intervención y 60,4% necesidad de transfusión de hematíes. Parece establecido que la PFS y la IA podrían causar un estado de «sangrado» por deficiencia del factor xiii (no detectado en los test que se utilizan habitualmente), trombocitopenia, hipofibrinogenemia y pérdida de otros factores de coagulación31,32. De Weerd et al.33 comunicaron un 29% de necesidad de transfusiones y reintervención en 3 pacientes. Asociaron el sangrado al número de sesiones de IA. Zschiedrich et al. mostraron un 21% de revisiones quirúrgicas a causa de hemorragia que atribuyen a la heparina administrada en la reperfusión del injerto18. Lentine et al. encuentran una incidencia de hemorragia que oscila entre el 10 y el 67%, siendo superior en los pacientes con esplenectomía (25,9%)34. Relacionan esta complicación con los factores previamente mencionados y fundamentalmente asociados a la aféresis. Kim et al. encuentran un 12,8% de sangrado postoperatorio relacionado con un estado urémico y con la situación prediálisis35. En nuestra serie no encontramos diferencias en el número de plaquetas, TP, TPTa, fibrinógeno, número de sesiones de aféresis, tipo de aféresis, tiempo o situación de diálisis o tiempo desde la última PFS/IA hasta la intervención. Tampoco encontramos diferencias en el número o gravedad de las complicaciones según la técnica de aféresis empleada, aunque observamos una mayor trombocitopenia asociada a IA y niveles más bajos de fibrinógeno asociados a PFS, y aunque esta asociación de ambas técnicas presentó un mayor número de complicaciones, las diferencias no fueron estadísticamente significativas. No se midió el factor xiii y la pauta de heparinización postrasplante es la misma que en el trasplante renal de donante vivo ABO compatible, donde la frecuencia de sangrado postoperatorio es menor del 8%. El número de complicaciones quirúrgicas no supuso un aumento en la hospitalización, que, en nuestra serie, guarda relación con el título de isoaglutininas preacondicionamiento.
El número de sesiones de PFS/IA preintervención fue de 6±3, similar a otras series. En Friburgo la media es de 5,7±3,6, en Heidelberg, de 7 (5-12) y en Atenas, de 5±3. En general, depende de los títulos de isoaglutininas preacondicionamiento, la técnica de aféresis y el cut-off marcado para aceptar el trasplante. Lawrence et al. necesitaron 8 sesiones de PFS para alcanzar<1:4, lo que impidió trasplantar a 5 pacientes de 51 candidatos a trasplante al no alcanzar esos títulos. Emplearon PFS, que no disminuye tanto el título de isoaglutininas como la DDP (plasmaféresis de doble filtración), empleada en Japón, o la IA, empleada fundamentalmente en Europa, aunque Parmentier et al. encuentran mayores reducciones de escalones de isoaglutininas con la PFS que con la IA36. Tobian et al. encuentran una reducción del 20% de isoaglutininas con cada tratamiento mediante PFS37 y Vallian et al. una reducción del 30% de isoaglutininas IgM tras el primer proceso con IA38. Rostaing et al. consiguieron procesar grandes volúmenes plasmáticos en una sola sesión de IA reduciendo el título de isoaglutininas y permitiendo la realización del trasplante39. Nuestro grupo emplea IA cuando los títulos son>1:256, o ambas técnicas cuando son mayores de 1:512. Según nuestros resultados, la IA o su asociación con PFS disminuyen más cantidad de isoaglutininas que la PFS aislada. En nuestro hospital no conseguimos disminuir el título de isoaglutininas y, por tanto, no pudimos trasplantar a 2 pacientes que tenían títulos basales de 1:1.024 y 1:2.048.
No está establecido si aquellos pacientes con títulos<1:8 en el momento de decidir el trasplante necesitan PFS o RTX. Masterson et al.40 comunicaron 20 casos sin acondicionamiento con una supervivencia del 100%, un rechazo mediado por anticuerpos y 4 rechazos mediados por células T. Gelpi et al.41 encuentran una supervivencia del 90% y un rechazo borderline. Krishnan et al.42 comunican 2 casos con rechazo mediado por anticuerpos y la consiguiente pérdida renal. Nanmoku et al.43 compararon 21 pacientes ABOi que recibían PFS con títulos IgG 1:32 con un grupo de 11 pacientes que no recibían PFS con un título de 1:8 y no observaron una mayor incidencia de rechazo, complicaciones o cambios en la supervivencia. En nuestra serie, 3 pacientes que presentaban títulos preacondicionamiento<1:8 recibieron una sesión de PFS y RTX. Una paciente presentó rechazo agudo borderline.
La técnica que empleamos para la cuantificación de isoaglutininas es la microtarjeta gel. Muramatsu at al.30 revisan los métodos de cuantificación de isoaglutininas basado en experiencias en el norte de Europa y Japón y concluyen que la técnica de hemaglutinación en tubo ofrece resultados con un amplio rango de títulos y una variación de la técnica; utilizando microtarjeta gel se aproxima más al método ideal (citometría de flujo), con una mayor reproducibilidad y una menor variabilidad interindividual e intercentros. La incidencia de rechazo cuando se emplea este método de cuantificación oscila entre el 6,5 y el 27%16,18,19,31,32. Krishnan et al. describen a 2 pacientes que no recibieron acondicionamiento por presentar títulos pretrasplante<1:8 mediante microtarjeta gel y presentaron un rechazo mediado por anticuerpos, con un aumento considerable de los títulos. Estos autores demostraron mediante citometría de flujo una hiperrespuesta en receptores O que reciben donantes A1 y B42.
La frecuencia de diabetes postrasplante es del 23,4%, y este dato no suele ser reflejado en las series. Su incidencia no difiere de la población ABO compatible. La incidencia de linfocele es un 6,2% inferior a otras series18,19,22, que oscila entre un 12 y un 33% y que algún autor44 asocia con la inmunosupresión con MMF.
Con un seguimiento medio de 44 meses, una paciente desarrolló un carcinoma de células claras en su riñón nativo y otra desarrolló un carcinoma cutáneo. Existen pocos datos en la literatura sobre la incidencia de neoplasias en TRDV ABOi. Lo et al. señalan un solo estudio45 en el que aparecen 2 linfomas y un cáncer gástrico. En el registro americano no encuentran mayor riesgo de cáncer en los ABOi que en los compatibles46. Posiblemente la ausencia de datos sea el reflejo de un escaso tiempo de seguimiento de estos trasplantes, lo que condiciona los resultados.
Las limitaciones de nuestro estudio vienen dadas por el escaso tamaño muestral, que limita algunos estudios (complicaciones postoperatorias), el empleo de 2 técnicas de aféresis (motivado fundamentalmente por el coste elevado de la IA), que hace que la disminución de títulos no sea homogénea, y el escaso período de seguimiento. A pesar de las limitaciones, los resultados globales nos parecen adecuados.
En conclusión, nuestra serie demuestra la eficacia del TRDV ABOi, con un excelente grado de supervivencia tanto del paciente como del injerto, sin ningún aumento en la incidencia de complicaciones infecciosas. Como reflejan otros autores, queda por evaluar el tratamiento inmunosupresor óptimo, el cut-off de los títulos y el número de sesiones de aféresis necesario para alcanzar ese cut-off en presencia de títulos altos, cuál es la técnica de aféresis que resulta más eficiente, la necesidad de acondicionamiento en presencia de títulos de isoaglutininas basales «bajos», dosis de RXT, el empleo de anti-CD25 o bolos de esteroides en el momento del trasplante.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.