Recientemente, se ha incorporado a nuestras posibilidades terapéuticas una nueva clase de dializadores, las membranas de medio cut-off (MCO), diseñadas para mejorar la permeabilidad y que podrían alcanzar una eficacia similar a la hemodiafiltración. Para aumentar el conocimiento sobre su uso, el objetivo del estudio fue valorar en las membranas de MCO el efecto de la superficie y del flujo sanguíneo (Qb) sobre la eficacia depurativa.
Material y métodosSe incluyó a 19 pacientes en programa de hemodiálisis. Cada paciente recibió 6 sesiones, en las que se varió la superficie de membrana, de 1,7 o 2,0 m2, y el Qb (300, 350, 400 o 450mL/min). En cada sesión se determinaron diferentes solutos al inicio y al final de la diálisis.
ResultadosEl cambio de superficie del dializador no mostró diferencias significativas en la depuración de pequeñas o grandes moléculas, sin cambios en la pérdida de albúmina. El aumento del Qb se acompañó de un aumento de depuración de pequeñas moléculas, sin mostrar diferencias en el porcentaje de reducción de β2-microglobulina, mioglobina, prolactina, α1-microglobulina y α1-glicoproteína ácida, a excepción de alguna comparación con Qb 450mL/min. Tampoco se observaron diferencias en la pérdida de albúmina en el líquido de diálisis, inferior a 2,5 g en todas las situaciones.
ConclusiónEl incremento de la superficie de 1,7 a 2,0 m2 en el dializador de MCO no ha significado una mayor eficacia depurativa. En estos dializadores el aumento del Qb no parece ser tan determinante como en la hemodiafiltración, a excepción de la depuración de pequeñas moléculas.
Recently, a new class of dialyzers, medium cut-off membranes (MCO), designed to improve the permeability, which could provide an efficacy similar to hemodiafiltration, have been incorporated into our therapeutic possibilities. To increase the knowledge about its use, the objective of the study was to evaluate the effect of the surface and blood flow (Qb) on the depurative efficacy in the MCO membranes.
Material and methodsWe included 19 patients in the hemodialysis. Each patient received 6 sessions, in which the membrane surface was varied, from 1.7 to 2.0 m2, and/or the Qb (300, 350, 400 or 450mL/min). In each session, different solutes were determined at the beginning and end of dialysis.
ResultsThe surface change of the dialyzer did not show significant differences in the removal of small or large molecules, without changes in albumin loss. The increase in Qb was accompanied by an increase in clearance of small molecules, without showing differences in the percentage reduction of β2-microglobulin, myoglobin, prolactin, α1-microglobulin and α1-acid glycoprotein, except for some comparison with Qb 450mL/min. There were also no differences in the loss of albumin in the dialysis fluid, less than 2.5 g in all situations.
ConclusionThe increase of the surface area from 1.7 to 2.0 m2 in the MCO dialyzer has not meant a greater depurative effectiveness. In these dialyzers the increase of Qb does not seem to be as determinant as in hemodiafiltration except for the clearance of small molecules.
La hemodiafiltración on line (HDF-OL) con altos volúmenes de reposición ha demostrado ser el tratamiento que más se acerca a la depuración del riñón normal, y el estudio ESHOL1,2 demostró una reducción de la mortalidad por cualquier causa respecto a la hemodiálisis (HD) en pacientes prevalentes en HD. Posteriormente, la valoración conjunta de los principales ensayos clínicos aleatorizados3 y varios metaanálisis4,5 han confirmado la disminución de la mortalidad global y cardiovascular. Finalmente, los registros nacionales franceses (REIN) y los de Australia y Nueva Zelanda también han mostrado una asociación con la reducción de mortalidad6,7.
Recientemente, se ha incorporado a nuestras posibilidades terapéuticas una nueva clase de dializadores, membranas de medio cut-off (MCO), diseñados para mejorar la permeabilidad gracias al mayor tamaño de los poros8,9. Estas membranas podrían ser una alternativa a la HDF-OL, ya que este tipo de HD, llamada HD expandida, podría alcanzar una eficacia similar a la alcanzada con la HDF-OL10,11.
Disponemos de poca bibliografía sobre el óptimo manejo de este tipo de dializadores. Sabemos que deben utilizarse exclusivamente en modalidad de HD para evitar pérdidas excesivas de albúmina, pero no disponemos de estudios que comparen diferentes superficies y los beneficios de aumentar el flujo sanguíneo (Qb), ambos factores limitantes en la eficacia tanto difusiva como convectiva. Con el fin de profundizar en el conocimiento y optimizar la utilización de esta nueva propuesta de dializadores con membrana de MCO, el objetivo del estudio fue valorar el efecto de la superficie de membrana y del Qb sobre la eficacia depurativa y sobre la pérdida de albúmina.
Material y métodosEstudio prospectivo monocéntrico en pacientes estables en programa de HD. Se incluyó a 19 pacientes (16 varones y 3 mujeres) con una edad media de 65,5 ± 14 años (intervalo 41-93 años) que se encontraban en programa de HD con un promedio de 72 ± 78 meses (intervalo 6-296 meses). La etiología de la insuficiencia renal crónica fue 6 pacientes con glomerulonefritis crónica, 4 con nefropatía diabética, 2 con poliquistosis, uno con nefropatía vascular, uno con nefropatía túbulo intersticial, uno de causa urológica, uno con enfermedad sistémica y 3de etiología no filiada. Todos los pacientes se dializaron a través de fístula arteriovenosa, excepto uno, a través de fístula protésica. La anticoagulación utilizada fue heparina de bajo peso molecular (tinzaparina) en el 58%, heparina sódica en el 21% de los pacientes y se dializaron sin heparina el 21% restante.
Cada paciente recibió 6 sesiones de HD con dializadores de MCO, siempre el mismo día de la semana, en las que se varió la superficie del dializador, 1,7 m2 (Theranova 400TM, Polyarylethersulfone, Baxter) versus 2,0 m2 (Theranova 500TM, Polyarylethersulfone, Baxter) o el Qb (300, 350, 400 o 450ml/min). Las características completas de los dializadores están recogidas en la tabla 1. Se mantuvieron constantes en cada una de las sesiones estudiadas los demás parámetros dialíticos: tiempo de diálisis, 291 ± 17min (240-300min); flujo del baño de diálisis (Qd) 400ml/min; monitor 5008 Cordiax, modalidad HD. Se aleatorizó el orden de las sesiones. Los parámetros de diálisis recogidos en cada sesión fueron: tiempo programado, duración real, dializador, Qb, Qd, Kt medido automáticamente por dialisancia iónica, índice de recirculación medido por el módulo de temperatura, presión arterial (PA), presión venosa (PV), presión transmembrana (PTM), hematocrito inicial y final, ultrafiltración y volumen de sangre procesada.
Características de los dializadores
| Theranova 400 | Theranova 500 | |
|---|---|---|
| MembranaMarca comercial | PoliariletersulfonaBaxter | PoliariletersulfonaBaxter |
| CUF (mL/h/mm Hg) | 48 | 59 |
| Wall thickness (μm) | 35 | 35 |
| Inner diameter (μm) | 180 | 180 |
| SC de β2-microglobulina | 1,0 | 1,0 |
| SC de mioglobulina | 0,9 | 0,9 |
| SC de albúmina | 0,008 | 0,008 |
| Superficie (m2) | 1,7 | 2,0 |
| Esterilización | Steam | Steam |
CUF: coeficiente de ultrafiltración; SC: sieving coefficient o coeficiente de cribado.
Analíticamente se determinaron las concentraciones de urea (60Da), creatinina (113 Da), β2-microglobulina (11.800Da), mioglobina (17.200Da), prolactina (23.000Da), α1-microglobulina (33.000Da), α1-glicoproteína ácida (41.000Da) y albúmina (66.000Da) en suero al inicio y al final de cada sesión para calcular el porcentaje de reducción de estos solutos. La concentración final de β2-microglobulina, mioglobina, prolactina, α1-microglobulina, α1-glicoproteína y albúmina se corrigieron para la hemoconcentración y el volumen de distribución (aproximadamente el volumen extracelular) según Bergström y Wehle12. Las concentraciones de urea, creatinina y albúmina se midieron por espectrometría de absorción molecular en el analizador ADVIA 2400 (Chemistry System, Siemens Healthineers, Tarrytown, EE. UU). La β2-microglobulina y la α1-glicoproteína ácida se midieron por inmunonefelometría con el analizador Dimension Vista (Siemens Healthineers) y la α1-microglobulina por inmunonefelometría por el analizador BNII (Siemens Healthineers). Las concentraciones de mioglobina se midieron por enzimoinmunoanálisis tipo «sandwich» con el analizador Dimension EXL (Siemens Healthineers). La concentración de prolactina se midió por enzimoinmunoanálisis tipo «sandwich» con el analizador ADVIA Centaur (Siemens Healthineers).
En todos los casos se utilizaron reactivos dedicados. Los valores de referencia de nuestro laboratorio son 10-50mg/dL para la urea, 0,3-1,3mg/dL para la creatinina, 0,1-2,3mg/L para la β2- microglobulina, 0-100 ng/mL para la mioglobina, 2,8-15 ng/mL para la prolactina, 5-25mg/L para α1-microglobulina, de 0,38-1,18g/L para la α1-glicoproteína ácida y de 34-48g/L para la albúmina.
Asimismo, se recogió una parte proporcional del líquido de diálisis mediante una bomba de infusión inversa (RAZELTM, Vermont, EE. UU.) para cuantificar la pérdida de solutos y también de albúmina. La concentración de la muestra obtenida se multiplicaba por el volumen total del líquido de diálisis. La urea, creatinina y prolactina se midieron igual que en suero. Sin embargo, como las concentraciones de β2-microglobulina y de albúmina eran muy bajas, fue necesario analizar dichas magnitudes con la misma tecnología, pero con los métodos de determinación en orina para aumentar la sensibilidad analítica. La β2-microglobulina se midió con un mejor índice de detección, 0,004625mg/L.
Finalmente, una valoración global de la capacidad depurativa (Global removal score) fue calculada con la siguiente fórmula recientemente publicada13: (UreaRR + β2-microglobulinaRR + mioglobinaRR + prolactinaRR + α1-microglobulinRR + α1-glicoproteína ácidaRR − albúminaRR)/6.
Los resultados se expresan como la media aritmética ± desviación típica. Para el análisis de la significación estadística de parámetros cuantitativos se ha empleado el test de la t de Student para datos pareados y ANOVA para datos repetidos (test de Bonferroni). Se ha considerado estadísticamente significativa una p < 0,05. Los análisis se hicieron con el programa SPSS versión 23 (SPSS, Chicago, IL, EE. UU.).
ResultadosTodas las sesiones de diálisis se realizaron sin incidencias clínicas destacables. No hubo ninguna sesión con coagulación de las líneas o del dializador. La comparación de los parámetros de diálisis se recoge en la tabla 2. No hubo diferencias en la sangre total procesada por el monitor, Qd, duración real de las sesiones, peso inicial, peso final, ganancia de peso, mediciones por el propio monitor de diálisis del hematocrito inicial ni final, recirculación del acceso vascular, PA ni PV entre las 2superficies estudiadas (tabla 2); la PTM fue ligeramente superior en la superficie menor. Solo 14 pacientes podían disponer de un Qb de 450mL/min para la valoración de los distintos flujos de sangre. Como era de esperar, se observaron diferencias en sangre total procesada por el monitor, recirculación del acceso vascular, PA, PV y PTM cuando se compararon las sesiones con diferentes Qb (tabla 2).
Compación de los parámetros de diálisis en las 6 situaciones de estudio
| Theranova 400 | Theranova 500 | p | Theranova 400Qb 300 mL/min | Theranova 400Qb 350 mL/min | Theranova 400Qb 400 mL/min | Theranova 400Qb 450 mL/min | |
|---|---|---|---|---|---|---|---|
| Sangre procesada (L) | 124,37 ± 13,3 | 123,9 ± 14,2 | 0,548 | 85,7 ± 5,6 | 99,5 ± 6,3 * | 114,4 ± 8,0 * a | 127,8 ± 8,1 * ab |
| Recirculación (%) | 14,5 ± 2,6 | 13,8 ± 2,5 | 0,163 | 10,1 ± 2,1 | 11,6 ± 2,4 c | 13,3 ± 2,1 *d | 13,9 ± 2,4 *d |
| Tiempo real (min) | 286,8 ± 15 | 286,2 ± 14 | 0,468 | 286,1 ± 19 | 284,6 ± 18 | 285,6 ± 20 | 285,4 ± 19 |
| Peso inicial (kg) | 71,0 ± 16,7 | 71,2 ± 17,1 | 0,695 | 72,5 ± 19,4 | 72,6 ± 19,2 | 72,7 ± 19,6 | 72,6 ± 19,6 |
| Peso final (kg) | 68,4 ± 16,6 | 68,9 ± 16,8 | 0,131 | 69,8 ± 18,8 | 69,9 ± 18,9 | 70,1 ± 19,0 | 69,7 ± 19,0 |
| Ganancia de peso (kg) | 2,66 ± 0,89 | 2,35 ± 1,25 | 0,318 | 2,70 ± 0,98 | 2,68 ± 0,99 | 2,58 ± 0,94 | 2,89 ± 1,15 |
| Hematocrito inicial (%) | 28,4 ± 4,1 | 29,3 ± 3,4 | 0,343 | 29,3 ± 4,1 | 29,9 ± 3,4 | 27,9 ± 3,7 | 27,9 ± 3,9 |
| Hematocrito final (%) | 34,0 ± 5,2 | 34,0 ± 4,2 | 0,966 | 34,7 ± 5,2 | 35,0 ± 3,7 | 33,8 ± 4,4 | 33,3 ± 5,3 |
| Presión arterial (mm Hg) | −214 ± 18 | −219 ± 22 | 0,396 | −130 ± 35 | −164 ± 30 * | −196 ± 29 * a | −214 ± 24 * a |
| Presión venosa (mm Hg) | 206 ± 23 | 204 ± 31 | 0,698 | 146 ± 17 | 170 ± 23 * | 196 ± 28 * a | 205 ± 21 * a |
| PTM (mm Hg) | 31,7 ± 6,3 | 27,3 ± 4,2 | 0,010 | 26,4 ± 4,2 | 25,7 ± 3,9 | 27,4 ± 5,2 | 31,1 ± 6,8 |
PTM: presión transmembrana.
* p < 0,001 respecto a Qb 300;
a p < 0,001 respecto a Qb 350;
b p < 0,001 respecto a Qb 400;
c p < 0,05 respecto a Qb 300;
d p < 0,05 respecto a Qb 350; (ANOVA para datos repetidos).
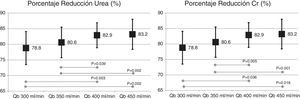
El cambio de superficie del dializador no mostró diferencias significativas en la dosis de diálisis o depuración de moléculas pequeñas, expresada como Kt, 69,6 ± 5,1 L con 1,7 m2 vs. 69,7 ± 6,1 L con 2,0 m2 (p = 0,935); porcentaje de reducción de urea (83,6 ± 4,6% con 1,7 m2 vs. 83,6 ± 4,0% con 2,0 m2; p = 0,957); y porcentaje de reducción de creatinina (77,3 ± 4,9% con 1,7 m2 vs. 77,1 ± 4,5% con 2,0 m2; p = 0,791). Sin embargo, el aumento del Qb mostró un incremento de la depuración de pequeñas moléculas (fig. 1).
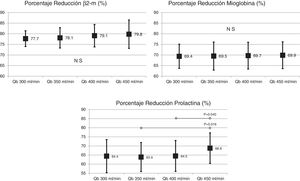
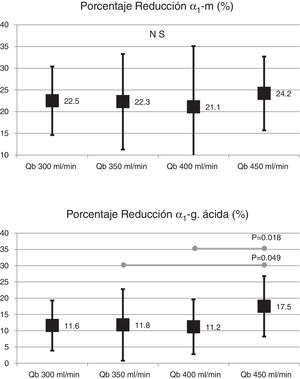
El cambio de superficie del dializador tampoco mostró diferencias significativas en la depuración de moléculas grandes, porcentaje de reducción β2-microglobulina (80,4 ± 5,8% con 1,7 m2 vs. 80,3 ± 3,6% con 2,0 m2; p = 0,914); porcentaje de reducción de mioglobina (70,7 ± 6,3% con 1,7 m2 vs. 70,4 ± 6,8% con 2,0 m2; p = 0,780); porcentaje de reducción de prolactina (68,8 ± 8,0% con 1,7 m2 vs. 67,0 ± 7,8% con 2.0 m2; p = 0,275); porcentaje de reducción de α1-microglobulina (22,3 ± 14% con 1,7 m2 vs. 19,4 ± 11% con 2,0 m2; p = 0,347) y porcentaje de reducción de α1-glicoproteína ácida (14,2 ± 8,3% con 1,7 m2 vs. 11,6 ± 10,1% con 2,0 m2; p = 0,246). Con respecto al aumento del Qb, no se observaron diferencias significativas en el porcentaje de reducción de β2-microglobulina, mioglobina ni α1-microglobulina; solo con Qb de 450mL/min el porcentaje de reducción prolactina y de α1-glicoproteína ácida fue ligeramente superior (figs. 2 y 3).
No se observaron diferencias significativas en el porcentaje de reducción de albúmina (10,9 ± 6,8% con 1,7 m2 vs. 11,8 ± 7,6% con 2,0 m2; p = 0,579); ni tampoco en la albúmina eliminada en el líquido de diálisis (2,35 ± 1,03g con 1,7 m2 vs. 1,89 ± 0,97g con 2,0 m2; p = 0,104), en ninguna de las 2superficies evaluadas. Tampoco se observaron cambios en la albúmina ni con la albúmina eliminada en el líquido de diálisis con los cambios de Qb (fig. 4).
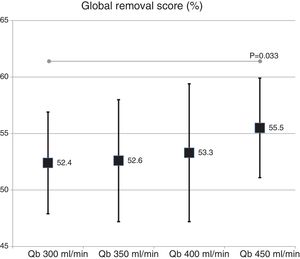
La valoración global de la capacidad depurativa con el cambio de superficie del dializador no mostró diferencias significativas (54,9 ± 5,2% con 1,7 m2 vs. 53,3 ± 4,8% con 2,0 m2; p = 0,151). Con el cambio de Qb, se observó un ligero incremento con el aumento del Qb, solo significativo con el Qb de 450mL/min respecto a 300mL/min (fig. 5).
DiscusiónEl presente estudio muestra que el cambio de superficie de 1,7 a 2,0 m2 del dializador de MCO no mostró diferencias significativas en la depuración ni en la pérdida de albúmina. El aumento del Qb se acompañó de un aumento de depuración de pequeñas moléculas, sin mostrar diferencias en el porcentaje de reducción de β2-microglobulina, mioglobina, prolactina, α1-microglobulina y α1-glicoproteína ácida, a excepción de alguna comparación con Qb de 450mL/min. Tampoco se observaron diferencias en la pérdida de albúmina en el líquido de diálisis, inferior a 2 g en todas las situaciones. Revisada la bibliografía, el presente estudio representa el primero que evalúa el efecto de la superficie y los cambios de Qb en dializadores de MCO.
Los dializadores con membranas de MCO en HD se han postulado como una alternativa a la HDF-OL, ya que consiguen una eficacia depurativa muy parecida y es segura, ya que la pérdida de albúmina es inferior a 3 g8-10. Algunos artículos muestran con MCO depuraciones de mioglobina, prolactina, factor D del complemento, α1-microglobulina y cadenas ligeras libres algo superiores a la HDF-OL11,14; otro trabajo muestra resultados similares15 y, finalmente, otro estudio muestra una depuración algo inferior de β2-microglobulina, mioglobina y prolactina16. La mayoría de estos estudios han sido realizados con superficie de 2,0 m2. La valoración global obtenida en este estudio con membrana MCO, entre el 52 y el 55%, estaría entre el 47% obtenido con HDF-OL en el 2002 con la primera generación de polisulfona17 y el 58% obtenido en el 2014 con la última generación de helixona18.
El presente estudio ha mostrado resultados similares con superficies de 1,7 m2 y de 2,0 m2, y se ha observado como única característica diferencial una PTM un 14% más elevada, que no significó ningún problema técnico ni de alarmas. El cambio de superficie tampoco resultó muy determinante en la HDF-OL posdilucional19.
En un estudio previo20, en la modalidad de HDF-OL, se puso de manifiesto la importancia del Qb en la consecución del volumen convectivo que, consecuentemente, aumentaba la capacidad depurativa de las moléculas pequeñas y de la β2-microglobulina, mioglobina y α1-microglobulina. En el presente estudio, los dializadores de MCO también se asociaron a una mejor depuración de moléculas pequeñas con el aumento del Qb; sin embargo, los resultados de porcentaje de reducción de solutos entre 12 y 40 kDa fueron muy similares, y reflejaron que el aumento del Qb no se asociaba a un mayor efecto convectivo por retrofiltración. Por tanto, estos resultados podrían indicar que la HD con dializadores de MCO podría ser una alternativa a la HDF-OL, especialmente en aquellos pacientes con Qb bajos.
Concluimos que el incremento de la superficie de 1,7 a 2,0 m2 en el dializador de MCO no ha significado una mayor eficacia depurativa. En estos dializadores el aumento del Qb no parece ser tan determinante como en la hemodiafiltración en línea posdilucional, a excepción de la depuración de pequeñas moléculas. Considerando las razones logísticas, técnicas y económicas de cada unidad de diálisis, la HD con membranas de MCO, a la espera de ensayos clínicos que muestren resultados de morbimortalidad, podría ser una alternativa a la HDF-OL, especialmente en aquellos pacientes con bajos flujos de sangre.
Conflicto de interesesLos autores declaran que no ha habido apoyo financiero para este proyecto. FM ha recibido honorarios de Amgen, Baxter, Bellco, Fresenius Medical Care y Nipro. El resto de los autores declaran no tener ningún conflicto de intereses.
Queremos manifestar nuestro agradecimiento a todos los pacientes que han participado, así como a todo el personal de la Sección de Diálisis del Hospital Clínic de Barcelona por su colaboración y entusiasmo en este estudio.