La patología glomerular más relacionada con enfermedad COVID-19 hasta la fecha parece ser la glomerulopatía colapsante, principalmente en pacientes de raza afroamericana y con alelos de riesgo para el gen APOL1. No obstante, en nuestra población, conformada por pacientes adultos mayores de raza caucásica, la patología más biopsiada desde el inicio de la pandemia ha sido la nefritis IgA o púrpura de Schönlein-Henoch.
Desde la descripción del primer caso de esta entidad tras infección por SARS-CoV-2 por nuestro grupo de investigación hemos objetivado otros tres, los cuales se describen a continuación. En contraste con el resto de los casos publicados de vasculitis IgA, nuestros pacientes presentaban mayor deterioro de función renal y todos requirieron tratamiento inmunosupresor. Además, algunos presentaron recuperación incompleta de función renal. Esta serie de casos afianza la posibilidad de que la infección por SARS-CoV-2 sea un desencadenante más de esta patología.
COVID-19 most related glomerular disease to date seems to be collapsing glomerulopathy, mostly in young Afroamerican patients with APOL1 gene risk alleles. However, in our population, predominant in elderly Caucasian patients, most biopsied pathology since the beginning of the pandemic has been IgA nephritis or Schönlein-Henoch purpura.
Since the description of the first case of this entity after SARS-CoV-2 infection by our research group, three more cases have arisen, which are described in the following article. In contrast to the rest of IgA vasculitis cases reported, our patients presented more renal function deterioration and all of them required immunosupresive therapy. Moreover, some showed incomplete recovery of renal function.
This case series strengthens the hypothesis that SARS-CoV-2 infection may be another trigger of this pathology.
Desde que el pasado marzo de 2020 la Organización Mundial de la Salud (OMS) declarase el estado de pandemia por enfermedad coronavirus 19 (COVID-19) se ha descrito la patología glomerular relacionada con la misma, siendo la glomerulonefritis colapsante1,2 la más frecuentemente asociada, la mayoría en población afroamericana.
Nuestro grupo ha publicado recientemente el primer caso de vasculitis IgA con nefritis asociado a COVID-193. Desde entonces, se han editado otros casos4–11, la mayoría en población menor de 30 años, presentando sólo cuatro de ellos afectación renal.
Tras el caso índice3, hemos objetivado otros tres casos de vasculitis IgA tras infección por SARS-CoV-2. Es más, esta ha sido la patología más frecuentemente biopsiada en nuestro medio desde el inicio de la pandemia. Todos los pacientes con este diagnóstico tenían serología SARS-CoV-2 positiva.
El cuadro clínico de nuestros pacientes difiere ampliamente del resto de casos publicados. Son pacientes adultos mayores, con afectación renal severa y necesidad de tratamiento inmunosupresor.
Presentación de casosCaso índice: Suso et al.3Caso 1Varón de 84 años con historia de extabaquismo, hipertensión arterial (HTA), dislipemia, bloqueo aurículo-ventricular (AV) completo con implante de marcapasos, endocarditis tricuspídea con estenosis tricuspídea residual y fallo cardíaco derecho con hepatopatía congestiva, flutter auricular anticoagulado con Sintrom, enfermedad pulmonar obstructiva crónica (EPOC) leve, síndrome de apnea obstructiva del sueño (SAOS) en tratamiento con dispositivo de presión positiva continua en la vía aérea (CPAP) nocturna y polineuropatía axonal. En 2019 presentaba niveles séricos de IgA de 405 mg/dL (70-400 mg/dL).
Ingresó de marzo a junio de 2020 por neumonía bilateral COVID-19, confirmada por reacción en cadena de la polimerasa (PCR) nasofaríngea, con múltiples complicaciones durante el ingreso. Recibió tratamiento con hidroxicloroquina, lopinavir/ritonavir, azitromicina, corticoides, tocilizumab y anticoagulación terapéutica por tromboembolismo pulmonar segmentario derecho.
En los últimos 15 días del mismo, desarrolló un fracaso renal agudo con creatinina (Cr) de 2,39 mg/dL, proteinuria 20 mg/dL y microhematuria junto con lesiones cutáneas purpúricas en abdomen y miembros (Cr y sedimentos urinarios previos normales). El estudio inmunológico (Ig, complemento, anticuerpos anticitoplasma de neutrófilos [ANCAs], anticuerpos antinucleares [ANAs], espectro electroforético sanguíneo) sólo mostró aumento de los niveles de IgA de 556 mg/dL (70-400 mg/dL). Las serologías virus de hepatitis B (VHB), virus de hepatitis C (VHC) y virus de la inmunodeficiencia humana (VIH) fueron negativas. Se realizó biopsia cutánea, sin datos de vasculitis. El deterioro renal se atribuyó a factores funcionales y fue dado de alta a principios de junio 2020 con Cr 2 mg/dL.
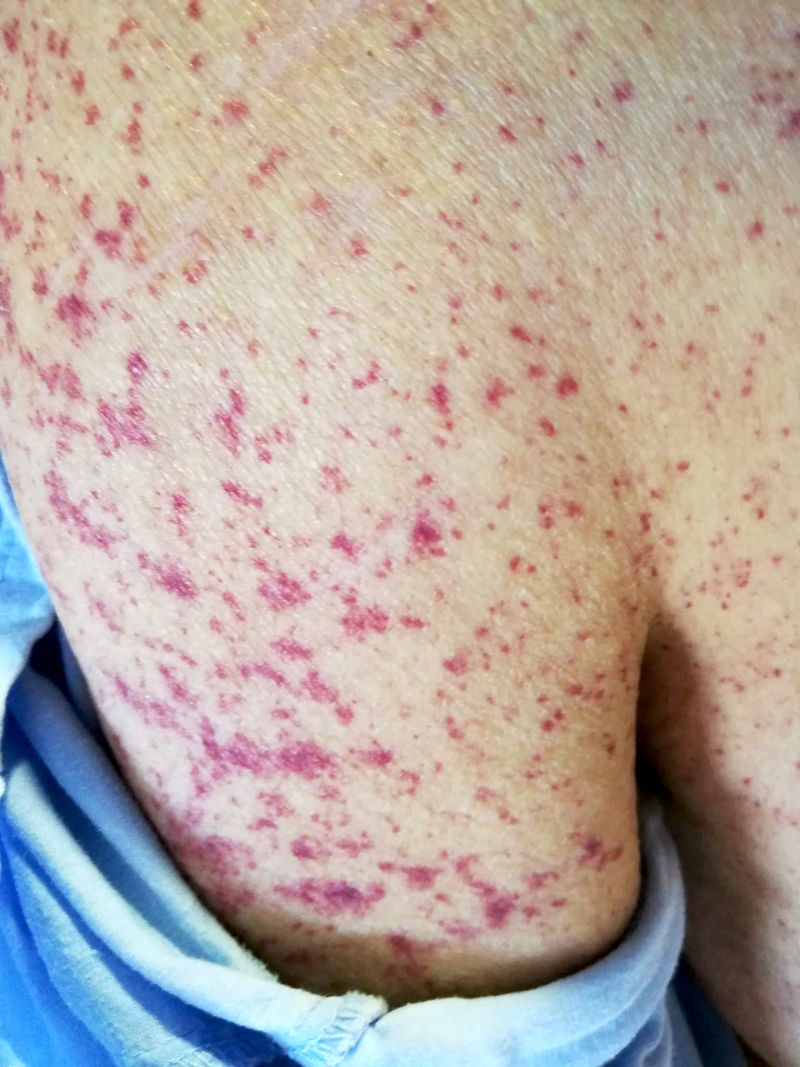
Tres semanas después, se remite a Urgencias por Cr 5,28 mg/dL con proteinuria 75 mg/dL (2 g/día) y hematuria macroscópica parda junto con lesiones de púrpura palpable en tronco y miembros sin respetar palmas ni plantas (fig. 1). El paciente refería varios brotes de lesiones cutáneas similares desde el alta. A la exploración estaba hipertenso (170/85 mmHg) y presentaba datos de sobrecarga de volumen además de las lesiones purpúricas referidas. La PCR nasofaríngea de COVID fue negativa con serología positiva para inmunoglobulina G (IgG) y negativa para inmunoglobulina M (IgM). El estudio inmunológico fue superponible al previo. Ecográficamente los riñones presentaban tamaño normal con múltiples quistes corticales bilaterales.
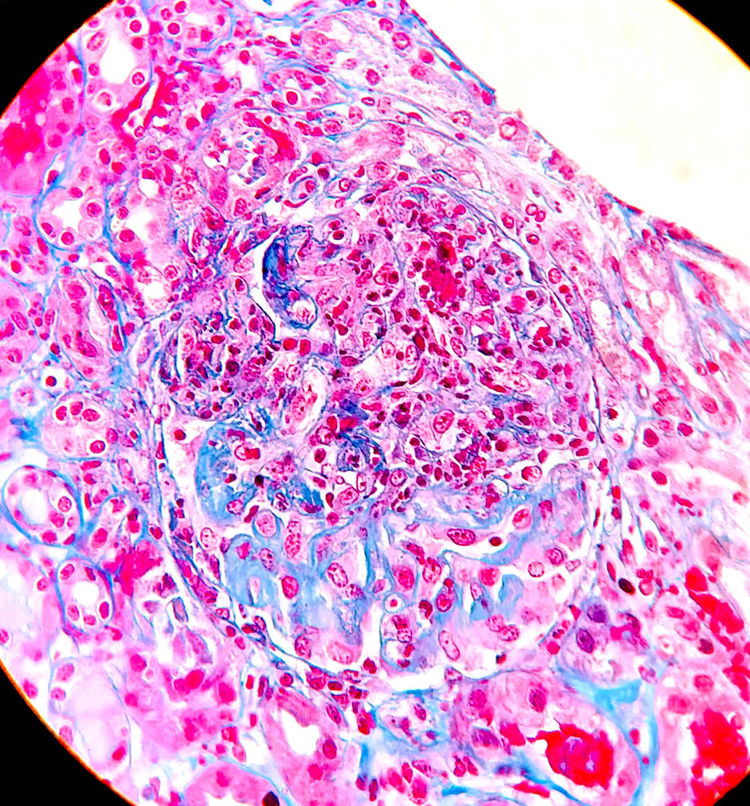
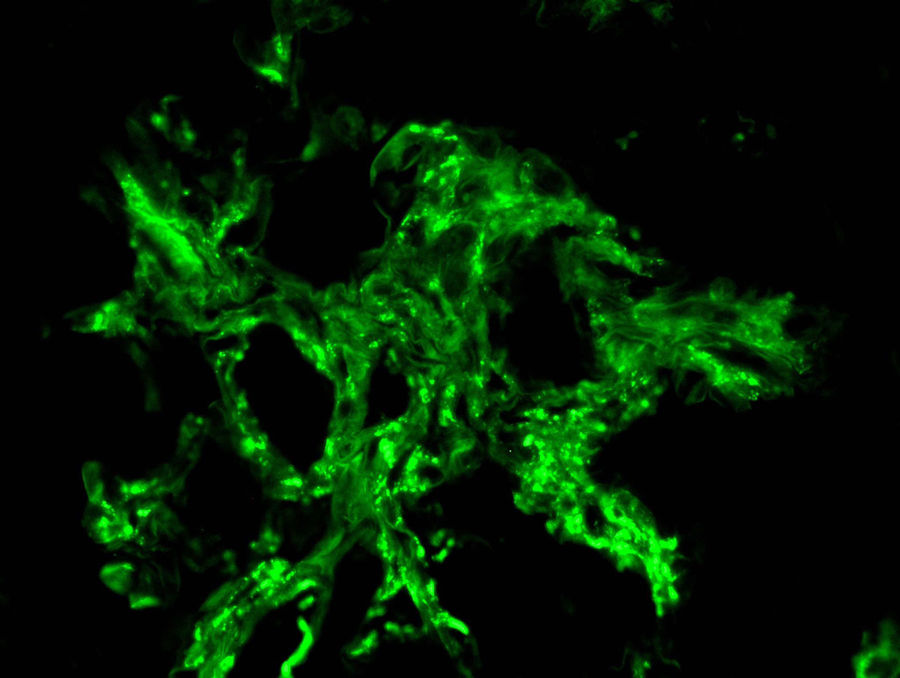
Ante la sospecha de vasculitis sistémica con compromiso renal se inició tratamiento con choques de 6-metilprednisolona (250 mg/día, tres días) seguidos de prednisona oral (0,8 mg/kg/día) y se realizó biopsia renal. Se identificaron 16 glomérulos, ocho de ellos esclerosados. En dos de ellos había ensanchamiento mesangial y en otros dos, retracción del penacho (fig. 2). No se observaron semilunas. Existían focos de fibrosis intersticial y atrofia tubular con focos de infiltrado mononuclear en la zona intersticial subcapsular mostrando algunos túbulos hematíes intraluminales. Las arterias y arteriolas no presentaban alteraciones. Con técnica de inmunofluorescencia se apreciaron depósitos granulares mesangiales de IgA (fig. 3), kappa y lambda, con negatividad para IgG, IgM, componente 3 del complemento (C3) y componente 1q del complemento (C1q), clasificándose de Vasculitis IgA (tipo Schönlein-Henoch) según la clasificación histológica International Study of Kidney Disease in Children (ISKDC) tipo II. Se repitió la biopsia cutánea, que confirmó depósitos de IgA.
En el primer mes, presentó brotes de púrpura palpable y de reactivación del sedimento urinario coincidiendo con el descenso esteroideo. Precisó nuevos choques de esteroides y, como ahorrador de estos (había recibido también dosis elevadas por el COVID-19) se asoció tratamiento con micofenolato mofetilo (MMF) consiguiéndose el control clínico.
A los 10 meses de seguimiento, ha recuperado parcialmente función renal (Cr de 2 mg/dL), ha negativizado la proteinuria y mantiene microhematuria (3-5 hematíes/campo).
Caso 2Varón de 87 años con antecedentes de HTA con miocardiopatía hipertensiva, hipertensión pulmonar leve, múltiples ingresos por neumonías adquiridas en la comunidad (último en abril de 2019), diverticulosis, hiperplasia benigna de próstata y deterioro cognitivo moderado de probable etiología vascular agudizado tras hemorragia subaracnoidea por traumatismo craneoencefálico en agosto de 2019, por lo que estaba institucionalizado.
Fue remitido a Urgencias en diciembre de 2020 por lesiones purpúricas confluentes, de predominio en miembros inferiores, región distal de miembros superiores y glúteos. Analíticamente se objetivó Cr de 2,29 mg/dL, proteinuria de 150 mg/dL en la tira y microhematuria (sedimentos urinarios y Cr hasta el mes previo normales).
En la exploración física la tensión arterial era de 100/70 mmHg, y además de las lesiones purpúricas presentaba datos de sobrecarga de volumen con hipoventilación en base derecha y crepitantes ipsilaterales. La radiografía de tórax mostró patrón reticular en campo medio y base derecha, ya conocido, aunque más acentuado. Había presentado un cuadro de infección respiratoria a finales de octubre de 2020 que se trató con amoxicilina-clavulánico, sin realizarse pruebas para COVID-19. A su ingreso, la PCR nasofaríngea de COVID-19 fue negativa con serología IgG positiva e IgM negativa. El estudio inmunológico sólo mostró aumento de los niveles de IgA de 502 mg/dL (70-400 mg/dL). Las serologías VHB, VHC y VIH fueron negativas.
Ante la progresión del deterioro de función renal (Cr 3,6 mg/dL) en el ingreso y la sospecha de vasculitis sistémica, se inició tratamiento con choques de 6-metilprednisolona (250 mg/día, tres días) seguidos de prednisona oral (0,8 mg/kg/día). Dada la edad y comorbilidad del paciente no se consideró la realización de biopsia renal. Se realizó biopsia cutánea que evidenció una vasculitis leucocitoclástica con depósitos granulares perivasculares de IgA en la inmunofluorescencia directa, confirmando el diagnóstico de vasculitis IgA.
A los 5 meses de seguimiento, la recuperación de función renal es completa con cifras de Cr 1,07 mg/dL. No se dispone de orina por incontinencia.
Caso 3Mujer de 64 años con antecedentes de HTA, hipotiroidismo en tratamiento sustitutivo y enfermedad renal crónica estadio 3B A1-A2 con microhematuria leve intermitente e IgA levemente elevada (486 mg/dL) en probable relación con glomerulonefritis crónica (no biopsiada), en seguimiento por nefrología desde 2013. Había permanecido estable con Cr en última revisión (octubre 2020) de 1,37 mg/dL, sin proteinuria ni microhematuria.
En marzo de 2020 presentó una neumonía unilateral COVID-19 que se trató con hidroxicloroquina y azitromicina de forma ambulatoria.
Desde mediados de diciembre de 2020 refería cifras tensionales elevadas (200/100 mmHg), precisando iniciar tratamiento antihipertensivo con enalapril y manidipino. En control analítico se evidenció deterioro de función renal con Cr 2,48 mg/dL, proteinuria 100 mg/dL con índice proteína/creatinina 3 mg/mg y 20-40 hematíes/campo en el sedimento. Diez días después, progresión del deterioro con Cr 3,41 mg/dL, proteinuria de 4,3 g/día (sin síndrome nefrótico) y microhematuria. La paciente negaba lesiones cutáneas previas, artritis/artralgias y clínica digestiva. Ante la sospecha de una glomerulonefritis rápidamente progresiva ingresó para biopsia renal.
A su ingreso la PCR COVID-19 fue negativa con serología SARS-CoV-2 positiva. El estudio inmunológico sólo mostró aumento de los niveles de IgA (434 mg/dL (70-400 mg/dL)). Las serologías de VIH, VHB y VHC fueron negativas. La biopsia identificó siete glomérulos, uno de ellos esclerosado. Engrosamiento mesangial difuso a expensas de matriz y celularidad mesangial formando sinequias. Dos glomérulos con semilunas epiteliales y uno con semiluna fibrosa. Se evidenciaron focos de fibrosis intersticial y atrofia tubular con infiltrados inflamatorios mononucleares intersticiales. Las arterias presentaban leve engrosamiento fibroso intimal. En IF se apreciaban depósitos granulares mesangiales y glomerulares de IgA (+++), C3 (+), kappa (+) y lambda (+). El diagnóstico histopatológico fue de Nefropatía IgA clasificación de Oxford M1 E1 S0 T0.
Dado el comportamiento clínico de una glomerulonefritis rápidamente progresiva y que presentaba casi un 50% de semilunas en la biopsia renal se inició tratamiento inmunosupresor con choques de metilprednisolona (250 mg/día, cuatro días) seguidos de prednisona oral asociando ciclofosfamida 500 mg quincenal.
A los cuatro meses de seguimiento, en fase de tratamiento activo, se ha objetivado mejoría de función renal hasta Cr 2,4 mg/dL, proteinuria 1,33 g/día y 10-20 hematíes/campo en el sedimento.
DiscusiónSon múltiples las patologías que se han descrito asociadas a la enfermedad COVID-19, entre ellas, la patología renal. Actualmente sabemos que el fracaso renal y las alteraciones del sedimento condicionan una mayor mortalidad intrahospitalaria12. Aunque el hallazgo más frecuente en las biopsias renales realizadas ha sido la necrosis tubular aguda13 se ha descrito patología glomerular, principalmente podocitopatías, en población afroamericana de mediana edad, con síntomas respiratorios leves y alelos de riesgo para el gen APOL114. Otra causa frecuente de afectación renal son las microangiopatías trombóticas (MAT)15. También hay descritos casos de vasculitis sistémicas, como enfermedad de Kawasaki16 y vasculitis p-ANCA17, algunas de las mismas, con compromiso renal.
Nuestro grupo publicó en octubre de 2020 el primer caso de vasculitis IgA con nefritis tras infección por SARS-CoV-23. Además de éste, en el primer año COVID, objetivamos los tres casos ahora descritos. De hecho, entre marzo 2020 y marzo 2021, la vasculitis IgA con nefritis (púrpura de Schönlein-Henoch) fue la patología más biopsiada en nuestro centro, representando el 33% de las biopsias realizadas. En todas estas nefropatías IgA tanto el cuadro clínico como las alteraciones en la biopsia motivaron el inicio de tratamiento inmunosupresor.
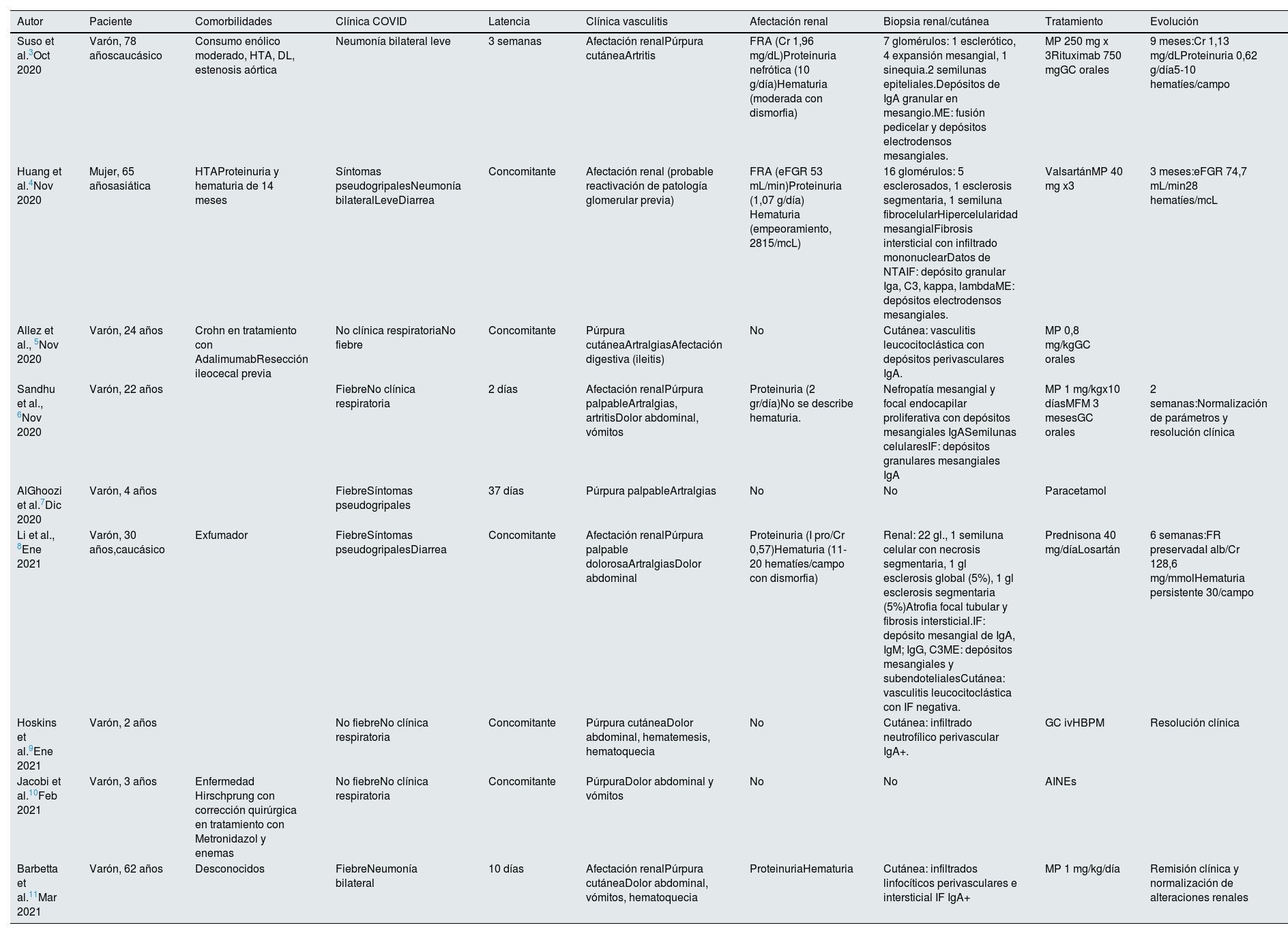
Desde el primer caso se han publicado otros en la literatura en el último año (tabla 1)4–11.
Vasculitis IgA en la literatura
| Autor | Paciente | Comorbilidades | Clínica COVID | Latencia | Clínica vasculitis | Afectación renal | Biopsia renal/cutánea | Tratamiento | Evolución |
|---|---|---|---|---|---|---|---|---|---|
| Suso et al.3Oct 2020 | Varón, 78 añoscaucásico | Consumo enólico moderado, HTA, DL, estenosis aórtica | Neumonía bilateral leve | 3 semanas | Afectación renalPúrpura cutáneaArtritis | FRA (Cr 1,96 mg/dL)Proteinuria nefrótica (10 g/día)Hematuria (moderada con dismorfia) | 7 glomérulos: 1 esclerótico, 4 expansión mesangial, 1 sinequia.2 semilunas epiteliales.Depósitos de IgA granular en mesangio.ME: fusión pedicelar y depósitos electrodensos mesangiales. | MP 250 mg x 3Rituximab 750 mgGC orales | 9 meses:Cr 1,13 mg/dLProteinuria 0,62 g/día5-10 hematíes/campo |
| Huang et al.4Nov 2020 | Mujer, 65 añosasiática | HTAProteinuria y hematuria de 14 meses | Síntomas pseudogripalesNeumonía bilateralLeveDiarrea | Concomitante | Afectación renal (probable reactivación de patología glomerular previa) | FRA (eFGR 53 mL/min)Proteinuria (1,07 g/día) Hematuria (empeoramiento, 2815/mcL) | 16 glomérulos: 5 esclerosados, 1 esclerosis segmentaria, 1 semiluna fibrocelularHipercelularidad mesangialFibrosis intersticial con infiltrado mononuclearDatos de NTAIF: depósito granular Iga, C3, kappa, lambdaME: depósitos electrodensos mesangiales. | ValsartánMP 40 mg x3 | 3 meses:eFGR 74,7 mL/min28 hematíes/mcL |
| Allez et al., 5Nov 2020 | Varón, 24 años | Crohn en tratamiento con AdalimumabResección ileocecal previa | No clínica respiratoriaNo fiebre | Concomitante | Púrpura cutáneaArtralgiasAfectación digestiva (ileitis) | No | Cutánea: vasculitis leucocitoclástica con depósitos perivasculares IgA. | MP 0,8 mg/kgGC orales | |
| Sandhu et al., 6Nov 2020 | Varón, 22 años | FiebreNo clínica respiratoria | 2 días | Afectación renalPúrpura palpableArtralgias, artritisDolor abdominal, vómitos | Proteinuria (2 gr/día)No se describe hematuria. | Nefropatía mesangial y focal endocapilar proliferativa con depósitos mesangiales IgASemilunas celularesIF: depósitos granulares mesangiales IgA | MP 1 mg/kgx10 díasMFM 3 mesesGC orales | 2 semanas:Normalización de parámetros y resolución clínica | |
| AlGhoozi et al.7Dic 2020 | Varón, 4 años | FiebreSíntomas pseudogripales | 37 días | Púrpura palpableArtralgias | No | No | Paracetamol | ||
| Li et al., 8Ene 2021 | Varón, 30 años,caucásico | Exfumador | FiebreSíntomas pseudogripalesDiarrea | Concomitante | Afectación renalPúrpura palpable dolorosaArtralgiasDolor abdominal | Proteinuria (I pro/Cr 0,57)Hematuria (11-20 hematíes/campo con dismorfia) | Renal: 22 gl., 1 semiluna celular con necrosis segmentaria, 1 gl esclerosis global (5%), 1 gl esclerosis segmentaria (5%)Atrofia focal tubular y fibrosis intersticial.IF: depósito mesangial de IgA, IgM; IgG, C3ME: depósitos mesangiales y subendotelialesCutánea: vasculitis leucocitoclástica con IF negativa. | Prednisona 40 mg/díaLosartán | 6 semanas:FR preservadaI alb/Cr 128,6 mg/mmolHematuria persistente 30/campo |
| Hoskins et al.9Ene 2021 | Varón, 2 años | No fiebreNo clínica respiratoria | Concomitante | Púrpura cutáneaDolor abdominal, hematemesis, hematoquecia | No | Cutánea: infiltrado neutrofílico perivascular IgA+. | GC ivHBPM | Resolución clínica | |
| Jacobi et al.10Feb 2021 | Varón, 3 años | Enfermedad Hirschprung con corrección quirúrgica en tratamiento con Metronidazol y enemas | No fiebreNo clínica respiratoria | Concomitante | PúrpuraDolor abdominal y vómitos | No | No | AINEs | |
| Barbetta et al.11Mar 2021 | Varón, 62 años | Desconocidos | FiebreNeumonía bilateral | 10 días | Afectación renalPúrpura cutáneaDolor abdominal, vómitos, hematoquecia | ProteinuriaHematuria | Cutánea: infiltrados linfocíticos perivasculares e intersticial IF IgA+ | MP 1 mg/kg/día | Remisión clínica y normalización de alteraciones renales |
La vasculitis IgA es una vasculitis inmunomediada de pequeño vaso que se manifiesta como púrpura no trombopénica, artritis o artralgias, dolor abdominal y/o afectación renal. A pesar de ser mucho más frecuente en la infancia, el 10% de la población afecta son adultos. Estos desarrollan formas más graves en las que es más frecuente el compromiso renal, condicionando un peor pronóstico18. La incidencia anual en adultos oscila entre 0,8-1,8 por cada 100.000 habitantes, con predominio en mayores de 65 años, varones y diabéticos19,20. Además, es más frecuente en la raza caucásica y asiática que en la afroamericana21.
A pesar de que su fisiopatología no es completamente conocida se estipula la influencia de factores genéticos, epigenéticos y ambientales. Actualmente se acepta el modelo de «four-hit», según el cual, una disregulación del sistema inmune daría lugar a formación de IgA1 anormalmente glicosilada, que sería reconocida por autoanticuerpos IgG/IgA formando inmunocomplejos depositados junto con factores del complemento a nivel mesangial18. Se han descrito patologías que predisponen al desarrollo de esta entidad como hepatopatías (déficit de aclaramiento hepático y generación de niveles basalmente elevados de IgA), enfermedad intestinal inflamatoria (sobreproducción de IgA en tracto intestinal)18 o patología glomerular de base (nefropatía IgA). Entre los desencadenantes o triggers de la vasculitis IgA destacan las infecciones, siendo las respiratorias y gastrointestinales, las más frecuentemente asociadas22.
La infección respiratoria por SARS-CoV-2, al igual que otras infecciones, generaría antígenos que, reconocidos por el sistema inmunitario y en presencia de factores predisponentes, potenciaría la tormenta de citocinas ya conocida22 y daría lugar a una disregulación inmunitaria que desencadenaría la mencionada vasculitis. Resulta improbable una noxa renal directa, no estando demostrada la evidencia de partículas a nivel renal23. Recientemente se han descrito dos casos de nefropatía IgA que, tras vacunación COVID-19, han presentado brote de hematuria macroscópica24. Todo ello apoya el que la infección COVID-19 pueda ser un desencadenante de vasculitis IgA.
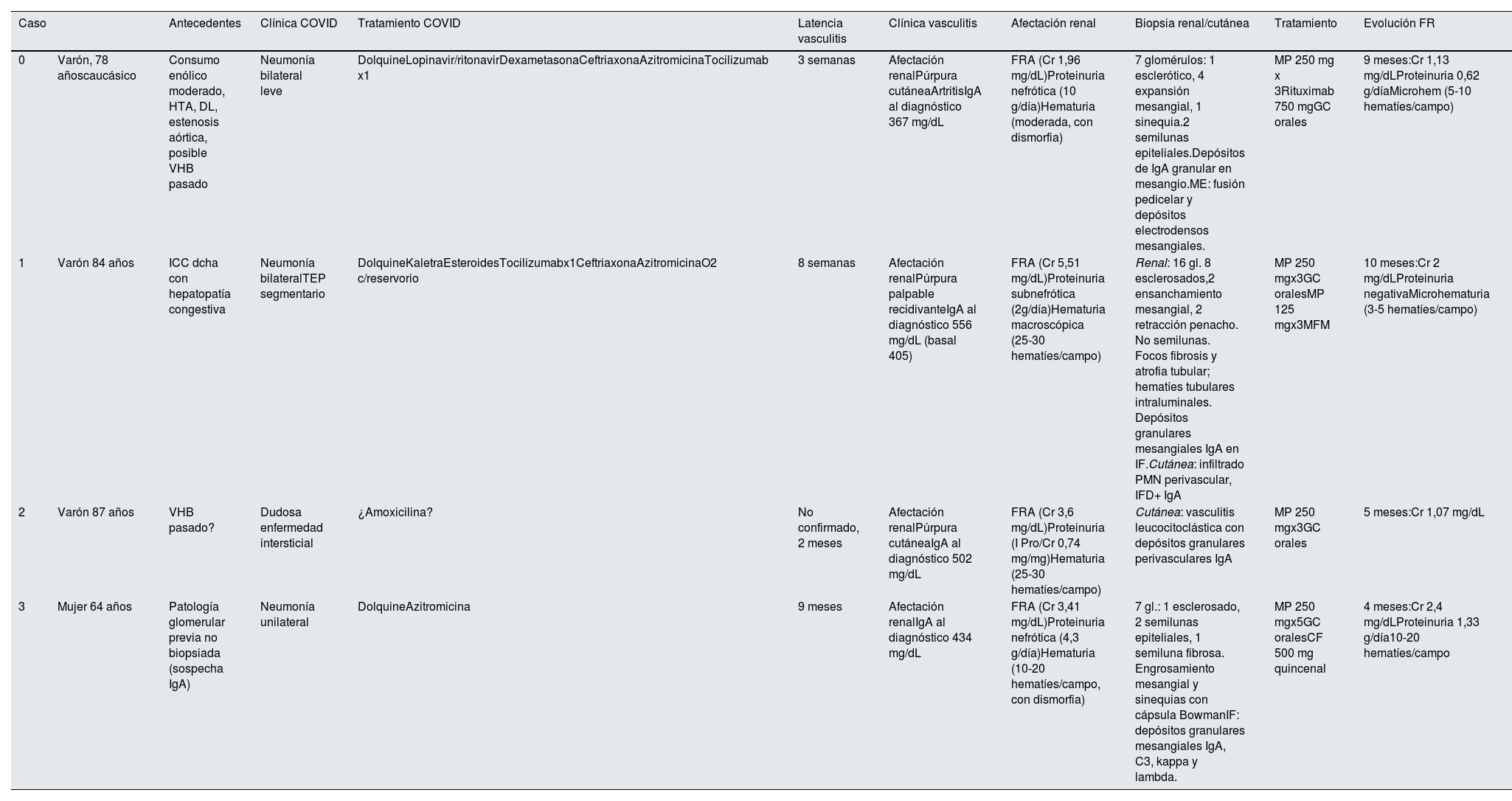
Teniendo en cuenta el primer caso publicado3, el 75% de nuestros pacientes con este diagnóstico eran varones, de edad avanzada (> 64 años) y raza caucásica. Todos debutaron con deterioro de función renal y uno de ellos además con un síndrome nefrótico clínico y bioquímico3 y en todos, la evolución clínica y los hallazgos de la biopsia apoyaron la necesidad de tratamiento inmunosupresor. Tres de ellos presentaron afectación extrarrenal, fundamentalmente cutánea. El tiempo de latencia entre la infección y el debut de la vasculitis osciló entre tres semanas y nueve meses, en todos los casos, con serología de infección pasada. Este dato apoya la teoría de la disregulación inmunitaria como principal factor etiopatogénico. Todos habían presentado afectación pulmonar secundaria a la infección por SARS-CoV-2. Un paciente tenía una hepatopatía crónica congestiva (caso 1) y otro una patología glomerular crónica no biopsiada, con alta sospecha clínica de nefropatía mesangial IgA (caso 3) como factores predisponentes. Todos, menos el caso índice, mostraron elevación de las cifras de IgA al debut. Durante el seguimiento (cuatro a 10 meses) la recuperación de función renal fue incompleta en el 50% de los casos. Los datos de nuestros pacientes se resumen en la tabla 2.
Vasculitis IgA en nuestro medio
| Caso | Antecedentes | Clínica COVID | Tratamiento COVID | Latencia vasculitis | Clínica vasculitis | Afectación renal | Biopsia renal/cutánea | Tratamiento | Evolución FR | |
|---|---|---|---|---|---|---|---|---|---|---|
| 0 | Varón, 78 añoscaucásico | Consumo enólico moderado, HTA, DL, estenosis aórtica, posible VHB pasado | Neumonía bilateral leve | DolquineLopinavir/ritonavirDexametasonaCeftriaxonaAzitromicinaTocilizumab x1 | 3 semanas | Afectación renalPúrpura cutáneaArtritisIgA al diagnóstico 367 mg/dL | FRA (Cr 1,96 mg/dL)Proteinuria nefrótica (10 g/día)Hematuria (moderada, con dismorfia) | 7 glomérulos: 1 esclerótico, 4 expansión mesangial, 1 sinequia.2 semilunas epiteliales.Depósitos de IgA granular en mesangio.ME: fusión pedicelar y depósitos electrodensos mesangiales. | MP 250 mg x 3Rituximab 750 mgGC orales | 9 meses:Cr 1,13 mg/dLProteinuria 0,62 g/díaMicrohem (5-10 hematíes/campo) |
| 1 | Varón 84 años | ICC dcha con hepatopatía congestiva | Neumonía bilateralTEP segmentario | DolquineKaletraEsteroidesTocilizumabx1CeftriaxonaAzitromicinaO2 c/reservorio | 8 semanas | Afectación renalPúrpura palpable recidivanteIgA al diagnóstico 556 mg/dL (basal 405) | FRA (Cr 5,51 mg/dL)Proteinuria subnefrótica (2g/día)Hematuria macroscópica (25-30 hematíes/campo) | Renal: 16 gl. 8 esclerosados,2 ensanchamiento mesangial, 2 retracción penacho. No semilunas. Focos fibrosis y atrofia tubular; hematíes tubulares intraluminales. Depósitos granulares mesangiales IgA en IF.Cutánea: infiltrado PMN perivascular, IFD+ IgA | MP 250 mgx3GC oralesMP 125 mgx3MFM | 10 meses:Cr 2 mg/dLProteinuria negativaMicrohematuria (3-5 hematíes/campo) |
| 2 | Varón 87 años | VHB pasado? | Dudosa enfermedad intersticial | ¿Amoxicilina? | No confirmado, 2 meses | Afectación renalPúrpura cutáneaIgA al diagnóstico 502 mg/dL | FRA (Cr 3,6 mg/dL)Proteinuria (I Pro/Cr 0,74 mg/mg)Hematuria (25-30 hematíes/campo) | Cutánea: vasculitis leucocitoclástica con depósitos granulares perivasculares IgA | MP 250 mgx3GC orales | 5 meses:Cr 1,07 mg/dL |
| 3 | Mujer 64 años | Patología glomerular previa no biopsiada (sospecha IgA) | Neumonía unilateral | DolquineAzitromicina | 9 meses | Afectación renalIgA al diagnóstico 434 mg/dL | FRA (Cr 3,41 mg/dL)Proteinuria nefrótica (4,3 g/día)Hematuria (10-20 hematíes/campo, con dismorfia) | 7 gl.: 1 esclerosado, 2 semilunas epiteliales, 1 semiluna fibrosa. Engrosamiento mesangial y sinequias con cápsula BowmanIF: depósitos granulares mesangiales IgA, C3, kappa y lambda. | MP 250 mgx5GC oralesCF 500 mg quincenal | 4 meses:Cr 2,4 mg/dLProteinuria 1,33 g/día10-20 hematíes/campo |
Comparativamente con la mayoría de casos publicados, nuestros pacientes mostraron una edad más avanzada al diagnóstico. El daño renal estuvo presente en todos y fue severo, precisando de tratamiento inmunosupresor a dosis altas y de forma prolongada. De los ocho casos publicados, excluido nuestro caso índice, el 75% eran niños y jóvenes y sólo el 50% presentaban afectación renal siendo ésta más leve, con menor necesidad de tratamiento inmunosupresor y en pautas más cortas. Únicamente el caso publicado por Huang et al.4 es superponible a los nuestros: edad avanzada, mayor afectación renal y presencia de patología glomerular previa con mayor cronicidad en la biopsia. La afectación extrarrenal fue frecuente, tanto a nivel cutáneo como digestivo y articular. El periodo de latencia fue mucho más corto, de hecho, muchos de los pacientes publicados mostraron clínica de forma concomitante a la infección. En tres pacientes había factores predisponentes: Allez et al.5 y Jacobi et al.10 describen antecedentes de enfermedad intestinal y Huang et al.4 de glomerulopatía previa. La evolución renal, en los cinco pacientes en que la información estaba disponible, fue favorable.
En conclusión, al igual que otras infecciones, el COVID-19 parece ser un trigger de patología glomerular. En nuestro medio, con predominio de población caucásica de edad avanzada, se ha convertido en la patología glomerular más frecuentemente asociada a esta infección. Todos los pacientes requirieron tratamiento inmunosupresor, dada la presentación clínica y los hallazgos de la biopsia. En la mitad de los casos la recuperación de función renal fue incompleta en la evolución.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.